拟南芥叶片衰老突变体ein3、max2延迟营养生长时相转变
2020-12-31尹晟傅钰龙鸿
尹晟,傅钰,龙鸿
拟南芥叶片衰老突变体延迟营养生长时相转变
尹晟,傅钰,龙鸿通信作者
(天津农学院园艺园林学院,天津 300392)
高等植物营养生长阶段根据能否诱导开花分为前期的幼龄期和后期的成熟期,其转变过程称为营养生长时相转变。营养生长时相转变和营养生长到生殖生长的转变,都是植物生长发育过程中的重要生理过程,均与植物自身发育的时间进程相关,受到一些共同的基因调控,而叶片衰老相关基因在营养生长时相转变中的调控作用仍不明确。本文研究了叶片衰老相关基因和的突变体营养生长时相转变特点。莲座叶叶形、远轴面表皮毛产生时间、叶基角特征等形态观测表明,拟南芥突变体延迟了营养生长时相转变。对植株生长发育不同阶段的、表达水平检测表明,和的表达量分别呈下降和上升的趋势,导致营养生长时相转变延迟。突变体由于叶片衰老进程受到影响,其发育迟缓,暗示和可能通过及表达水平来调控营养生长时相转变。
营养生长时相转变;叶片衰老基因;;;拟南芥
高等植物的营养生长包括幼龄期(juvenile stage)和成熟期(adult phase),从幼龄期到成熟期的转变被称为营养生长时相转变(vegetative phase change,VPC),高等植物只有经历营养生长时相转变,才具备生殖能力,进而完成生活史。
在拟南芥生长过程中,幼龄期植株叶片呈圆形,叶柄较长,叶边缘光滑,表皮毛仅分布在近轴面;当植株从幼龄期开始向成熟期转变,叶片逐渐呈现成熟特征,叶形呈椭圆状,叶柄变短,叶边缘呈锯齿状,近轴面和远轴面上均有表皮毛出现[1]。叶基角在成熟期也比幼龄期明显增大[2]。研究表明,小分子RNA156()及其靶基因(SQUAMOSA Promoter binding protein-like)家族,参与植物的生长发育进程调控,是VPC发生的标记。随着植株的生长发育,表达量逐渐降低,而靶基因表达量逐渐增大,完成从幼龄期到成熟期的转变[3]。
果树生长发育也经历了VPC的过程,果树的幼龄期即为生产上的童期,是指实生树生长到具有开花潜能,采取任何措施都不能人工诱导开花的发育时期。这一时期的长短因树种、环境条件和栽培技术而异,农谚中有“桃三杏四李五年”的说法,由于果树以果实为收获目标,童期是限制果树从实生树到开花结实的重要因素。除不能开花外,童期果树也具有许多与成熟期果树不同的生理和形态特点,如叶缘的形状表现为缺刻,茎上多棘刺等,实生树的童期虽然不能消除,但可缩短。
叶片衰老是植物正常的生理过程。是乙烯信号转导途径中重要的转录因子,能够激活下游的乙烯响应基因[4],进一步影响叶片衰老。是多种植物激素信号转导通路共用的关键因子[5],基因编码一个包含F-box的蛋白质,F-box是泛素E3连接酶复合体的重要组分,通过泛素介导的蛋白水解来控制叶片的寿限,它结合了延迟衰老需要的蛋白并可将其水解[6]。和均参与叶片衰老进程的调控,与植物发育的时间进程相关,但对营养生长时相转变的作用仍不清楚。
本文研究拟南芥突变体的VPC过程,旨在探讨基因对于VPC的影响,为拟南芥中叶片衰老与VPC之间的关联提供试验依据,为进一步探索果树幼龄期(童期)生长发育的基因调控和时相转变提供参考。
1 材料与方法
1.1 试验材料
拟南芥(L.)野生型Col-0种子由天津农学院果树学重点实验室保存。WT- Col背景下的(CS8052)、(CS9565)突变体种子购自美国俄亥俄州立大学的Arabidopsis Biological Resource Center(ABRC)。
1.2 试验方法
1.2.1 植株种植
植株种植方法参见文献[7]。
1.2.2 拟南芥形态学观察
待种子长出子叶后,开始观察记录野生型Col-0及突变体的形态学特征,包括:植株的莲座叶数量,莲座叶叶形及最早出现远轴面表皮毛的叶序数,莲座叶叶长宽比及叶基角,使用DWRuler软件测量叶片及叶柄之间形成的叶基角,并计算植株生长速率。
1.2.3 荧光定量PCR
采用实时荧光定量PCR仪(BIO-RAD CFX96)和大连宝生物荧光定量试剂(SYBR Premix Ex TaqTMⅡ)进行检测。提取野生型及突变体生长发育阶段各时期的叶片组织RNA并反转录为cDNA作样品模板,每个样品重复3次,内参基因为,对植株叶片中调控基因和靶基因的表达进行荧光定量PCR检测。扩增采用颈环法,引物序列:-F:5′-GCTGAGAGATTCAGATGCCCA-3′,-R:5′-GTGGATTCCAGCAGCTTCCATACT-3′,-F:5′-CATCTTGTAGATCTCTGAAGTTG GACT-3′,-R:5′-GAGATTGAGACATA GAGAACGAAGACA-3′,-F:5′-TGAGAA GAAGCAAAGCGGAA-3′,-R:5′-TATCCG CGGTACAACTCTCG-3′。
2 结果与分析
2.1 叶形分析及出现远轴面表皮毛的莲座叶
为分析突变体的VPC进程,课题组进行了野生型及突变体的形态学观察。结果表明,野生型营养生长时间为20 d,莲座叶总数为11片,在第6片莲座叶(第15天)时叶缘出现明显锯齿、叶片伸长并出现远轴面表皮毛;与之相对应,突变体和的营养生长时间分别为28 d和33 d,莲座叶总数分别为15片和14片,分别在第7片(第18天)和第7片(第21天)莲座叶时出现远轴面表皮毛(图1,表1)。这些结果说明,突变体较野生型VPC被延迟。

图1 野生型和突变体ein3、max2的莲座叶叶形图
注:A:野生型莲座叶叶形;B:突变体莲座叶叶形;C:突变体莲座叶叶形。箭头示出现远轴面表皮毛,标尺=1 cm

表1 野生型和突变体ein3、max2莲座叶发育状况比较
注:营养生长时间指从播种日期到植株出现可见花芽的时间。与野生型分别进行对比,用检验法对统计结果进行差异显著性分析,*代表差异显著(0.01<≤0.05),**代表极差异显著(0.01)。下同
2.2 叶片长宽比
为进一步分析突变体的VPC进程,测量并计算了野生型与突变体的叶片长宽比。结果表明,野生型及突变体的莲座叶长宽比均呈上升趋势,其中野生型在第6片长宽比明显增大后趋于稳定上升,说明此时发生VPC;而突变体均在第7片长宽比明显增大后趋于稳定上升(图2A,2B),说明突变体在此时发生VPC,比野生型VPC延迟。

图2 野生型和突变体ein3、max2叶片长宽比值
注:A、B折线图分别为对应生长时期的野生型与突变体的莲座叶叶片长宽比
2.3 叶基角变化
通过测量并计算野生型和突变体莲座叶叶片叶基角发现,在植株生长过程中,其叶片基角也随之发生变化。选取第3、5、7、9片莲座叶,测量并计算其叶片基角进行差异比较。在第5和第7片莲座叶,野生型叶基角分别为121.45°和126.58°,突变体分别为108.16°、115.27°;突变体分别为104.23°、114.60°(表2),突变体叶基角均明显小于野生型,说明突变体与野生型相比均发生VPC延迟。

表2 野生型与突变体ein3、max2植株叶片基角的比较
2.4 miR156及SPL3表达分析
q-PCR结果显示,随着植株的生长发育,野生型和突变体各发育阶段的表达量均呈下降的趋势(图3),野生型在第15天时表达量显著下降,突变体和分别在19天(图3A)和21天(图3B)时表达量明显下降,突变体中表达量均比野生型高。此外,野生型和突变体各发育阶段的表达量均呈上升趋势(图3),野生型在第15天时表达量显著上升约3倍,突变体的表达量均比野生型低,突变体和分别在第19天(图3C)和第21天(图3D)时表达量显著上升约2倍,随后持续增长,直至分别生长到第28天(图3C)、33天(图3D)出现花芽时达到峰值,说明突变体和2分别在第18天和第21天发生VPC,对比野生型发生VPC时间(第15天),突变体均发生VPC时间延迟。
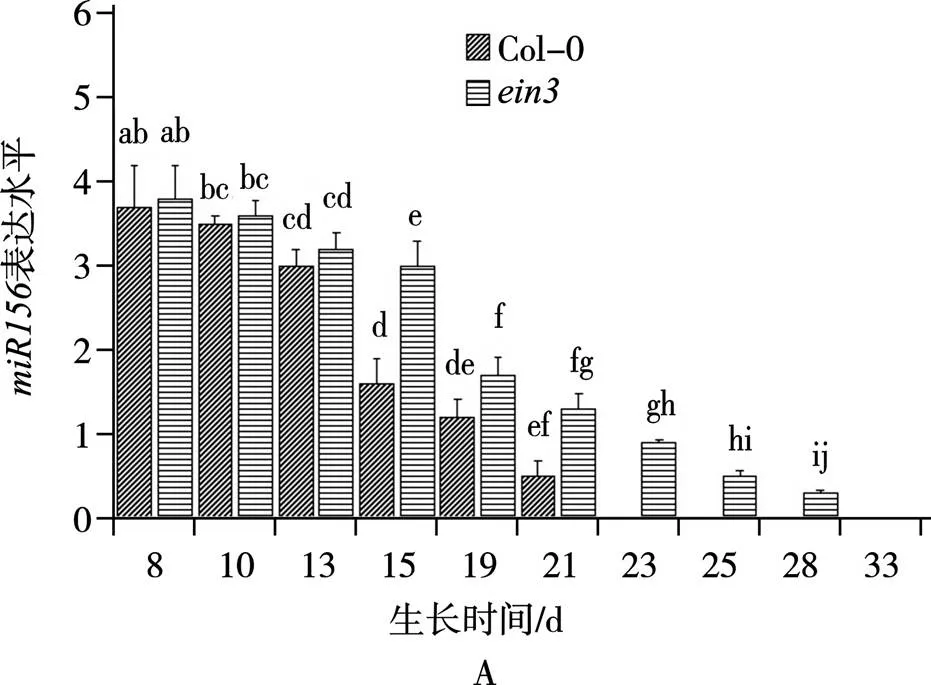

图3 突变体ein3、max2中miR156和SPL3的表达水平q-PCR检测
注:A和B为和中的表达水平;C和D为和中的表达水平
3 讨论与结论
营养生长时相转变是植物生长发育中的一个重要生理过程,也是必不可少的阶段,其遗传调控机理尚不完全清楚。一类小分子RNA,、等作为植物发育时间进程的调节因子,不仅在植物的VPC过程中起作用,也在成花诱导中起作用[8-11]。研究表明,通过抑制10个基因起作用,超表达植株显示,这些基因调控植物发育和生理的许多方面,和对VPC和营养生长至生殖生长时相转变起作用,和则对花分生组织转变起作用[12]。此外,通过作用于细胞核中的信号因子参与调控VPC[13]。本研究也表明,通过和协同作用,参与调控和的VPC和成花转变。
叶片生长是营养生长的正常过程,随植株生长发育,叶片在衰老过程中,一些叶片衰老相关基因被激活后,表达增强,参与叶片衰老调控,包括和[14]。作为乙烯信号转导途径中的一个关键因子,对乙烯反应起正调控作用,促进叶片衰老;则延迟衰老相关蛋白水解,同样促进衰老。突变体和中,叶片数目比野生型增多,可能是叶片衰老延迟的表现。拟南芥VPC产生过程中,远轴面表皮毛的产生是一个形态学标志,但其分子机制仍不清楚。最近研究表明,由于()中的3'非编码区域的G突变为A,加速了远轴面表皮毛的产生。一个作用于调控途径下游的类转录因子蛋白TOE1抑制了基因表达[15]。可见,远轴面表皮毛的产生与调控途径相关。本研究中,突变体远轴面表皮毛的产生与基因表达调控VPC进程结果相一致,说明突变体VPC延迟的同时,也从一个侧面说明远轴面表皮毛的产生与基因表达调控存在相关性。
植株在生长发育过程中,器官形态上的变化受到基因表达的调控,营养生长是由细胞内外因子调控蛋白来调控的一个多细胞协同生长的过 程[16]。研究表明,在植物茎发育早期中积累于茎端分生组织中起作用,而基因则通过抑制()基因表达来调控分生组织的大小,和基因共同作用,调控植物生长发育的时间进程[17]。和基因共同作用,依靠表达量上的阈值(Threshold)来调控VPC进程[18],这与课题组的q-PCR检测结果一致。前期工作也表明,通过茎端分生组织的形态变化来调控VPC的过程[19]。
VPC是一个综合调控的结果,是植物随生长发育时间进程而产生的生理过程,从渐进到量变,具有累积效应。和基因是VPC进程的调控主线(main pathway),其他与发育时间相关的基因以及表观遗传因子[20-22]也可能参与其中,这有待更多的试验验证。
[1] TELFER A,BOLLMAN K M,POETHIG R S. Phase change and the regulation of trichome distribution in[J].Development,1997,124(3):645-654.
[2] LI S,YANG X,WU F,et al. HYL1 controls themiR156- mediated juvenile phase of vegetative growth[J]. Journal of Experimental Botany,2012,63(7):2787-2798.
[3] WU G,POETHIG R S. Temporal regulation of shoot development inbyand its target[J]. Development,2006,133(18):3539-3547.
[4] 徐倩,殷学仁,陈昆松. 基于乙烯受体下游转录因子的果实品质调控机制研究进展[J]. 园艺学报,2014,41(9):1913-1923.
[5] STIMBERG P,FURNER I J,LEYSER H M O. MAX2 participates in an SCF complex which acts locally at the node to suppress shoot branching[J]. Plant Journal,2007,50(1):80-94.
[6] WOO H R,CHUNG K M,Park J Het al. ORE9,an F-box protein that regulates leaf senescence in[J]. Plant Cell,2001,13(8):1779-1790.
[7] 卢阳,龙鸿. 拟南芥叶片数目变化突变体对营养生长时相转变的影响[J]. 植物学报,2015,50(3):331-337.
[8] CAO D,LI Y,WANG J,et al. GmmiR156b overexpression delays flowering time in soybean[J]. Plant Molecular Biology,2015,89:353-363.
[9] GUO C,XU Y,SHE M,et al. Repression of miR156 by miR159 regulates the timing of the juvenile-to-adult transition in[J]. The Plant Cell,2017,29:1293-1304.
[10] FENG S,XU Y,GUO C. Modulation of miR156 to identify traits associated with vegetative phase change in tobacco()[J]. Journal of Experimental Botany,2016,67(5):1493-1504.
[11] LEICHTYA A R,POETHIG R S. Development and evolution of age-dependent defenses in ant-acacias[J]. Proceedings of the National Academy of Sciences of the United States of America,2019,116(31):15596-15601.
[12] XU M,HU T,ZHAO J,et al. Developmental functions of miR156-regulated()genes in[J]. PLOS Genetics,2016,12(8):e1006263.
[13] ZHANG H,ZHANG L,HAN J,et al. The nuclear localization signal is required for the function of squamosal promoter binding protein‑like gene 9 to promote vegetative phase change in[J]. Plant Molecular Biology,2019,100:571-578.
[14] GAN S,AMASINO R M. Making sense of senescence:molecular genetic regulation and manipulation of leaf senescence[J]. Plant Physiology,1997,113:313-319.
[15] XU Y,QIAN Z,ZHOU B,et al. Age-dependent heteroblastic development of leaf hairs in[J]. New Phytologist,2019,224:741-748.
[16] SALEM M A,LI Y,BAJDZIENKO K,et al. RAPTOR controls developmental growth transitions by altering the hormonal and metabolic balance[J]. Plant Physiology,2018,177:565-593.
[17] FOURACREA J P,POETHIG R S. Role for the shoot apical meristem in the specification of juvenile leaf identity in[J]. Proceedings of the National Academy of Sciences of the United States of America,2019,116(20):10168-10177.
[18] HE J,XU M,WILLMANN M R,et al. Threshold- dependent repression ofgene expression by miR156/miR157 controls vegetative phase change in[J]. PLOS Genetics,2018,14(4):e1007337.
[19] 郭蕊,傅钰,马婉琪,等. 拟南芥生物钟突变体延迟营养生长时相转变[J]. 生物学杂志,2018,35(3):15-18.
[20] XU Y,GUO C,ZHOU B,et al. Regulation of vegetative phase change by SWI2/SNF2 chromatin remodeling ATPase BRAHMA[J]. Plant Physiology,2016,172:2416-2428.
[21] XU M,HU T,SMITH M R,et al. Epigenetic regulation of vegetative phase change in[J]. The Plant Cell,2016,28(1):28-41.
[22] XU Y,ZHANG L,WU G. Epigenetic regulation of juvenile-to-adult transition in plants [J]. Frontiers in Plant Science,2018,9:1048.
The vegetative phase changedelay by leaf senescence related mutantsand
Yin Sheng, Fu Yu, Long HongCorresponding Author
(College of Horticulture and Landscape, Tianjin Agricultural University, Tianjin 300392, China)
In higher plants, vegetative phase change refers to the transition from juvenile to adult phase, and after that plants can blossom. The vegetative phase change and the transition from vegetative growth to reproductive growth are important physiological processes in plant growth and development. Both processes are related to the timespan of plant development, sharing some regulated genes. However, regulation of leaf senescence related genes during this transition remains unknown. This study investigated the characteristics of vegetative phase change via leaf senescence related mutantsand. Morphological observations of rosette leaf shape, onset of abaxial trichomes, blade base angles showed that vegetative phase change was delayed inandExpression levels ofandat different stages ofplant development showed down-regulated and up-regulated trend,leading toa delayed vegetative phase change.Compared with wild types, mutant plants developed slowly, due to the ongoing leaf senescence. The data suggested thatandmay play a role in regulating plant vegetative phase change through expression levels ofand.
vegetative phase change;leaf senescence gene;;;
1008-5394(2020)04-0007-05
10.19640/j.cnki.jtau.2020.04.002
Q945.4
A
2020-04-02
天津农学院研究生培养质量提升项目(101018)
尹晟(1994—),男,硕士在读,主要从事果树遗传方面的研究。E-mail:554182342@qq.com。
龙鸿(1964—),男,教授,博士,主要从事果树遗传、发育生物学的研究。E-mail:longhong@tjau.edu.cn。
责任编辑:杨霞
