三价镧锕离子与三种18-冠-6配体的络合行为
2020-12-30李游祯王建晨
李游祯,王建晨,陈 靖,徐 超
清华大学 核能与新能源技术研究院,北京 100084
冠醚是一类重要的超分子主体化合物,对多种类型的金属离子具有络合能力,广泛应用于配位化学、萃取化学、分析化学等众多领域[1]。其中,冠醚与f区元素(含f电子,包括镧系元素和锕系元素)可以形成各种结构的配合物[2-3],从而产生独特的识别能力,并可应用于f区元素的分离[4-5]。冠醚环大小、供体原子的种类和数量以及取代基等因素会改变冠醚的空间结构、孔径大小、电子云密度等,并最终影响其与金属离子的主客体相互作用。部分冠醚类配体的结构示意图示于图1。例如,二环己基-18-冠-6和U(Ⅵ)形成1∶1包合物[4],而12-冠-4及15-冠-5-醚和U(Ⅵ)则可以形成1∶1半包合物或2∶1夹心型配合物[6-7]。最近,Hu等[3]通过在氮杂18-冠-6上接上吡啶甲酸基团,获得了对镧系系列元素具有特殊选择性的配体,其对离子半径较大的轻镧系离子和半径较小的重镧系离子配位作用强,而对半径介于之间的中镧系离子配位作用则较弱。
研究冠醚类配体和f区元素离子的基本络合行为对于设计用于f区元素分离的新型配体及深入理解f区元素的配位特性具有重要意义。许多热力学和光谱学方法,如微量热、吸收光谱和荧光光谱等可以用于络合反应的基础热力学研究,获得络合模式等结构信息及络合稳定常数(lgK)、焓变(ΔH)和熵变(ΔS)等热力学数据[8]。对冠醚类配体和f区元素离子络合模式和络合热力学参数的比较和分析可帮助我们深入了解各种因素对络合反应的影响,从而利于更好地筛选和设计功能冠醚配体用于f区元素离子的分离。需要指出的是,目前在同一介质体系中系统测量冠醚类配体与f区元素离子络合热力学参数的工作还较少[9-13]。
图1 冠醚类配体的结构示意图Fig.1 Structures of crown ether ligands discussed
本工作拟以Nd3+作为三价镧系离子的代表,综合运用光谱学、微量热学等研究手段,测定Nd3+与三种结构渐变的18-冠-6配体:18-冠-6(18C6)、苯并-18-冠-6(Bz18C6)、二苯并-18-冠-6(DB18C6)(图1)在乙腈介质中络合的热力学参数,分析络合过程的驱动力及物种组成,系统考察苯基取代基对络合反应的影响。另外,本工作还基于密度泛函理论(DFT)优化气相中Nd3+和Am3+与冠醚形成的配合物的结构,计算络合反应的吉布斯自由能,结合实验获得的热力学数据,进一步探究苯环取代基对冠醚络合能力的影响,并比较冠醚对Nd3+和Am3+的络合能力。
1 实验部分
1.1 试剂与仪器
无水高氯酸钕,通过将稍过量的Nd2O3(纯度>99%)溶于高氯酸、过滤、干燥得到;18-冠-6(18C6,纯度>99%)、苯并-18-冠-6(Bz18C6,纯度>97%)、二苯并-18-冠-6(DB18C6,纯度>98%),使用前未做进一步纯化;超干乙腈,纯度为99.9%,含水量小于30 mg/L。以上试剂均购于北京百灵威科技有限公司。
Cary6000i型紫外-可见-近红外光谱仪,安捷伦科技有限公司;TAM Ⅲ型微量热滴定仪,美国TA公司。
1.2 紫外-可见吸收光谱滴定
Nd3+的吸收光谱滴定实验均在(25.0±0.1) ℃下进行。取2.2 mL 2 mmol/L Nd3+的乙腈溶液于10 mm石英比色皿中,逐滴加入15 mmol/L冠醚的乙腈溶液,搅拌2 min,待反应充分平衡后收集560~620 nm范围内的吸收光谱(扫描间隔0.2 nm,积分时间0.4 s)。光谱数据扣除基线后导入HypSpec 软件处理[14],拟合得到配合物的物种信息及络合平衡常数(lgK)。
1.3 等温微量热滴定
以850 μL乙腈为参比,将700 μL 2 mmol/L Nd3+的乙腈溶液置于量热计内的反应池中,通过高精度输送泵逐滴加入15 mmol/L冠醚的乙腈溶液,每次滴加5 μL,间隔时间8 min,共滴加25 次,样品搅拌转速为80 r/min,量热仪反应池温度控制在25 ℃。热信号包含金属离子与配体络合反应热、溶液的稀释热、去溶剂化热等信息。将得到的热谱数据在NanoAnalyze软件中处理并扣除稀释热,之后导入到HypDeltaH软件中,结合光谱滴定获得的络合稳定常数,拟合得到反应焓变(ΔH),并进一步计算得到反应熵变(ΔS)。
2 结果与讨论
2.1 紫外可见吸收光谱
在乙腈体系中进行了三种冠醚配体与Nd3+络合的紫外可见吸收光谱滴定实验,结果示于图2(a)—(c)。由图2(a)—(c)可知,三个冠醚配体体系中Nd3+的吸收光谱变化类似:随着冠醚配体的不断加入,Nd3+于577 nm处的吸收峰强度不断降低,配体与Nd3+摩尔浓度比大于1后光谱变化较小。上述光谱变化表明,Nd3+与三种冠醚配体在乙腈中均发生了明显的络合反应。对光谱进行拟合分析,结果表明,Nd3+与三种冠醚配体均生成化学计量比为1∶1的配合产物,拟合得到的络合稳定常数(lgK)列入表1。图2(d)—(f)为拟合得到的滴定过程中不同Nd物种的摩尔吸收光谱。从图2(d)—(f)可以看出,18C6、Bz18C6和DB18C6与Nd3+所形成的1∶1配合物的吸收峰在形状和位置上都十分接近,表明Nd3+在三种配合物中的配位环境较为类似。另外,相比乙腈溶剂中自由Nd3+的吸收光谱,Nd3+和冠醚配合物的吸收均有所减弱,同时吸收光谱还发生了较为明显的裂分,表明Nd3+所处的配位场和配位环境对称性发生了明显改变[15-16]。
2.2 等温微量热分析
进一步,在乙腈体系中分别进行了三种冠醚配体与Nd3+络合的量热滴定实验,结果示于图3(a)—(c)。由图3(a)—(c)可知,随着冠醚配体的不断加入,络合反应持续吸热(热信号为负值)。18C6和Bz18C6与Nd3+的络合滴定中,当配体与Nd3+摩尔浓度比在1左右时热信号迅速降低至本底;而DB18C6与Nd3+络合反应的吸热过程则持续更长,在配体与Nd3+摩尔浓度比接近2时,热信号才逐渐降低至本底。通过以上过程,可初步推断18C6和Bz18C6与Nd3+的络合作用强于DB18C6。利用光谱滴定确定的络合模式及络合稳定常数对量热结果进行了拟合(图3(d)—(f))。
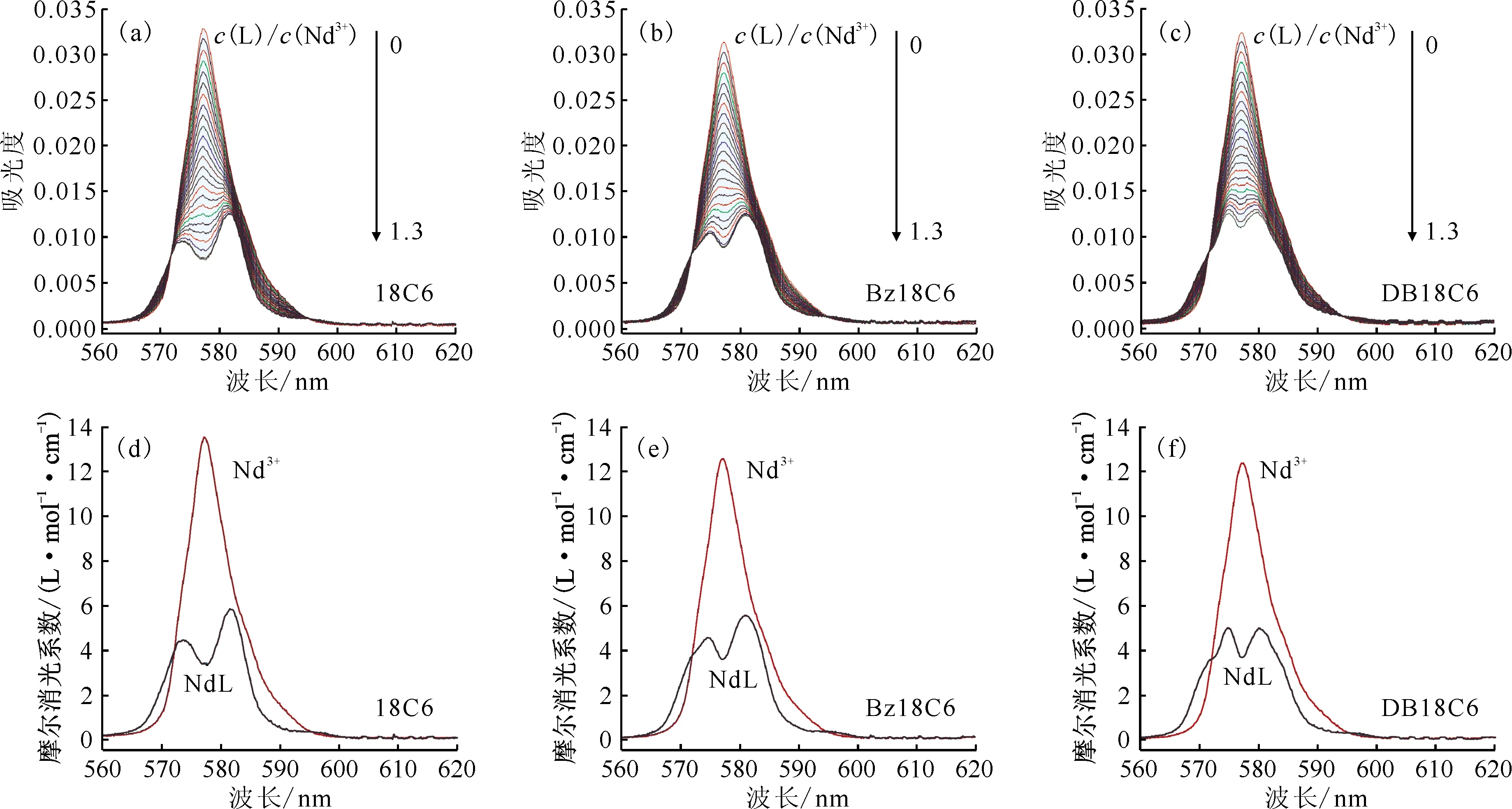
L代表冠醚配体图2 乙腈体系Nd3+与冠醚系列配体紫外光谱滴定的实验结果(a—c)和摩尔吸收光谱拟合结果(d—f)Fig.2 Experimental(a-c) and molar absorptivity fitting(d-f) results of spectrophotometric titrations of Nd3+ with 18C6, Bz18C6 and DB18C6 in acetonitrile

Llg KΔH/(kJ·mol-1)ΔS/(J·mol-1·K-1)18C66.41±0.0519.1±0.6204±3Bz18C65.78±0.0620.1±0.6194±3DB18C64.20±0.0240.7±0.5237±2
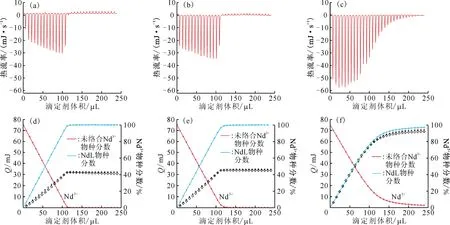
(a)、(d)——18C6,(b)、(e)——Bz18C6,(c)、(f)——DB18C6 ◇——实验值,+——计算值图3 乙腈体系Nd3+与冠醚系列配体量热滴定结果(a—c)和拟合结果(d—f)Fig.3 Microcalorimetric titrations(a-c) and fitting results(d-f) of Nd3+ with 18C6, Bz18C6 and DB18C6
2.3 络合热力学分析
三种冠醚配体与Nd3+在乙腈溶剂中的络合热力学参数汇总于表1。从表1可以看出:三种配体与Nd3+络合能力大小顺序为18C6>Bz18C6>DB18C6,即随着18-冠-6中苯基取代基的增加,其与Nd3+的络合能力逐渐减弱。苯基取代基对于Nd3+络合反应的影响可能主要体现在两个方面:一是苯环的加入会使得冠醚环的刚性增强,影响冠醚与Nd3+的尺寸匹配;二是苯环的吸电子效应会减弱相邻配位O原子的电子密度,从而减弱冠醚环O原子和Nd3+的静电相互作用。
Nd3+与三种冠醚配体的络合均为吸热、熵增反应,络合主要通过熵驱动。推测这一热力学变化过程主要是由于络合前后金属离子和冠醚配体的溶剂化变化引起。乙腈分子与Nd3+通过离子-偶极相互作用形成弱配位结构,而乙腈分子和冠醚具有较强的氢键作用和范德华力作用,形成较为规整的溶剂化冠醚结构[17-18]。Nd3+和冠醚配体络合过程中,乙腈分子和Nd3+及冠醚的相互作用均被破坏,体系吸热;同时,部分溶剂化的乙腈分子释放到自由溶剂环境中,体系混乱度增大,使得熵增加。
2.4 DFT计算
采用DFT计算对三种冠醚配体和Nd3+及Am3+在气相中的络合行为进行了研究。计算使用Gaussian09 软件[19],采用B3LYP 杂化泛函[20]。对C、H、O原子使用6-31G*基组;对Am 使用ECP60MWB赝势以及相应的(14s13p10d8f6g)/[10s8p5d4f3g]基组[21-22];对Nd 使用ECP28MWB赝势以及相应的(14s13p10d8f6g)/[10s9p5d4f3g]基组[23-24]。首先,优化得到了配合物的配位结构,结果示于图4。由图4可知:冠醚配体与Nd3+或Am3+络合后,冠醚环上的六个O原子并不在一个平面,而是和金属离子交错进行配位,这与文献[25-27]中报道的水合Nd3+-18C6离子的扭曲平面配位结构一致。当冠醚环上含有苯环取代基时,冠醚环刚性增加,苯基的平面共轭结构限制了相邻配位O原子的配位构型,不利于冠醚环上六个配位O原子采取优势构象与Nd3+或Am3+配位,导致18C6、Bz18C6、DB18C6与Nd3+或Am3+的配合物稳定性依次降低。三种冠醚配体与Nd3+或Am3+配合物的键长数据(表2)表明,苯基取代使得冠醚环上与苯基相邻的部分O原子与金属离子的键长显著增加,相互作用力减弱。
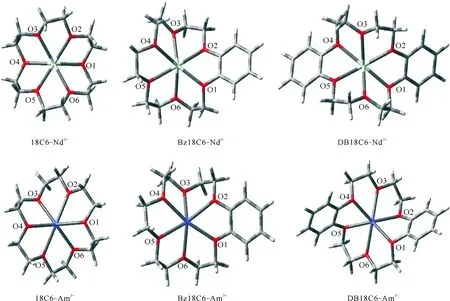
图4 Nd3+及Am3+与18C6系列配合物的优化结构Fig.4 Optimized structures of crown ethers-Nd3+ and crown ethers-Am3+ complexes
为了进一步比较上述配合物的相对稳定性,分别计算了络合反应吉布斯自由能,结果列入表3。由表3可知:冠醚对金属离子的络合能力随冠醚环上苯基取代基的增加而降低,与吸收光谱滴定实验测得的相对络合强度结果相符。另外,对比相同冠醚配体与Nd3+及Am3+的吉布斯自由能可以看出,Nd3+更易与冠醚络合,这可能是由于Nd3+的离子半径略大于Am3+(其离子半径分别为100 pm和99 pm[28]),使得Nd3+更易与更大的冠醚空腔(130~160 pm)进行尺寸匹配所致。如表2所示,相同冠醚配合物中Nd-O键长稍短于Am-O,进一步证明Nd3+比Am3+与冠醚配体有更好的尺寸匹配和更强的相互作用。需要指出的是,总体上Nd3+和Am3+与相同冠醚配体形成配合物的种类、结构、吉布斯自由能等均比较接近。实验研究冠醚配体与Nd3+的络合行为对理解其与Am3+的络合行为具有一定参考价值。
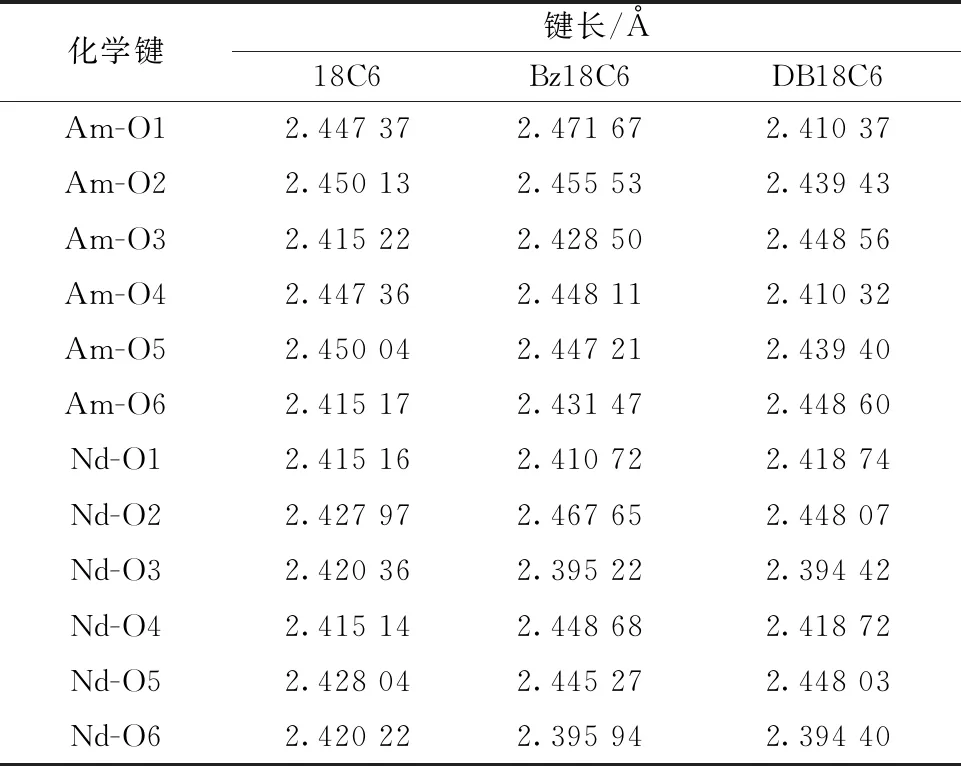
表2 18C6系列配体与Nd3+、Am3+配合物的键长Table 2 Bond length in crown ethers-Nd3+ and crown ethers-Am3+ complexes

表3 DFT计算得到的18C6系列配体与Nd3+、 Am3+配位的吉布斯自由能Table 3 Gibbs free energy for crown ethers-Nd3+ and crown ethers-Am3+ complexes from DFT calculations
3 结 论
无水乙腈体系中,Nd3+与三种结构渐变的18C6冠醚配体均生成1∶1配合物。运用紫外可见吸收光谱滴定和量热滴定的方法获得了络合反应的络合常数和焓变、熵变等热力学参数。实验结果表明,随着冠醚配体中苯基取代基数目的增加,冠醚环刚性增强,部分O原子配位能力减弱,导致其与Nd3+的络合能力变弱。络合反应均为吸热反应,焓变不利于络合反应进行,反应主要由熵驱动。基于密度泛函理论计算获得了配合物的优化结构和相对络合强度,结果与实验一致。Nd3+或Am3+与相同冠醚配体络合时,Nd3+与配体的络合能力更强,但总体上二者与相同冠醚配体生成配合物的结构和性质接近。
