非小细胞肺癌十基因突变联合检测分析
2020-12-30代洁左卓郭鹏谭化姣廖琼
代洁,左卓,郭鹏,谭化姣,廖琼
610041 成都,四川省肿瘤医院·研究所,四川省癌症防治中心,电子科技大学医学院 病理科
肺癌是全世界发病率和死亡率均为最高的肿瘤[1]。非小细胞肺癌(non-small cell lung cancer,NSCLC)是我国肺癌的主要病理类型,占肺癌患者总数的80%~85%,5年生存率低于15%[2]。50%肺癌患者确诊时已是晚期,传统的治疗方法总体预后较差[3]。随着肿瘤分子生物学的发展,针对NSCLC常见驱动基因(如EGFR、ALK、ROS1、RET、BRAF、HER2和MET等)靶向治疗药物奥希替尼、克唑替尼、卡博替尼、曲美替尼、达拉非尼、阿法替尼等上市,肺癌患者中位生存期明显延长,疗效得到显著改善[4-5]。因此,传统的单基因检测已经不能满足肺癌患者的需求,需要一次性对NSCLC多个驱动基因进行同时检测,以指导个性化的肺癌靶向治疗。有鉴于此,本研究收集406例NSCLC患者样本,采用ARMS法进行EGFR、ALK、ROS1、RET、KRAS、NRAS、PIK3CA、BRAF、HER2和MET十基因联合检测,评估各基因的突变频率,分析其与临床病理特征间的关系,以期为临床医生合理选择治疗方案、实施个体化治疗提供有力的证据。
1 材料与方法
1.1 临床资料
收集2019年5月至2019年10月四川省肿瘤医院病理确诊为NSCLC、同时有足够的肿瘤细胞进行后续分子病理检测的样本406例,其中福尔马林固定石蜡包埋组织400例,细胞涂片6例;男性216例,女性190例;患者年龄35~89岁,中位年龄为62岁;肺腺癌357例,鳞癌37例,腺鳞癌8例,未分类4例;原发灶317例,转移灶86例,未明确3例。样本类型包含细胞学样本、冰冻后组织、穿刺样本和手术切除样本,其中细胞学31例(细胞块25例、细胞涂片6例)、冰冻后组织148例、穿刺样本145例、手术切除样本47例和未明确(外院会诊组织)35例。
1.2 肿瘤组织DNA、RNA的提取及ARMS法荧光定量PCR检测
肿瘤组织石蜡样本进行连续切片,切片厚度8 μm,根据肿瘤大小取3~5片置于1.5 mL EP管内,细胞涂片直接刮片,每个肿瘤样本总共收集2管,分别用于DNA和RNA的提取。组织DNA、RNA提取试剂盒、EGFR、ALK、ROS1、RET、KRAS、NRAS、PIK3CA、BRAF、HER2联合检测试剂盒和MET突变检测试剂盒均为厦门艾德公司生产,具体操作步骤严格参照试剂盒说明书进行,本实验室荧光定量PCR仪为Stratagene Mx3000P,DNA和RNA浓度由Merinton SMA4000分光光度计测定。
1.3 统计学方法
采用SPSS 17.0软件进行统计学分析基因突变与患者年龄、性别、组织学类型、是否转移、标本类型等临床病理的相关性,卡方检验、Pearson卡方检验及Fisher精确检验分析是否具有统计学意义,以P<0.05为差异有统计学意义。
2 结 果
2.1 NSCLC中驱动基因突变的分布
406例标本中,十种驱动基因的总突变率为73.2%(297/406)。EGFR总突变率为51.0%(207/406),在十种基因中突变频率最高,KRAS基因突变率为9.6%(39/406),位居第二,ALK融合频率为6.2%(25/406),居第三位,ROS1融合、RET融合、NRAS、PIK3CA、BRAF、HER2和MET14号外显子跳跃突变率分别为2.5%(10/406)、2.2%(9/406)、0.2%(1/406)、2.2%(9/406)、1.0%(4/406)、2.2%(9/406)、0.7%(3/406)(图1A)。
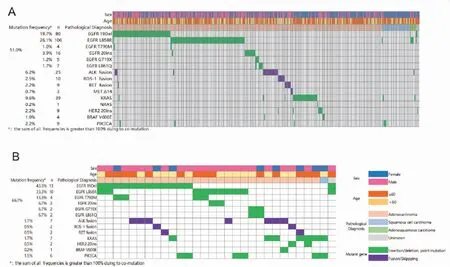
图1 突变分布
在检出突变的297例样本中,有30例样本为双位点共突变(图1B),突变类型丰富多样,多达18种,其中包括L858R/T790M 2例、L858R/20-INS 2例、L858R/ALK1例、L858R/PIK3CA2例、L861Q/G719X 2例、19Del/L858R 3例、19Del/T790M 2例、19Del/ALK3例、19Del/KRAS1例、19Del/PIK3CA2例、19Del/RET1例、19Del/ROS11例、ALK/KRAS2例、ALK/BRAF1例、KRAS/HER21例、KRAS/PIK3CA2例、RET/KRAS1例和ROS1/HER21例(表1)。与单基因突变的患者相比,双突变患者中女性占比更高(73.0%vs53.0%,P=0.034,表2),病理亚型及年龄与共突变发生率无关。
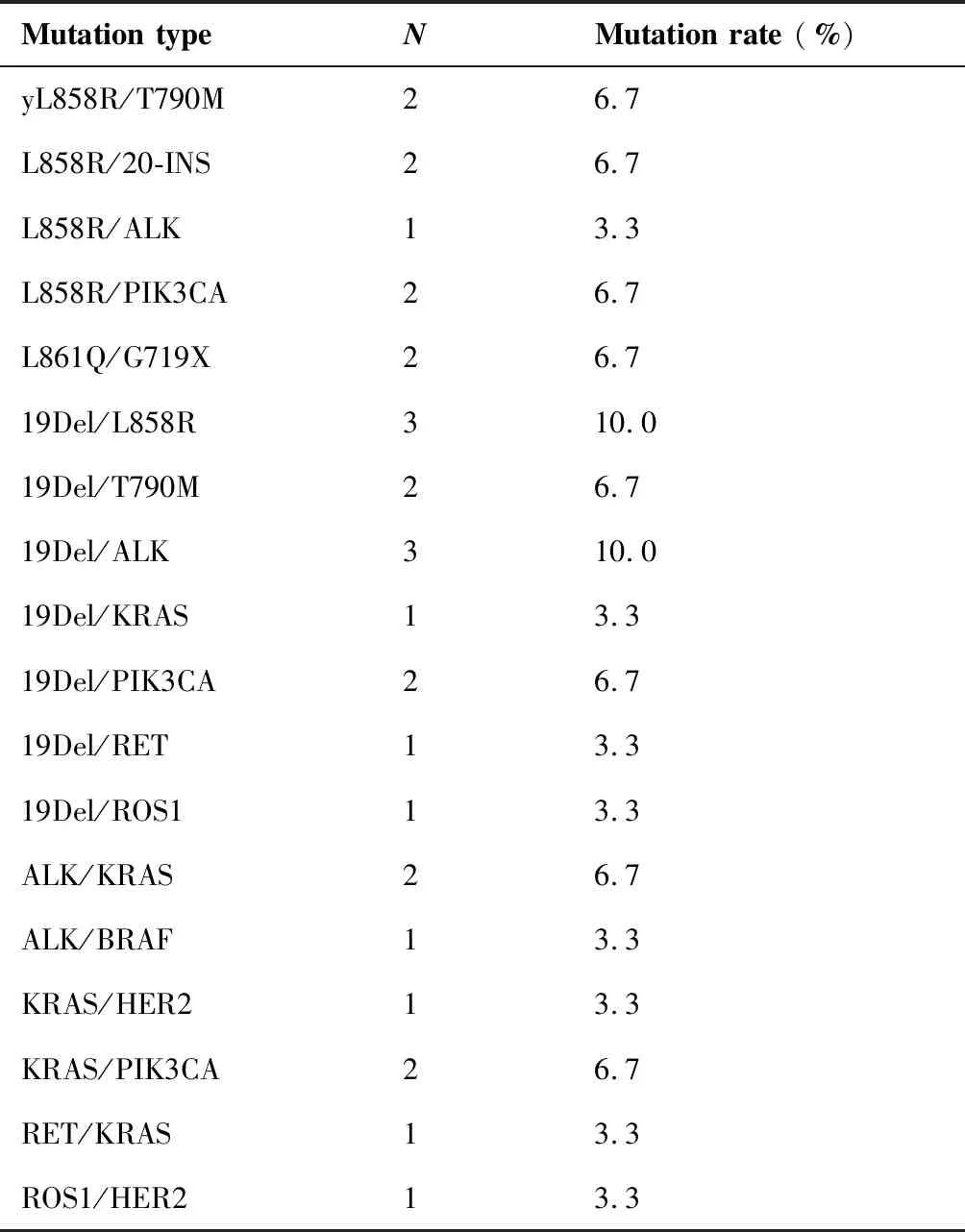
表1 NSCLC患者十联检双点突变类型及比例
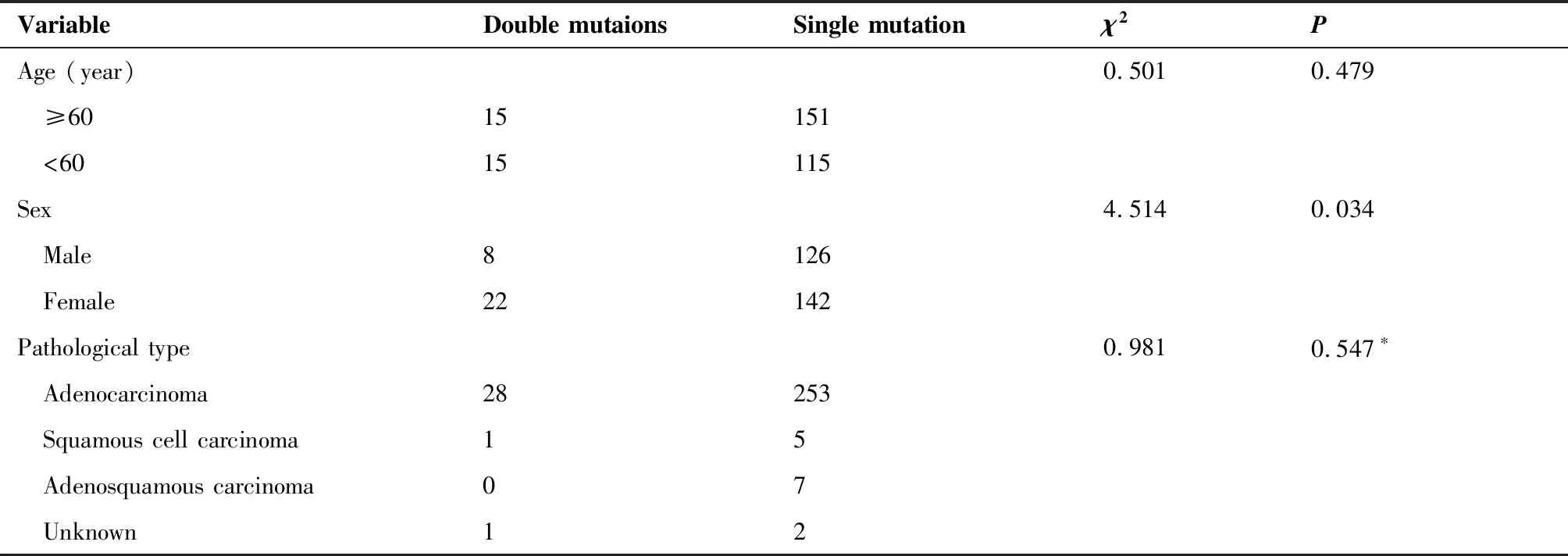
表2 双突变患者与单突变患者的特征比较
2.2 EGFR基因各位点突变情况
本次检测发现EGFR基因突变的例数为207例,占总检出率的51.0%(207/406),突变频率最高,其中包括单点突变196例,双突变11例。单突变中L858R的突变例数最多,为99例,其次为19Del(75例)、20-INS(14例),还检测到稀有突变G719X 3例和L861Q 5例。而在EGFR双突变中,19Del+L858R为3例,19Del+T790M、L858R+T790M、L858R+20ins及G719X+L861Q共突变均各为2例(图2)。
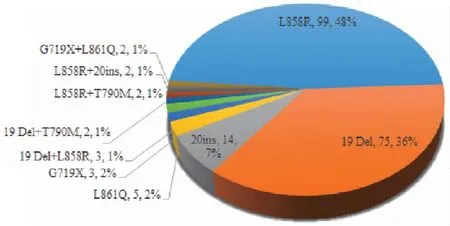
图2 EGFR突变分布饼图
2.3 NSCLC驱动基因突变与临床病理特征的相关性
驱动基因突变与临床病理特征的相关性分析如表3所示:在性别分布方面,EGFR 在女性患者中的突变频率高于男性,差异有统计学意义(67.4%vs36.6%,P<0.001),HER2 20ins同样好发于女性,差异有统计学意义(4.2%vs0.5%,P< 0.01)。KRAS则相反,男性患者中的KRAS突变频率高于女性(14.4%vs4.2%,P< 0.001)。在年龄分布方面,ROS1融合突变在年龄低于60岁患者中发生率显著高于60岁以上的人群,差异有统计学意义(0.5%vs0.4%,P< 0.01)。在NSCLC患者病理组织学分型方面,EGFR突变在腺癌中的发生率为56.5%,显著高于鳞癌(2.7%,P<0.001)。
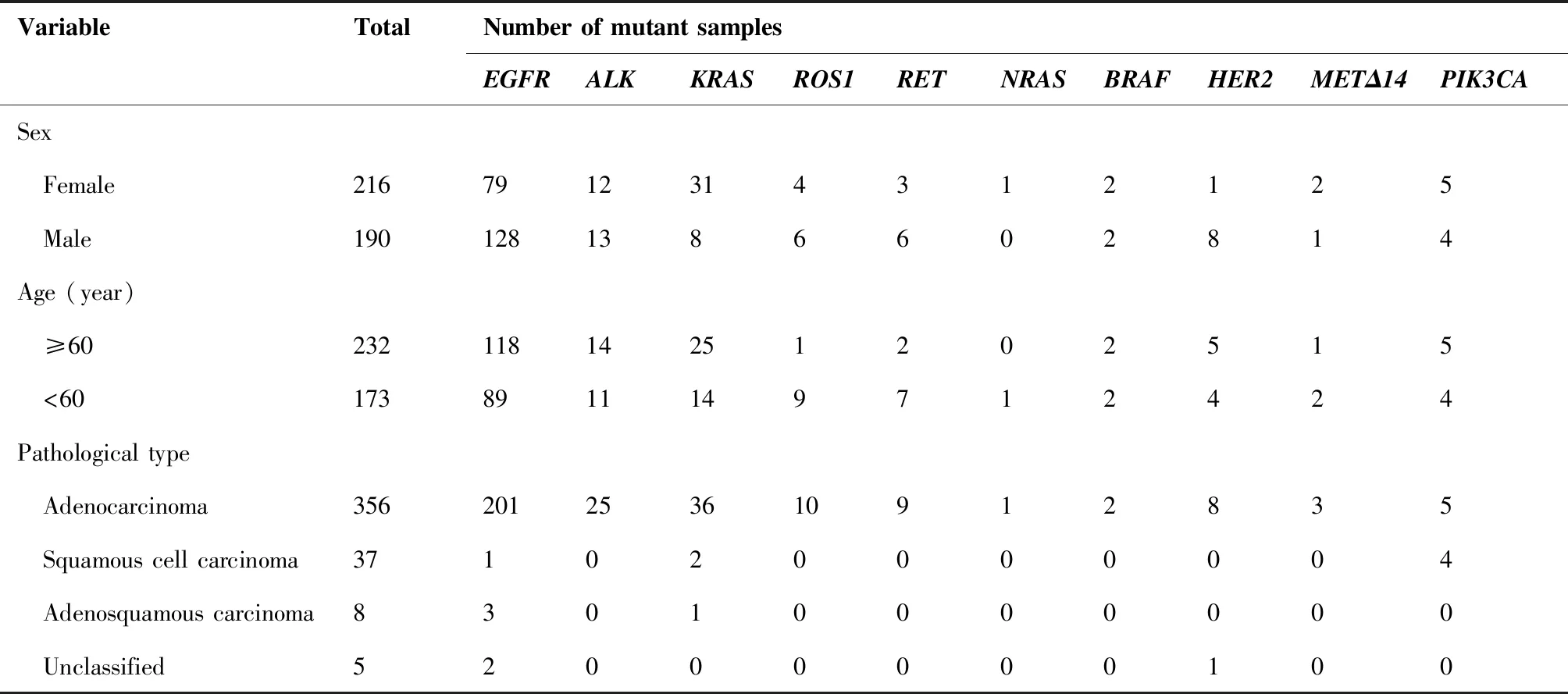
表3 驱动基因突变与临床病理特征的相关性
不同来源样本驱动基因突变检出率如表4所示:原发灶的突变检出率为72.2%,转移灶中的突变检出率为75.6%,二者差异无统计学意义(P=0.536)。总体而言,不同取材方法之间驱动基因的检出率存在差异,其中冰冻后样本检出率最高(81.8%,121/148),其次是细胞学样本(77.4%,24/31),第三为手术样本(70.2%,33/47),穿刺样本检出率最低(64.8%,94/145)。两两相比发现,冰冻样本驱动基因检出率显著高于穿刺样本(81.8%vs64.8%,P=0.001)。
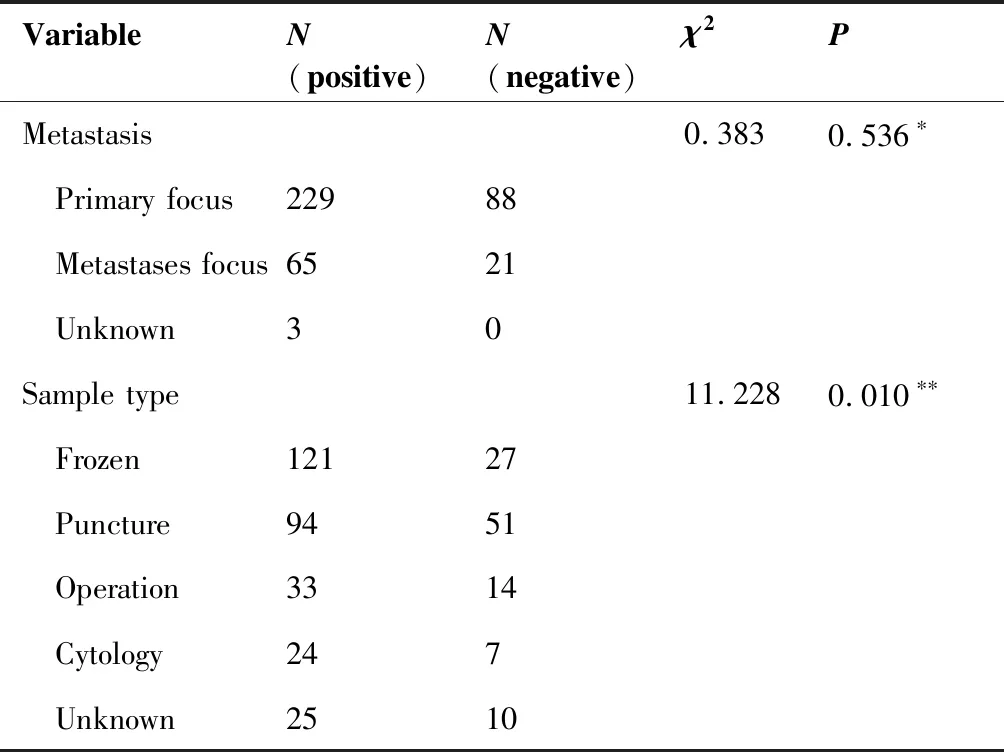
表4 不同样本中的突变检出率
2.4 双突变样本的组织病理特征及既往治疗史
我们对所有双突变样本的HE切片和免疫组化染色进行了复核,发现双突变样本的组织病理学主要为腺泡型腺癌、贴壁型腺癌、粘液腺癌、实性腺癌和微乳头状腺癌(图3)。双突变病例组织学形态与单突变相似,未发现特有的组织病理特征,不能从组织形态学推断是否有驱动基因共突变及共突变类型。
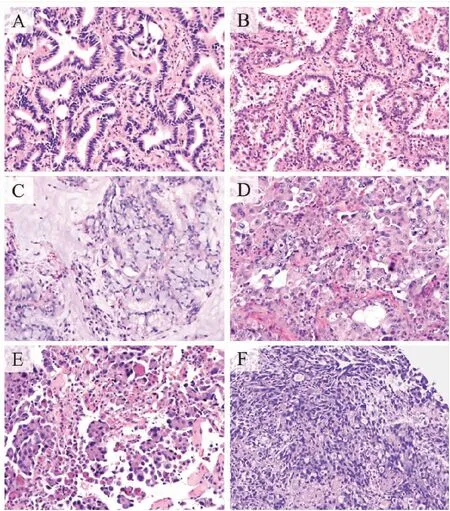
图3 双突变样本的病理HE图片(×200)
双突变样本中,共20例样本可明确既往治疗史(图4)。17例(57%)样本来源于初诊初治患者,既往未经受过治疗;3例(10%)患者既往接受过靶向治疗(1例)、放化疗(1例)或手术(1例)。
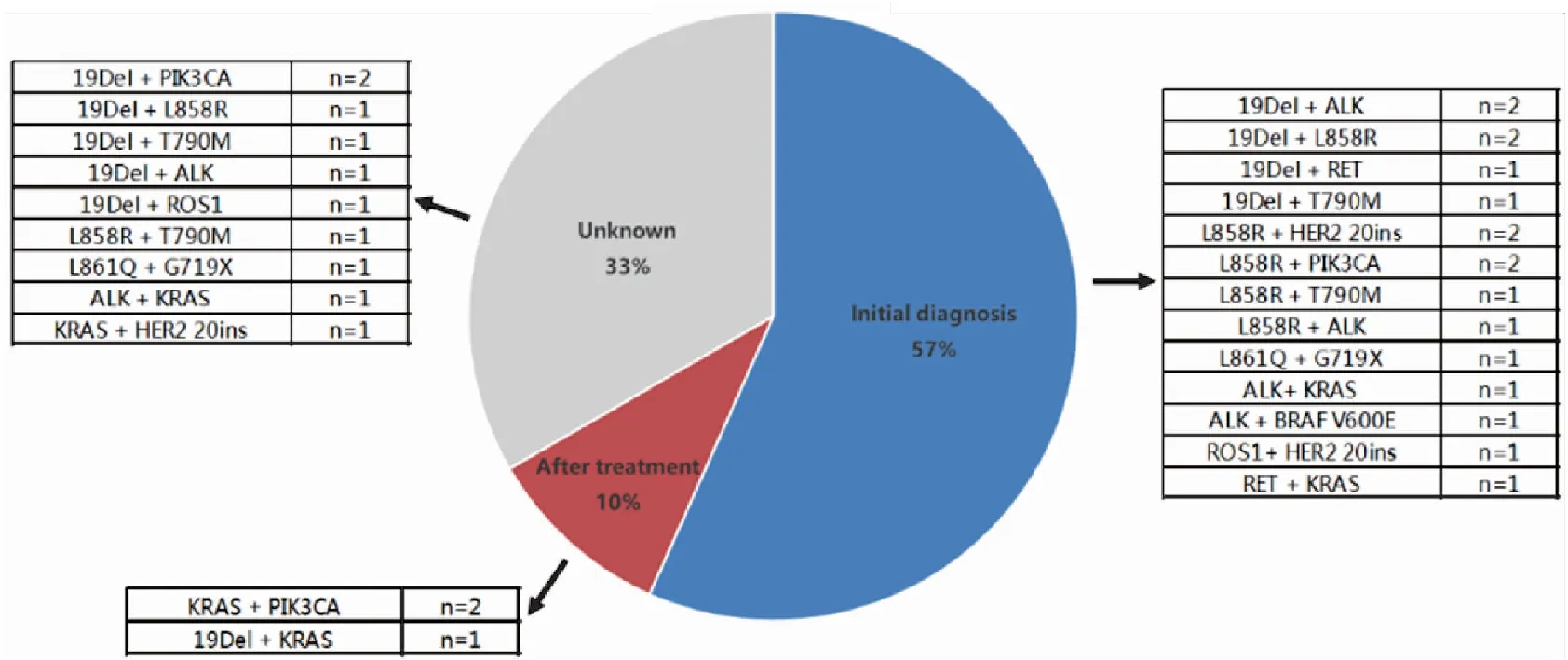
图4 双突变患者既往治疗史分布及共突变类型
3 讨 论
既往研究数据表明,EGFR基因的突变率在亚洲为30%~51%[6],本检测EGFR总突变率为51.0%(207/406),在此范围内。EGFR突变率是十种基因最高的,种类多样,最常见的类型为21号外显子L858R突变和19号外显子缺失,符合既往报道[7-8]。EGFR突变与治疗的反应性有明确的关系,除了常见的EGFR突变外,也观察到了EGFR少见突变,EGFR-TKI对携带少见突变的NSCLC患者的有效率低于常见突变,存在异质性[9-10],但靶向治疗仍优于化疗[11]。我们在研究中发现了稀有突变G719X 3例和L861Q 5例。由于例数较少, EGFR-TKI对携带这类突变患者的有效性还需加大样本量继续进行研究。本研究突变发生率第二位的是KRAS(9.6%,39/406),第三位则为ALK基因融合 (6.2%,25/406),与既往研究KRAS基因突变率6%~25%,ALK融合发生率2%~7%相符[12]。ROS1属于胰岛素受体家族中的一种受体酪氨酸激酶,位于6号染色体上,约有2%的NSCLC病例发生ROS1基因重排[13],与本项目的研究结果(2.5%,10/406)基本一致。RET基因融合、NRAS突变、PIK3CA突变、BRAF突变、HER2突变和MET14号外显子跳跃突变的发生率分别为2.2%(9/406)、0.2%(1/406)、2.2% (9/406)、1.0% (4/406)、2.2% (9/406)、0.7% (3/406),也符合以往的研究[14]。尽管后面这几种基因的突变率较低,但是临床上已经存在这些位点的靶向治疗药物,因此有必要对其进行检测分析[15]。临床医生可以根据我们的十基因联合检测报告、美国食品药品管理局(Food and Drug Administration,FDA)获批、NCCN Guidelines for Non-Small Cell Lung Cancer(Version 3.2020)和临床试验药物[16-20]等合理选择用药(表5)。
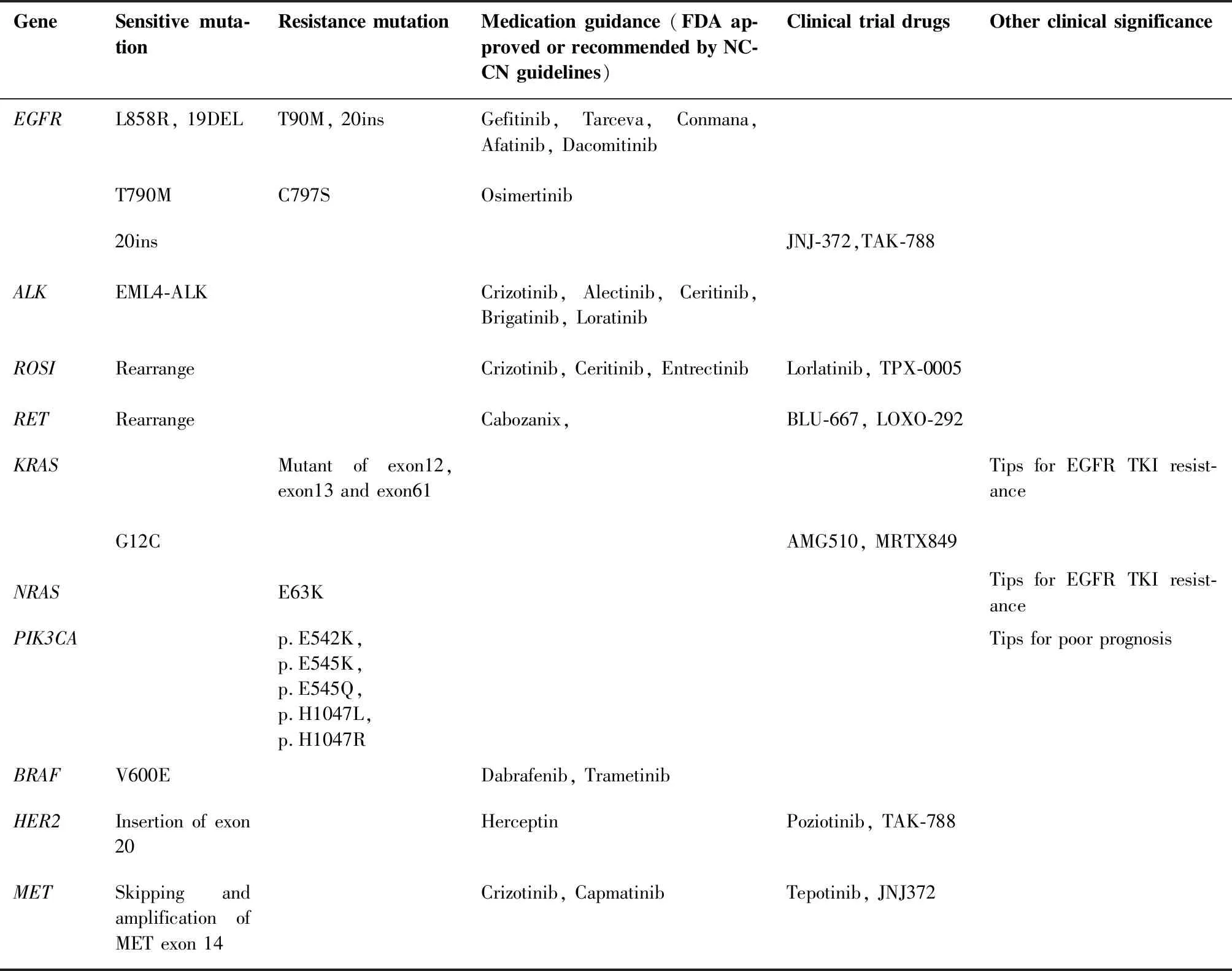
表5 非小细胞肺癌基因突变类型和用药指导
本实验数据发现,NSCLC患者的突变类型已经不局限于一种基因的突变,单基因双点突变和双基因联合突变的发生例数已达到30例,突变类型达到18种,多于以往报道[21-22]。研究显示EGFR双突变类型、EGFR/ALK双突变类型可以从EGFR-TKIs药物中获益,KRAS/ALK双突变类型可以从ALK抑制剂治疗中受益[23-25]。OPTIMAL试验表明,对于携带EGFR19Del和21突变的中国NSCLC患者,厄洛替尼作为一线治疗与吉西他滨联合卡铂相比生存期明显延长[26]。由于本研究的患者双突变例数较少,每种类型均只有1~3例,大多为首次发现肿瘤,采取的治疗方式多为手术或手术+术后化疗。其中一例86岁的女性右肺下叶非小细胞腺癌伴双肺、骨、纵隔淋巴结、脑转移(Ⅳ期,19 Del/ALK-EML4/KIF5B融合双突变),予以盐酸埃克替尼分子靶向治疗,无进展生存期(progression-free survival,PFS)为9个月 ,与盐酸埃克替尼一线治疗PFS为296天接近[27],说明盐酸埃克替尼针对19 Del/ALK双突变的治疗是有效的。另一例54岁女性肺腺癌患者检测到罕见双突变(L861Q/G719X),在服用28天马来酸阿法替尼后放弃靶向治疗,使我们无法判定疗效。我们后期将对更多患者的靶向用药情况进行跟踪、收集和统计。
本次研究的406例样本数据显示,部分驱动基因的分布具有性别、年龄或病理组织亚型偏好。EGFR突变(67.4%vs36.6%,P<0.001)和HER220ins突变(4.2%vs0.5%,P< 0.01)在女性患者中的发生率高于男性,ROS1融合在小于60岁患者中的发生率更高(0.5%vs0.4%,P<0.01),与既往的报道一致[28]。我们的数据也显示,EGFR突变在肺腺癌中的突变频率高于肺鳞癌(56.5vs2.7%,P<0.001),提示不同病理亚型NSCLC的驱动模式和靶向治疗策略有一定的差异。
同时,我们针对NSCLC原发灶和转移灶的突变频率进行了数据分析,两组阳性检出率分别为72.2%(229/317)和75.6%(65/86),比较差异无统计学意义(P>0.05),因此原发灶和转移灶的组织标本均可用于肺癌驱动基因突变的检测[29]。由于标本来源的方式不同,此次研究也对比了细胞学、冰冻后、穿刺和手术切除样本的突变率,除冰冻后样本与穿刺样本之间的差异有统计学意义(64.8%vs81.8%,P=0.001)以外,其他样本类型之间的差异均无统计学意义。穿刺样本的阳性率最低,样本质量、肿瘤细胞含量及肿瘤异质性是出现该现象可能的原因。尽管如此,不论NSCLC患者标本的病理组织学类型[30]、标本来源[31]、是否为转移灶,都能够用于肿瘤驱动基因突变检测,指导晚期NSCLC的治疗,但可以优先选择冰冻后组织。本研究收集的406例样本,冰冻后样本为术后立即送检固定,肿瘤成分多,其突变检出率显著高于整体样本的十基因突变检出率(81.8%vs73.2%,P=0.037),也提示我们在平时的临床工作中标本及时固定的重要性,更有利于DNA和RNA的完整保存。而对于穿刺样本,在我院常规进行加快制片流程,属于加快标本,大多在收到样本的第3天就能得到基因报告,大大缩短检测时间的同时确保阳性突变的检出率,有利于患者的及时治疗。但穿刺组织样本量较少,经过HE及免疫组化切片后,留给基因检测的组织量已很少,单基因检测无法有效覆盖所有靶点,不仅提供的基因信息有限,而且多次检测会造成样本的浪费或不够。而采用多基因联合检测,能在一次检测中提供足够的靶向用药信息,同时节省宝贵的临床样本,又缩短了报告周期。多基因联合检测是未来NSCLC乃至其他癌症基因检测的发展趋势。
双驱动基因共突变在NSCLC中相对罕见[32],既往研究报道EGFR突变合并ALK融合的患者TKI疗效与单基因突变患者相比更差,但仍优于化疗[33]。双突变的产生可能源于肿瘤异质性[34],或者为同一肿瘤细胞携带两种驱动突变[35]。无论如何,我们的研究显示双驱动突变不具备独特的组织病理特征,基因检测是鉴定双突变的主要方法。我们的研究同时证实:双驱动基因共突变常发生于既往未经治疗的NSCLC中,由此产生的多信号通路激活可能导致TKI治疗的原发耐药。因此,在初诊的肺癌患者中进行多基因联合检测能够提供更加全面的临床指导信息。
目前除了EGFR、ALK、ROS1、RET、KRAS、NRAS、PIK3CA、BRAF、HER2和MET十种驱动基因与NSCLC发生发展密切相关外,NTRK1-3基因是罕见的驱动基因,已经明确NTRK融合在NSCLC中具有重要意义[36]。NTRK1-3融合突变的患者TMB(肿瘤突变负荷)更高、PD-L1表达水平更高,提示这类患者可能更适合免疫治疗,有望从NTRK抑制剂或免疫治疗中获益。神经调节蛋白1(neuregulin-1,NRG1)能够结合HER3和HER4并激活ErbB信号通路[37],在NRG1融合的消化系统肿瘤中已有阿法替尼成功控制肿瘤的案例报道[38],而在肺癌中,NRG1融合的发生率约0.3%[39],随着更多低频驱动突变的发现和相关药物的问世,单基因检测在时效性、样本消耗量等方面将出现更多的局限性。未来多基因联合检测试剂盒将不仅仅局限于这十种驱动基因,会加入越来越多的基因检测位点,随着高通量测序技术的推广和普及,也将极大的推动肺癌的精准治疗,使更多的肺癌患者获益。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
