HMME-PDT诱导皮肤微血管内皮细胞损伤的作用及机制研究*
2020-12-30杨北辰陈涛周培媚付丽新郭在培
杨北辰,陈涛,周培媚,付丽新,郭在培
610017成都,成都市第二人民医院 皮肤科(杨北辰、陈涛、周培媚、付丽新);610041成都,四川大学华西医院 皮肤科(郭在培)
光动力疗法(photodynamic therapy,PDT)是一种利用光敏剂联合光照后产生靶细胞杀伤力的新型组织消融疗法。它作为一种高选择性、安全性好、副作用小的新治疗技术,已越来越多地应用于多种皮肤疾病的治疗,包括:日光性角化、基底细胞癌、鳞状细胞癌、鲍温病、尖锐湿疣、寻常疣、扁平疣、痤疮等。PDT的理论基础是光动力反应,广义概念系指有分子氧参与的光敏剂吸收光子引发的一系列光化学反应。在系统或局部应用光敏剂后,病变组织吸收并蓄积外源性或内源性光敏性物质,组织细胞中的光敏性物质受到相应波长(可见光、近红外光或紫外光)的非致热性光线照射时,通过光动力反应产生单线态氧等细胞毒性产物,这些活性物质与相邻的生物大分子及亚细胞器相互作用,损伤和破坏组织及细胞,最终导致肿瘤细胞及增殖旺盛细胞的死亡或凋亡,达到光动力治疗目的[1-5]。
葡萄酒色斑(port wine stains,PWS) , 又称鲜红斑痣,属于毛细血管瘤的一种,是一类常见的先天性血管畸形。该病新生儿发病率约为0.3%~0.5%, 大部分患儿为先天性局部微静脉异常发育所致。皮损初发可表现为浅红或粉红色斑疹,后颜色渐加深,可呈鲜红或紫红;部分皮损增厚,可出现丘疹、结节,甚至软组织肿大,形成畸形或皮肤出血。此外,由于70%~80%的皮损都位于面颈部,严重影响了患者的容貌,给患者及家属带来了巨大的社会心理压力[6]。目前,脉冲染料激光治疗仍是鲜红斑痣的主要治疗方法。尽管该治疗方法是安全、有效的,但仅有10%~20%的患者皮损能够完全清除,而20%~30%的患者几乎无效[7-8]。因此,寻求更多相对安全有效的PWS治疗方法成为目前需要解决的问题。
近来,新型光敏剂海姆泊芬(血卟啉单甲醚,hematoporphyrin monomethyl ether,HMME)的PDT治疗开始在PWS的治疗领域崭露头角。HMME是一种单体卟啉类药物,以被动运输的方式通过血管内皮细胞膜,经过一定波长和能量的激光照射激活,产生光动力效应[9]。与第一代光敏剂(如:光卟啉)相比,HMME具有组份单一、结构明确、光敏化力强、光动力效应高、代谢迅速、毒副作用更低等优点。I期临床试验已证实,HMME单剂量注射(2.5~10 mg/kg)安全且耐受性良好[10]。后续的临床试验也充分证实HMME-PDT治疗PWS的有效性[11-12]。
本项目拟通过研究HMME-PDT对人真皮微血管内皮细胞(human dermal micro-vascular endothelial cells,HDMECs)损伤作用及机制,深化对HMME-PDT治疗PWS的药理作用及分子水平作用机制的认识,为HMME-PDT治疗PWS提供进一步科学的实验证据及理论依据。
1 材料和方法
1.1 材料
注射用海姆泊芬购自泰州复旦张江药业有限公司;H2O2购自美国Sigma-Aldrich公司;CCK-8(AR1160)试剂盒购自武汉博士德生物工程有限公司;Annexin V-FITC Kit(FAK015.50) 购自深圳欣博盛生物科技有限公司;细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)、c-Jun氨基末端激酶(c-Jun N-terminal Kinase,JNK)、P38抗体均购自美国Cell Signaling Technology公司。人真皮微血管内皮细胞HDMECs来源于美国疾控中心(CDC,Atlanta,GA,USA)。
1.2 方法
1.2.1HDMECs培养及传代 使用添加有10%热灭活胎牛血清、1%双抗(100 U/mL青霉素、100 U/mL链霉素)的DMEM高糖培养基进行培养与传代。
1.2.2药物处理 细胞传代培养48 h后以不同浓度HMME溶液(5 μg/mL、10 μg/mL、20 μg/mL)分别处理细胞30 min、1 h、2 h、3 h、4 h、5 h、6 h后PBS冲洗细胞,通过荧光显微镜观察HMME进入细胞后所发荧光,确定最佳光照时间点。本实验根据观察结果选取3 h为药物处理时间。
1.2.3确定光照强度 20 μg/mL HMME处理细胞3 h后予功率密度25 mw/cm2、50 mw/cm2、75 mw/cm2、100 mw/cm2,波长在442~465 nm波段绿光照射30 min。分别于处理后即刻、1 h及12 h用普通倒置显微镜观察细胞形态,并结合CCK-8结果确定合适光照强度。
1.2.4细胞处理分组 以浓度为0.31 μg/mL、0.625 μg/mL、1.25 μg/mL、2.5 μg/mL、5 μg/mL、10 μg/mL、20 μg/mL、40 μg/mL、80 μg/mL、160 μg/mL HMME培养基处理细胞3 h后予功率密度75 mw/cm2波长在442~465 nm波段绿光照射30 min。恒温孵箱静置培养。
将该组分为低浓度处理组(HMME浓度为0.31 μg/mL、0.625 μg/mL、1.25 μg/mL、2.5 μg/mL、5 μg/mL)及高浓度处理组(HMME浓度为10 μg/mL、20 μg/mL、40 μg/mL、80 μg/mL、160 μg/mL)。不同浓度单纯HMME处理组及单纯光照组(PDT组)为阴性对照,200 μM H2O2处理细胞1 h为阳性对照组,不予处理细胞为空白对照组。
1.2.5细胞损伤情况调查
1.2.5.1 CCK-8检测细胞活力 将传代后的HDMECs接种入96孔板中,使每孔细胞数约为1×104个。分别于处理后1 h、12 h及24 h吸出原始培养基,PBS清洗后每孔加入100 μL新鲜培养基及10 μL CCK-8溶液放入细胞培养箱内继续孵育,1 h后酶标仪450 nm波长检测OD值,从而判定HMME对细胞活力的影响。
1.2.5.2 流式细胞术检测细胞凋亡及坏死比率的变化 将传代后的HDMECs接种入6孔板中,使每孔细胞数约为1×106个, 按照上述方法处理细胞12 h后,弃上清液、PBS冲洗、胰酶消化、离心清洗3次后制成300 μL细胞悬液。避光双染Annexin V- FITC及碘化丙啶(propidium iodide, PI)20 min后流式细胞术检测荧光强度。Annexin V-FITC检测早期凋亡,PI检测中晚期凋亡,荧光强度与细胞凋亡量呈正比。
1.2.5.3 分光光度计法检测细胞培养上清乳酸脱氢酶水平变化 将传代后的HDMECs接种入6孔板中,使每孔细胞数约为1×106个,按照上述方法处理细胞12 h后收集细胞上清液。按照试剂盒操作步骤处理上清,使用分光光度计法检测各组细胞培养上清乳酸脱氢酶水平变化。
1.2.6细胞氧化应激状态调查
1.2.6.1 细胞内活性氧簇(reactive oxygen species,ROS)产生 将传代后的HDMECs接种入6孔板中,使每孔细胞数约为1×106个,按照上述方法处理细胞12 h后弃上清,收集细胞洗涤后制成300 μL细胞悬液,避光单染二氯荧光素二乙酸酯20 min,流式细胞术检测荧光强度。荧光强度与细胞内ROS量成正比。
1.2.6.2 细胞脂质过氧化产物的变化 按照检测细胞上清液乳酸脱氢酶(lactate dehydrogenase,LDH)水平步骤培养处理细胞并收集培养上清液。按丙二醛(malonaldehyde,MDA)检测试盒说明书操作,分光光度计法检测各组脂质过氧化产物MDA水平。
1.2.7细胞MAPKs家族蛋白活化 将传代后的HDMECs接种入直径10 cm平皿,各组细胞按上述方法处理15 min后去除培养基,用冷PBS洗3次,加300 μL裂解液,裂解完成后提取总蛋白。在12%的SDS-PAGE胶上进行分离,并转到聚偏氟乙烯中空纤维膜上。用含5%BSA的TBS-T液封闭1 h后,膜上加入一抗(t-ERK、p-ERK、t-JNK、p-JNK、t-P38、p-P38)孵育过夜,再与辣根过氧化物酶标记的二抗孵育1 h。其后,用增强化学发光法显色,并在胶片上进行曝光。以β-actin表达作为内参对照。
1.3 统计学处理
使用SPSS 22.0统计学软件进行统计分析,全部数据均以均数±标准差表示,组间比较使用单因素方差分析。P<0.05示差异有统计学意义。
2 结 果
2.1 HMME-PDT对HDMECs损伤的影响
2.1.1HMME-PDT改变细胞形态 将细胞置于普通光学显微镜下观察细胞形态。正常生长HDMECs为梭形,细胞间排列紧密,予HMME-PDT处理后细胞皱缩、变形,排列松散,单纯给药组及单纯光照组细胞形态正常(图1)。
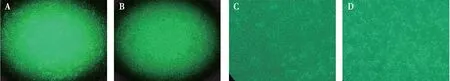
图1 HMME-PDT处理细胞后细胞形态改变
2.1.2 HMME-PDT降低细胞活力 以不同浓度HMME预处理细胞3 h后光照30 min。与空白对照组相比,低浓度HMME-PDT组(0.31 μg/mL、0.625 μg/mL、1.25 μg/mL、2.5 μg/mL、5 μg/mL)处理细胞后1 h、12 h及24 h细胞存活率均明显降低(图2A~C)。低浓度HMME组(0.31 μg/mL、0.625 μg/mL、1.25 μg/mL、2.5 μg/mL、5 μg/mL)处理细胞后细胞存活率差异均无统计学意义(图2D)。高浓度HMME-PDT组(10 μg/mL、20 μg/mL、40 μg/mL、80 μg/mL、160 μg/mL)处理细胞后细胞存活率均明显降低(图2E)。高浓度HMME组(10 μg/mL、20 μg/mL、40 μg/mL、80 μg/mL、160 μg/mL)处理细胞后细胞存活率差异均无统计学意义(图2F)。PDT单独处理对细胞存活率无明显影响,200 μM H2O2可致细胞存活率明显降低。
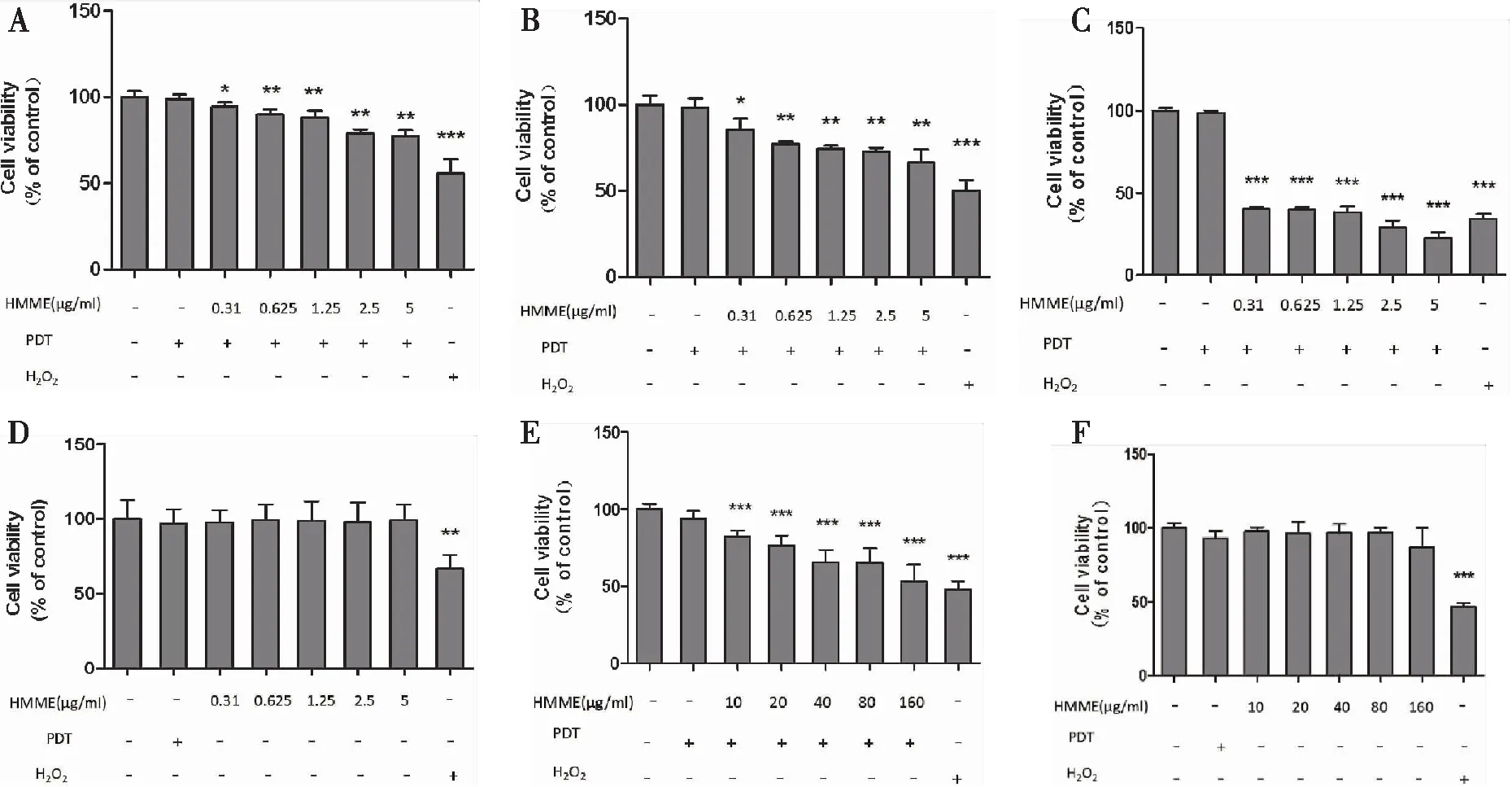
图2 不同浓度的HMME-PDT均可致细胞活力明显降低
2.1.3HMME-PDT诱导细胞凋亡 通过流式细胞术发现,与空白对照组相比, HMME-PDT组(0.31μg/mL、0.62 μg/mL、1.25μg/mL、2.5 μg/mL、5μg/mL)处理细胞后12 h细胞凋亡率均明显增高;PDT单独处理组及HMME单独处理组细胞凋亡率差异均无统计学意义;200 μM H2O2阳性对照组细胞凋亡率明显增加(图3)。
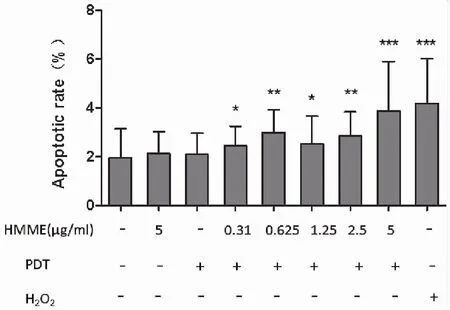
图3 不同浓度HMME-PDT均可诱导细胞凋亡(*P<0.05,**P<0.01,***P<0.001)
2.1.4HMME-PDT致细胞LDH释放 检测细胞上清液发现,与空白对照组相比,HMME-PDT组(0.31 μg/mL、0.625 μg/mL、1.25 μg/mL、2.5 μg/mL、5 μg/mL)处理细胞后12 h细胞LDH释放量明显增多(图4A)。PDT及HMME单独处理细胞后细胞上清LDH含量无明显变化(图4B)。200 μM H2O2可致细胞释放大量LDH。
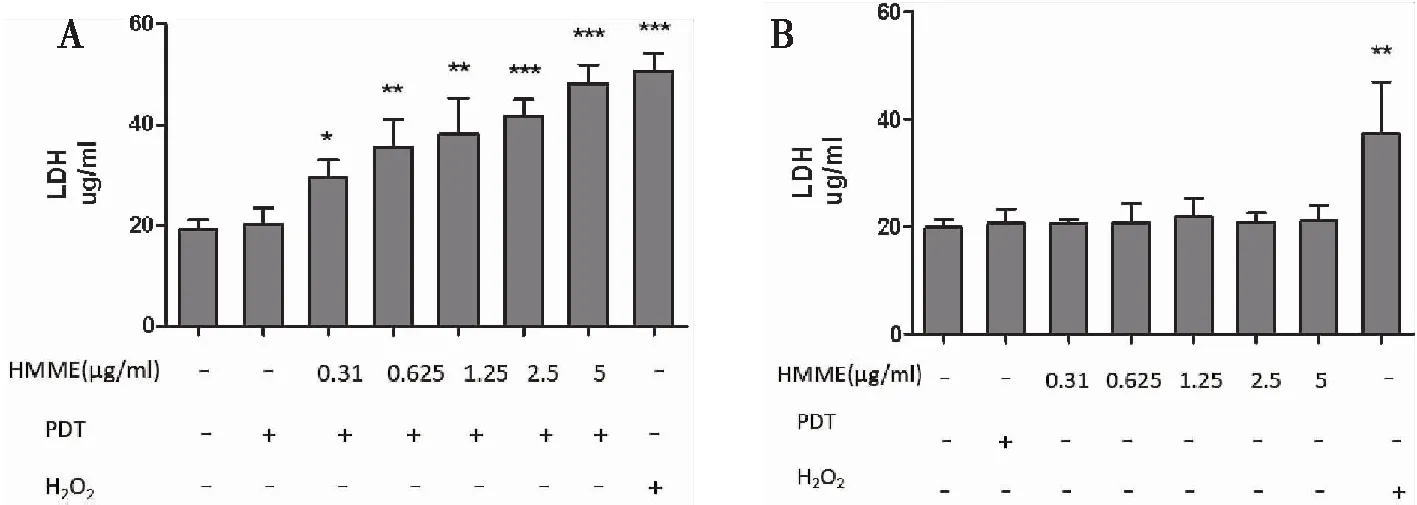
图4 HMME-PDT组细胞上清LDH含量明显增多
2.2 HMME-PDT对HDMECs氧化应激状态的影响
2.2.1HMME-PDT诱导细胞内产生ROS 通过流式细胞术发现,与空白对照组相比,不同浓度HMME-PDT组(0.31 μg/mL、0.625 μg/mL、1.25 μg/mL、2.5 μg/mL、5 μg/mL)处理细胞后12 h细胞内ROS产量明显增多;PDT单独处理组及HMME单独处理组未见细胞内ROS产生量发生明显变化,200 μM H2O2阳性对照组细胞ROS产生量明显增加(图5)。
2.2.2HMME-PDT致细胞内产生MDA 检测细胞上清液发现,与空白对照组相比,不同浓度HMME-PDT组处理细胞后12 h细胞产生MDA量明显增多(图6A)。PDT单独处理组及HMME单独处理组细胞内MDA产量无明显变化(图6B)。200 μM H2O2可致细胞产生大量MDA。
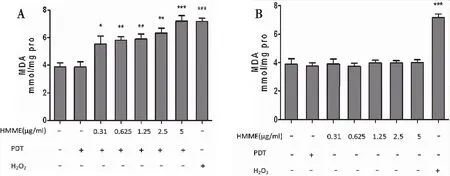
图6 HMME-PDT组MDA含量明显增加
2.3 HMME-PDT诱导细胞MAPKs家族蛋白的活化
Western blot实验检测结果显示: 与空白对照组比较,HMME-PDT处理组磷酸化的P38及ERK表达增高。PDT单独处理组及HMME单独处理组未见明显促磷酸化作用(图7A)。半定量统计分析灰度值结果显示HMME-PDT处理组磷酸化的ERK、P38表达增高,磷酸化JNK表达未见明显变化(*P<0.05,**P<0.01,***P<0.001)(图7B)。
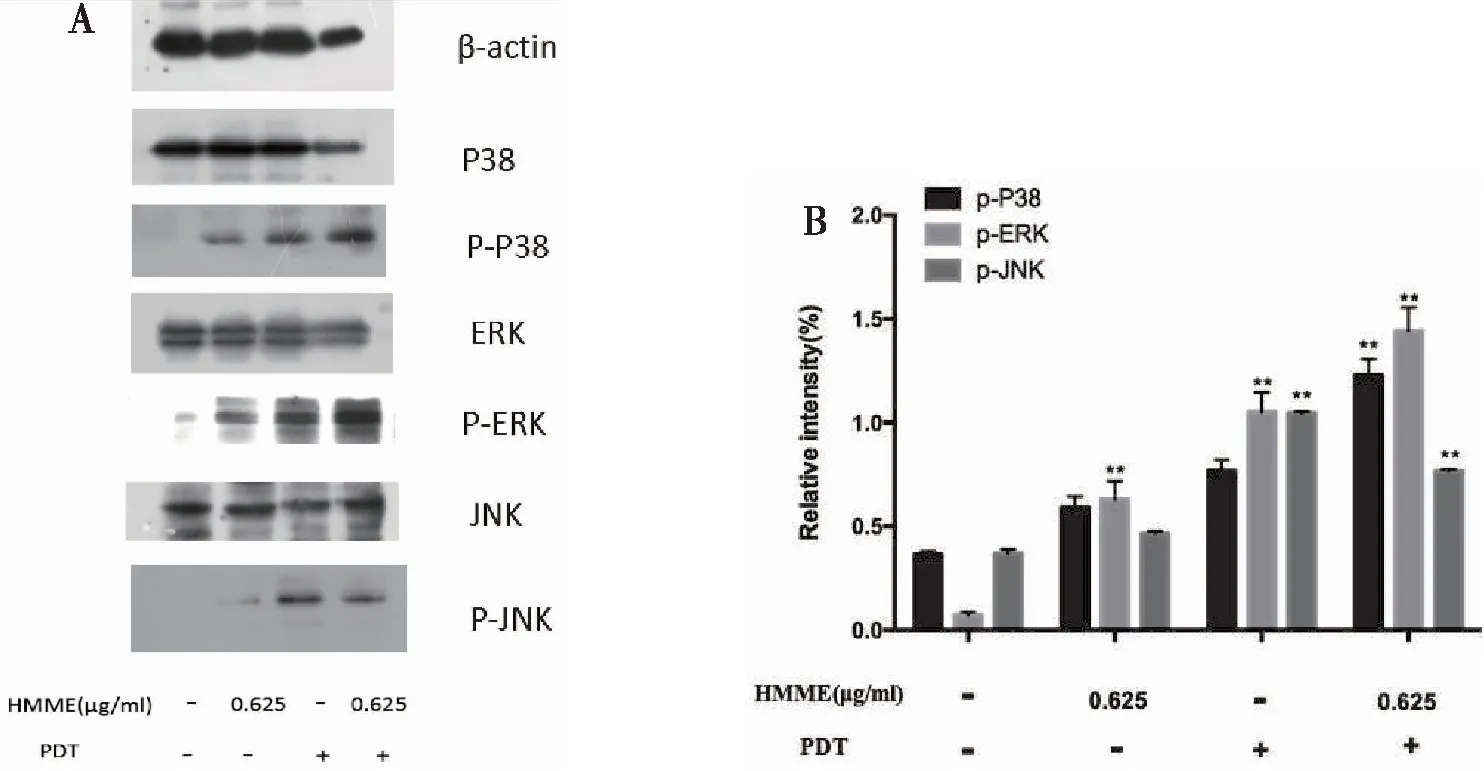
图7 HMME-PDT可以诱导P38、ERK磷酸化
3 讨 论
HMME是一种单体卟啉类光动力药物。与第一代光敏剂相比,海姆泊芬具有光动力效能更强、代谢迅速、毒副作用更低等优点,已开始在临床应用中崭露头角。现有资料显示HMME-PDT治疗PWS安全、有效[10-12]。本研究发现,HMME-PDT可致HDMECs产生大量ROS,诱导细胞凋亡。这一作用可能与其细胞MAPKs蛋白家族的磷酸化,进而激活炎症信号通路有关。
ROS是细胞在有氧代谢过程中产生的具有高生物活性含氧化合物的总称,包括超氧阴离子(·O2-)、羟自由基(·OH)、过氧化氢(H2O2)、氢过氧自由基(HO2·)、一氧化氮(NO)等。目前普遍认为ROS是一种具有生物学活性的毒性分子,参与调控了多种因子的细胞生物学效应[13]。ROS可以通过脂质过氧化反应、蛋白质变性、DNA损伤、线粒体膜电位改变以及调控细胞信号转导等途径引起细胞损伤[14-18]。相关研究表明HMME-PDT作用机制可能是药物进入循环,并在高浓度时,由于光化学反应诱导血管内皮细胞活性氧产生, 选择性地损伤血管内皮细胞所致[10,19-23]。
本次研究通过对细胞损伤情况的调查发现,低浓度HMME-PDT就能使细胞活力显著下降,凋亡细胞明显增多。并且药物浓度越大,细胞凋亡率越高。这说明在光照强度一定的情况下,HMME对HDMECs的损伤作用呈浓度依赖。同时我们发现,完成处理后继续培养细胞,随着培养时间的延长,细胞的凋亡现象更加明显,且早凋亡及中晚凋亡细胞比例均明显增加。由此我们可以推测,HMME-PDT对细胞的损伤作用存在时间依赖性。即在光照处理后的一段时间内HMME对目的细胞的损伤作用能持续进行。以上结果说明HMME具有较高的光反应性及较强的光动力效能,接受相应波长的可见光照射后能有效地杀伤目的细胞。随后我们发现,阴性对照组细胞在接受高浓度HMME单独处理后与空白对照相比并未出现明显凋亡现象,这说明HMME本身并不使细胞发生损伤,进一步证实了HMME的安全性。LDH存在于细胞质中,当细胞受到损伤时会通过受损的细胞膜释放到胞外。由于释放出的LDH性质较稳定,所以培养基中LDH的含量可以作为判定细胞死亡和受损程度的相对指标。本次研究通过检测处理组与对照组细胞上清LDH含量也再次证实HMME-PDT能导致HDMECs损伤。
之后的研究结果表明HMME-PDT能导致细胞产生大量ROS并引起脂质过氧化反应。且随着药物浓度的增加及处理后培养时间的延长氧化应激损害越明显,与其致细胞损伤结果一致。这也证明HMME-PDT是通过氧化应激途径杀伤目的细胞。
MAPKs途径是主要的细胞内信号转导途径之一,在细胞增殖及凋亡方面具有重要作用[24],包括ERK、JNK和P38[25-26]。大量研究表明,ROS能活化血管内皮细胞,使得ERK、P38、JNK等蛋白磷酸化[27-30];而这些MAPKs家族蛋白的活化,可诱导下游凋亡相关转录,促进细胞死亡。
本研究结果证实了HMME-PDT可以明显促进ERK、P38磷酸化,但并未见促进JNK磷酸化。这提示HMME-PDT可能是通过调控MAPKs通路中的ERK、P38两种激酶从而诱导HDMECs凋亡的发生。有研究表明ROS能活化MAPKs途径,并诱导凋亡蛋白酶caspase3产生,促进细胞凋亡[31]。Caspase家族被认为与细胞凋亡密切相关,通过基因敲除技术发现Caspase 还参与了细胞的成熟、生长和分化及免疫的调节[32-34]。之前,Wei等[35]的研究显示,HMME可进入细胞线粒体,在光照后通过线粒体膜电位改变及caspase家族蛋白活化,介导卵巢癌细胞株3AO细胞死亡。细胞凋亡还可通过细胞色素C途径。细胞色素C从线粒体内释放是关键的一步[36]。在细胞凋亡信号的刺激下,细胞色素C从线粒体内释放到胞浆内,在dATP存在下与凋亡分子Apaf-1形成复合体,并招募细胞内caspase 9的前体pro-caspase 9到复合体上并发生自身切割活化;从而促进pro-caspase 3切割活化,caspase 3产生并诱导细胞凋亡[36-37]。HMME-PDT促进血管内皮细胞凋亡作用是否与活化caspase家族相关,值得后期的进一步研究与验证。
综上所述,本项研究显示:HMME-PDT可诱导HDMECs产生ROS,致其发生氧化应激损害和细胞凋亡。其机制可能是通过调控MAPKs通路中的ERK和P38磷酸化从而诱导凋亡相关转录来实现的。总之,海姆泊芬因其较强的光敏性及光动力效能、较高的安全性、药物处理时间相对较短等特点对于治疗因血管畸形造成的葡萄酒色斑等相关皮肤疾病具有独特的优势。
本课题以体外细胞模型为研究对象,从分子水平部分阐明了海姆泊芬治疗葡萄酒色斑的作用机制,其结果为HMME-PDT治疗葡萄酒色斑的可靠性及安全性提供了科学的实验证据,并为HMME-PDT临床应用提供了理论依据和线索。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
