多重实时聚合酶链式反应熔解曲线法同步鉴别蓝鳍金枪鱼、裸盖鱼、异鳞蛇鲭
2020-12-29许随根李家鹏李金春杨君娜熊苏玥乔晓玲王守伟
许随根,李家鹏,李金春,陈 曦,杨君娜,熊苏玥,黄 鑫,乔晓玲,曲 超,王守伟
(中国肉类食品综合研究中心,北京食品科学研究院,国家肉类加工工程技术研究中心,肉类加工技术北京市重点实验室,北京 100068)
近年来,随着经济发展,水产类食品越来越受消费者青睐,特别是营养价值较高的金枪鱼和鳕鱼的消费需求在不断增长。同时,鱼肉制品的掺假事件被多次报道,造成消费者的恐慌,掺假行为不仅威胁消费者的健康和造成经济利益受损,还损害渔业及其国际贸易,而且也对监管部门的执法提出了更高技术要求[1]。鱼肉产品掺假或称为标签错误标示是一个全球性的问题[2],在亚洲、非洲[3]、欧洲[4]、南美洲[5]、大洋洲和北美洲[6-7]等地多国均有报道。银鳕鱼(裸盖鱼,Anoplopoma fimbria)含有大量的不饱和脂肪酸、多种必须氨基酸、多种维生素、钙、镁、硒等营养元素[8],营养丰富,肉味甘美,易于消化,深受婴幼儿喜爱,常作为辅食食用,市场上具有很高售价。关于裸盖鱼产品掺伪的报道很多,其中油鱼(异鳞蛇鲭,Lepidocybium flavobrunneum)在掺伪鱼类中最引起社会和消费者广泛关注,因异鳞蛇鲭外形酷似裸盖鱼,但其肌肉及内脏富含蜡质油脂,多吃会导致腹泻,严重危害消费者健康[9]。蓝鳍金枪鱼富含二十二碳六烯酸、二十碳五稀酸、酪胺酸、牛磺酸、核酸、铁、钙、钾、多种必须氨基酸和VB12等营养成分[10],营养价值极高,其肉质细嫩,口感滑腻,有“金枪鱼之王”的雅称[11],由于每种金枪鱼具有不同的品质和价格,蓝鳍金枪鱼在市场上稀缺,具有很高售价,造成不法商贩以其他近似鱼类以次充好售卖[12]。消费者在购买鱼类产品时多基于鱼鳍、鱼须、体型、鳃耙数、脊骨数等外部形态特征判别鱼种类,而裸盖鱼和金枪鱼产品多以真空包装的切块、切片、腰肉或罐头产品交易,因此监管者和消费者不易通过形态特征判断其所用的原料。针对这类掺假造假的判定,传统的形态特征鉴别法已经不能满足,必须基于更确切、精准的物种鉴别基础上,因此,行业急需一种灵敏、特异的蓝鳍金枪鱼和裸盖鱼及其制品的物种鉴定方法。
现今鳕鱼与金枪鱼的鉴定标准方法国内仅有 SN/T 3589.6—2013《出口食品中常见鱼类及其制品的鉴伪方法 第6部分:金枪鱼成分检测 实时荧光PCR法》和SN/T 3589.7—2013《出口食品中常见鱼类及其制品的鉴伪方法 第7部分:鳕鱼成分检实时荧光PCR法》,金枪鱼、鳕鱼成分检测实时聚合酶链式反应(real-time polymerase chain reaction,real-time PCR)法,而蓝鳍金枪鱼、裸盖鱼、异鳞蛇鲭没有快速的鉴定方法。目前,已经报道的有关金枪鱼、异鳞蛇鲭、鳕鱼的分子鉴定方法有多重PCR琼脂糖电泳法[13-14]、多重PCR联合酶联吸附法[15]、核苷酸测序(forensically informative nucleotide sequencing,FINS)法[16]、DNA条形码法[17-18]、PCR限制性片段长度多态性法(PCR restriction fragment length polymorphism,PCR-RFLP)[19]和单物种荧光定量 PCR法[20-21]。多重PCR琼脂糖电泳法灵敏度较低,近物种鉴定易出现假阳性,FINS和DNA条形码法需要测序[22],鉴定周期长,操作繁琐;此外,DNA条形码法还存在依赖参考的数据库建设不够完善、核内DNA条形码[23]和混合物种样品单一条形码获取困难等不确定因素[24];多重PCR联合酶联吸附法操作繁琐,成本较高;单物种PCR法检测速度较快,但是检测物种较少,每次只能检测一个物种,而且目前建立的单物种特异性PCR多集中在大西洋鳕鱼[25]、太平洋鳕鱼[26]、细鳞壮鳕[27]等鳕形目鳕鱼。开发满足行业快速检测蓝鳍金枪鱼、裸盖鱼、异鳞蛇鲭的分子鉴定方法成为迫切需求。
本研究针对蓝鳍金枪鱼、裸盖鱼和异鳞蛇鲭的市场检测需求,利用SYBR Green real-time PCR的熔解曲线法,开发同时检测蓝鳍金枪鱼、裸盖鱼、异鳞蛇鲭3 个物种的多重real-time PCR检测方法,以期实现多物种的快速检测,同时降低检测成本,能够满足多样品的快速检测需求,具有很好的应用前景。
1 材料与方法
1.1 材料与试剂
1.1.1 样品来源
建立多重real-time PCR方法体系所用鱼类和畜禽肉:4 种金枪鱼、剑旗鱼、裸盖鱼、异鳞蛇鲭由北京水产公司远洋捕捞队提供;燕鲅鱼、鲐鲅鱼、青鱼、草鱼、鳙鱼、鲢鱼各1 种,来源于北京岳各庄水产批发市场;猪肉采购于北京二商大红门肉类食品有限公司;牛、绵羊、山羊肉来源于北京月盛斋清真食品有限公司;鸡、鸭肉购于北京永辉超市。
1.1.2 试剂
动物组织基因组D N A 提取试剂盒 天根生物 (北京)技术有限公司;LightCycler®480 real-time PCR反应管、SYBR Green酶体系预混液 罗氏诊断产品(上海)有限公司;无水乙醇 北京化工集团;DNeasy Blood & Tissue Kit DNA提取试剂盒 凯杰企业管理 (上海)有限公司。
1.2 仪器与设备
多样品剪切均质匀浆仪 美国欧姆尼公司;ME104分析天平 梅特勒-托利多(北京)公司;Vortex-Genie2涡旋振荡器 美国Scientific Industries公司;NanoDROP one超微量分光光度计 赛默飞世尔科技有限公司;RocheLight Cycler 480 PCR仪 罗氏诊断产品(上海)有限公司;T100TMThermal Cycler型PCR仪 美国伯乐公司;Eppendorf Centrifuge 5417R离心机 艾本德中国有限公司;Cascada BIO超纯水系统 美国颇尔公司。
1.3 方法
1.3.1 样品的处理及基因组DNA的提取
将鱼去鳞片,畜禽肉去筋膜,取肌肉剪碎,准确称取3 g肉,加水12 mL,调整均质仪10 000 r/min匀质10 min,取1.5 mL离心管吸取150 μL匀浆液于其中,8 000 r/min离心1 min,去上清液,然后按照试剂盒说明书操作提取DNA,4 ℃保存备用。
1.3.2 目标物种的引物设计
在NCBI网站获取6 种金枪鱼、8 种鳕鱼、裸盖鱼、异鳞蛇鲭、刺鳞蛇鲭等26 种鱼类线粒体DNA序列,利用Mega 7.1软件进行序列比对,选择序列差异大的区域利用软件Oligo 7.56设计特异性引物。设计的引物在NCBI网站通过BLAST程序进行扩增产物同源性及特异性比对,比较不同引物对扩增产物Tm值并选取扩增产物Tm值差异显著的引物用于实验。最终,蓝鳍金枪鱼的特异性引物设计在线粒体DNA的D-loop区,裸盖鱼的特异性引物设计在线粒体DNA的16S rRNA基因,异鳞蛇鲭的特异性引物设计在线粒体DNA的ND4L基因,所有引物由赛默飞世尔科技中国合成(表1)。
表1 目标物种的引物信息Table 1 Information about primers for target species used in this study
1.3.3 设计引物的特异性验证
利用提取的各物种基因组DNA作为模板,进行real-time PCR扩增。采用10 μL的PCR体系,其中SYBR Green酶体系预混液5 μL,上下游引物(5 μmol/L)各1.0 μL,模板DNA 2 μL,加无菌重蒸水补足至10 μL。 real-time PCR程序:95 ℃预变性5 min;95 ℃变性10 s,60 ℃退火和延伸共计45 s,重复35 个循环;熔解峰图制作:95 ℃变性1 min,降温至70 ℃、1 min,之后均匀速率(0.02 ℃/s)升温至95 ℃,并连续采集各温度下的荧光值;然后,60 s内降温至40 ℃。以温度为横坐标,荧光值对温度的一阶负导数为纵坐标,制作熔解峰值图[28]。
1.3.4 多重real-time PCR体系建立
选取蓝鳍金枪鱼、裸盖鱼、异鳞蛇鲭的特异性引物,首先优化退火温度、循环数等扩增条件,已往文献报道多重PCR扩增过程中各引物对存在相互竞争的关系,引物浓度对多重real-time PCR能否扩增目标物种起重要作用,在多重PCR体系中调配合适的引物浓度能够有效避免个别物种漏检情况的发生[29],据此设计系列不同浓度梯度的引物组合体系,根据各组合系统所产生的峰图高度调整不同物种引物浓度,以出现平滑、基本等高且特异的峰值图为标准,选定最优组合体系。如表2所示,采用25 μL的PCR体系,其中SYBR Green酶体系预混液12.5 μL,上下游引物(5 μmol/L)各4.2 μL(上下游引物为蓝鳍金枪鱼、裸盖鱼、异鳞蛇鲭特异性引物按比例混合组成),模板DNA 2 μL,加无菌重蒸水补足至25 μL。real-time PCR程序:95 ℃预变性5 min;95 ℃变性10 s,58 ℃退火和延伸共计45 s,重复35 个循环;熔解峰图制作:95 ℃变性1 min,降温至70 ℃保持1 min,之后均匀速率(0.02 ℃/s)升温至95 ℃,并连续采集各温度下的荧光值;然后,60 s内降温至40 ℃。以温度为横坐标,荧光值对温度的一阶负导数为纵坐标,制作熔解峰值图。

表2 引物配比及各组分添加量(总体积25 μL)Table 2 Ingridents and formulation of PCR reaction system (total volume 25 μL)
1.3.5 多重real-time PCR检测的灵敏度
将蓝鳍金枪鱼、裸盖鱼、异鳞蛇鲭的DNA溶液梯度稀释,分别配制5、0.5、0.05、0.005、0.000 5 ng/μL DNA溶液,开展灵敏度检测;制备蓝鳍金枪鱼、裸盖鱼与异鳞蛇鲭的肉粉,按比例混合分别配制成含蓝鳍金枪鱼、裸盖鱼、异鳞蛇鲭成分50%、10%、5%、1%、0.5%、0.10%的混合肉样,提取DNA开展相对检出限灵敏度检测。
1.3.6 多重real-time PCR体系实际应用效果验证
采购金枪鱼、鳕鱼的鲜品切片、切块以及罐头制品,购置金枪鱼鲜品13 份,裸盖鱼切块9 份,烤鳕鱼片8 份,金枪鱼罐头5 份,鳕鱼类罐头5 份。利用所建立的多重real-time PCR检测方法测定其蓝鳍金枪鱼、裸盖鱼、异鳞蛇鲭成分。
1.4 数据处理
实验重复3 次,每次做2 个平行。所有数据采用±s表示。
2 结果与分析
2.1 设计引物的特异性验证
分别使用蓝鳍金枪鱼、裸盖鱼、异鳞蛇鲭的特异性引物对蓝鳍金枪鱼、黄鳍金枪鱼、马苏金枪鱼、大目金枪鱼、三文鱼、黄鱼、草鱼、鲢鱼、鳙鱼、鲤鱼、青鱼、异鳞蛇鲭、燕鲅鱼、鲐鲅鱼、剑旗鱼、猪、牛、绵羊、山羊、鸡、鸭的DNA(5 ng/μL)进行 real-time PCR扩增,结果显示3 对特异性引物只对各自阳性物种DNA产生特异性扩增,而对其他物种DNA无典型扩增曲线出现,表明蓝鳍金枪鱼、裸盖鱼、异鳞蛇鲭的特异性引物具有很好特异性。将3 对引物混合后对22 个物种DNA进行多重real-time PCR检测验证,扩增结果见 图1,检测结果与单一引物检测结果相同,表明3 对引物在多物种扩增中也具有很好的特异性,不同物种源性成分的Tm值相差显著。扩增产物的GC含量和片段长度的差异是造成这种差异的主要因素,为利用多重real-time PCR熔解曲线分析法建立掺假检测方法提供理论基础。DNA的Tm大小与其均一性、GC含量及介质中的离子强度等因素有关,所以离子浓度固定的溶液中,短链DNA的Tm值受其浓度、片段长度和GC含量的影响[30]。而长片段DNA则在变性过程中主要发生局部解链,首先解链低GC含量的部分,通常40~100 bp被认定为一个熔解单元[31]。片段大小超过100 bp后,GC含量和溶液浓度是影响DNATm值的主要因素。另外,种内个体变异只会发生几个碱基的突变,相应造成Tm值的变化也较小(同物种内不同个体DNA的PCR扩增产物的Tm测定误差范围为0~0.3 ℃)。因此,基于熔解曲线分析法不需判定片段内碱基序列的变异,只考虑特异性引物是否设计在的种内保守区,相比PCR-RFLP、荧光探针法和DNA条形码技术,本方法的优点也在此处[32-34]。
多重real-time PCR方法检测物种源性成分的能力与其反应重数密切相关。real-time PCR反应重数越多,各引物对的相互竞争就越激烈,real-time PCR体系的检测能力越容易受到限制。目前,已报道的研究中real-time PCR重数在5 重及以下,因此,研究者为了利用尽量少的引物对同步检测尽可能多的物种源性成分,往往将特异性引物设计在属特异种保守的序列处,从而提高所开发方法的检测灵敏度和通量,本实验设计的异鳞蛇鲭引物采用此策略,使其能检测异鳞蛇鲭和刺鳞蛇鲭。引物特异性验证的结果见表3。

图1 real-time PCR体系的特异性Fig. 1 Specificity of the established real-time PCR system

表3 引物特异性验证结果Table 3 Statistical results of specificity verification of primers
2.2 多重real-time PCR特异性检测结果
配制蓝鳍金枪鱼、裸盖鱼、异鳞蛇鲭的混合肉样(各物种源性成分含量比例相同,物种组合见表4), 提取各样品D N A,以提取的D N A 为模板进行多重 real-time PCR扩增,并分析熔解曲线,再次验证所建多重real-time PCR体系的特异性,同时确定各物种成分熔解温度(Tm)分布范围。分析各样品熔解曲线图,结果如图2、3所示,所检样品的熔解曲线峰位置、峰个数均与样品的物种源性成分组成相对应,均没有非特异性峰出现的现象,进一步表明建立的多重real-time PCR体系具有很好的特异性。3 次重复实验并计算各物种源性成分的Tm值,计算结果见表4。实验并统计不同引物浓度体系、不同模板浓度中3 种鱼类的Tm值分布情况,由统计结果可知3 种鱼类源性成分的熔解温度分布段分别为蓝鳍金枪鱼源性成分Tm值(74.98±0.60)℃、裸盖鱼源性成分Tm值(78.65±0.71)℃、异鳞蛇鲭源性成分Tm值(82.38±0.25)℃,各物种源性成分的Tm值均有偏移,异鳞蛇鲭源性成分的Tm值漂移范围最小,为0.5 ℃,裸盖鱼源性成分的Tm值漂移范围最大,为1.42 ℃,整体看来各物种源性成分的Tm值偏移跨度较小,表明所建方法稳定性较好;各物种源性成分Tm值范围之间相互不交叉,因此,分析所检测样品熔解曲线,根据谱图中溶解峰数和温度范围(即峰的位置)能准确判定所检样品中含有的物种。

表4 混合鱼肉样品中各鱼类成分熔解温度值Table 4 Melting temperature values of fish components in mixed fish samples
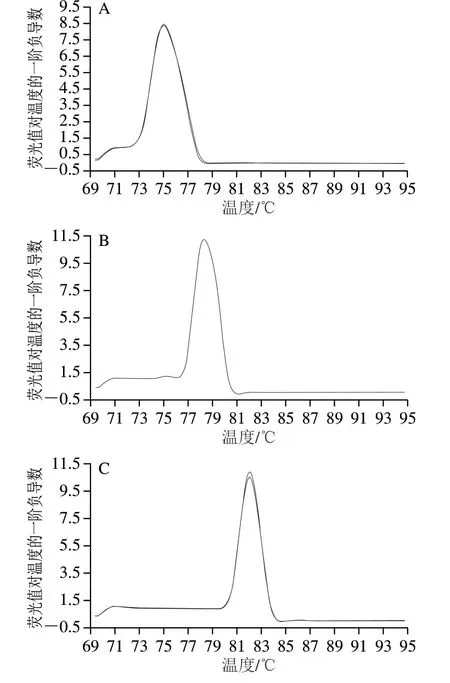
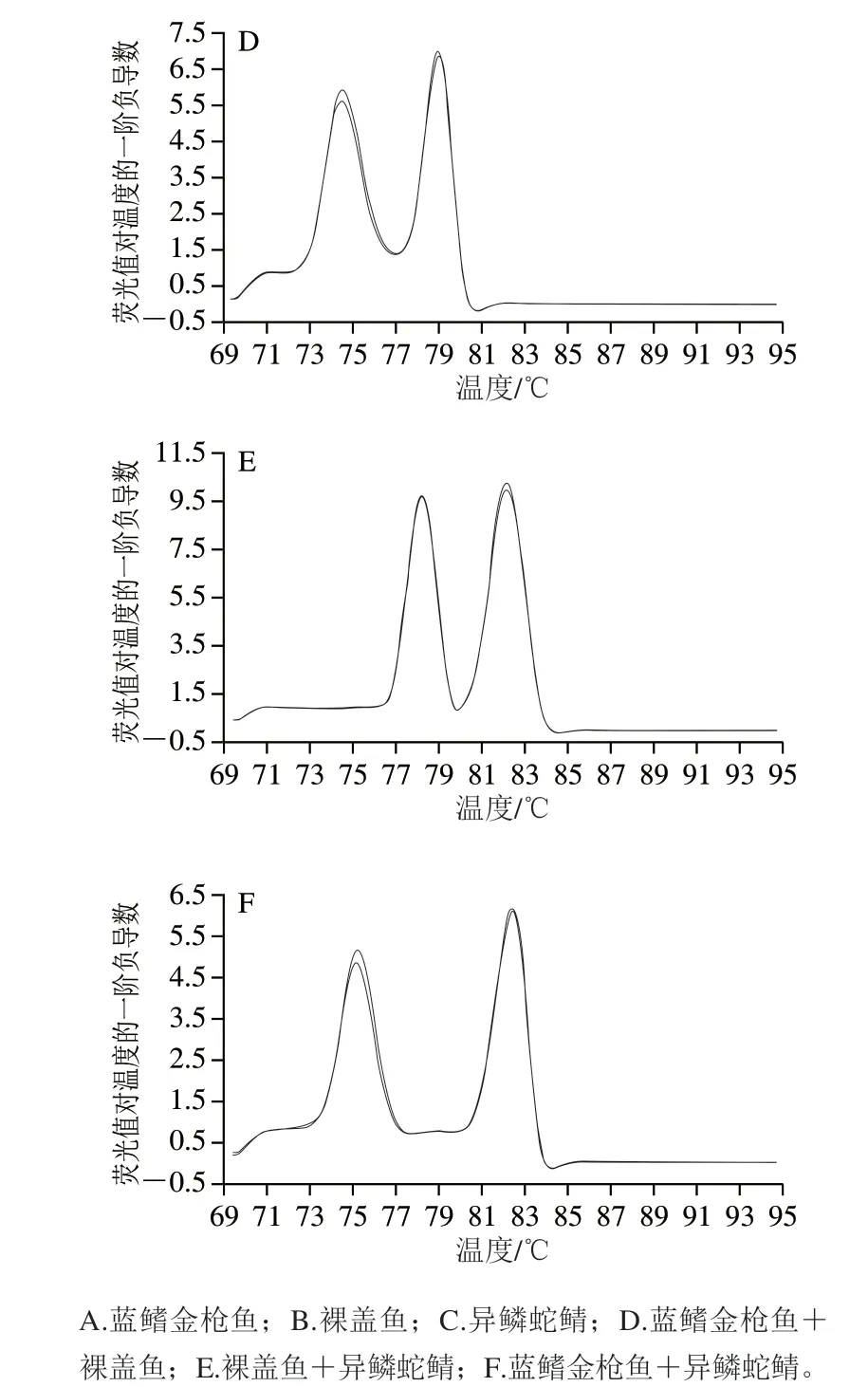
图2 多重real-time PCR检测各混合样DNA的熔解曲线Fig. 2 Melting curves of DNA in mixed samples detected by multiplex real-time PCR
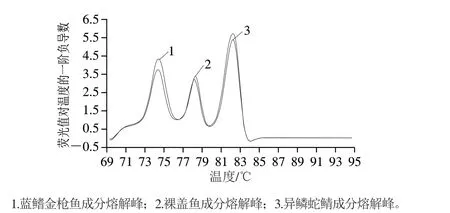
图3 所建real-time PCR体系检测3 种鱼类混合DNA的熔解曲线Fig. 3 Melting curves of mixed DNA of three fishes detected by real-time PCR
2.3 多重real-time PCR检测方法的灵敏度
以制备成5、0.5、0.05、0.005、0.000 5 ng/μL的蓝鳍金枪鱼、裸盖鱼、异鳞蛇鲭的质量浓度梯度DNA样品和3 鱼类混合DNA溶液为模板,进行多重real-time PCR扩增及熔解曲线分析,测试多重real-time PCR的DNA浓度灵敏度;由图4A可知,蓝鳍金枪鱼各质量浓度梯度样品的Tm分别为(75.37±0)、(75.47±0.20)、(75.38±0.04)、(75.88±0.01)、(76.24±0.11)℃; 由图4 B 可知,裸盖鱼各浓度梯度样品的Tm分别为(78.45±0)、(78.47±0.01)、(78.64±0.01)、(79.20±0.08)、(79.27±0.01)℃;由图4C可知,异鳞蛇鲭各浓度梯度样品的Tm分别为(82.1±0.01)、(82.07±0.01)、(82.11±0.04)、(82.26±0.01)、(82.47±0.01)℃。三者的Tm值均在各自的温度范分布围内,由此可知采用本方法多重real-time PCR体系检测单物种DNA,蓝鳍金枪鱼、裸盖鱼、异鳞蛇鲭成分的检出限均为0.001 ng。由图4D可知,采用本方法多重real-time PCR体系测定混合样DNA溶液,10 ng混合DNA为模板,蓝鳍金枪鱼、裸盖鱼、异鳞蛇鲭的Tm分别为(74.49±0.04)、(78.09±0.05)、82.23±0.02)℃, 1 ng混合DNA为模板,蓝鳍金枪鱼、裸盖鱼、异鳞蛇鲭的Tm分别为(74.90±0.04)、(78.46±0.05)、(82.30±0.02)℃,0.1 ng混合DNA为模板,蓝鳍金枪鱼、裸盖鱼、异鳞蛇鲭的Tm分别为(75.61±0.01)、(79.0±0.02)、(82.46±0.01)℃,三者的Tm值均在各自的温度分布范围内,可知本方法检测多物种时,蓝鳍金枪鱼、裸盖鱼、异鳞蛇鲭源性成分的检出限为0.1 ng。
以含蓝鳍金枪鱼、裸盖鱼、异鳞蛇鲭成分50%、10%、5%、1%、0.5%、0.10%的质量分数梯度混合样品的DNA为模板,开展多重real-time PCR扩增,并分析熔解曲线,测试所建多重real-time PCR体系的相对检出限,测试结果显示采用所建多重real-time PCR体系检测混合样品DNA,蓝鳍金枪鱼、裸盖鱼、异鳞蛇鲭源性成分的检出限分别为0.5%、1%、0.5%。
本研究开发的多重real-time PCR检测方法的检出限与周彤等[35]开发的多重real-time PCR检出肉制品中动物源性的检出限相当,均能做到多物种检出限0.1 ng。已有 文献[36]报道0.1 ng DNA的检出限能充分满足鱼制品掺假检测的需求。
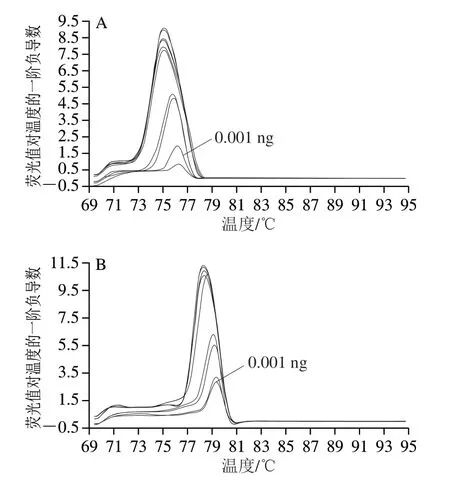

图4 所建多重real-time PCR的灵敏度检测Fig. 4 Sensitivity evaluation of multiplex real-time PCR
2.4 多重real-time PCR体系实际应用效果验证
为检验所建方法在实际样品中的应用效果,并更进一步验证所建多重real-time PCR的准确性。用本方法对采集的市售金枪鱼切块、裸盖鱼切块、烤鳕鱼片、鳕鱼罐头类、金枪鱼罐头类样品进行检测,结果表明,Tm值在(74.98±0.60)℃范围内出现熔解峰(蓝鳍金枪鱼源性成分)的有4 份样品;Tm值在(78.65±0.71)℃范围内出现熔解峰(裸盖鱼源性成分)的有8 份样品;Tm值在(82.38±0.25) ℃范围内出现熔解峰(异鳞蛇鲭源性成分)的有6 份样品;3 个Tm值范围内均未出现熔解峰的样品22 份。

表5 市场采购水产品的检测结果Table 5 Results of detection of aduleration in commercial aquatic products
从样品分类及结果的统计分析(表5)可以看出,金枪鱼切块、裸盖鱼切块、烤鳕鱼片、金枪鱼罐头、鳕鱼罐头中均存在标签错误标识或者掺伪,错误标识或者掺伪率达22.5%,所有检测样品中烤鳕鱼片的掺伪或者标签错误标识率最高,高达37.5%。金枪鱼切块制品中有产品标识为白金枪鱼切块,而检测结果显示实际物种为异鳞蛇鲭;烤鳕鱼片和罐头类制品的掺假也多数采用鲶鱼、异鳞蛇鲭等其他廉价或相似鱼种冒充。以上结果证明所建方法在实际样品检验中具有很好应用效果,该多重real-time PCR体系用于实际水产品的快速鉴别准确有效。
3 结 论
本研究针对蓝鳍金枪鱼、裸盖鱼和异鳞蛇鲭的市场检测需求,基于3 种鱼类的线粒体基因序列,利用SYBR Green real-time PCR的熔解曲线法开发了同时检测蓝鳍金枪鱼、裸盖鱼、异鳞蛇鲭3 个物种的多重real-time PCR检测方法。该方法实现了多物种的快速检测,同时降低检测成本,能够满足多样品的快速检测需求。所建的多重real-time PCR检测方法具有很高灵敏度和很好的识别度,在实际水产样品的检测中也显示了不错的应用效果。所建方法能为监管机构快速检测水产类制品的物种提供技术支持,检测结果准确可靠,可供执法部门作为参考依据,同时提高市场监管部门打击水产制品掺假的效率,使其能够有效加强水产品的监管,保护消费者的健康,保证相关企业与消费者经济不受损;此外,所建方法为渔业正确识别所捕捞鱼类物种提供技术支持,从而改善目前金枪鱼、鳕鱼市场真实产品物种与标识物种不符的乱象,因此,所建方法会有很好的应用前景。
