兔皮胶原蛋白的性质及凝胶临界模型的建立
2020-12-29张晓亮
张晓亮,张 毅
(天津工业大学纺织科学与工程学院,天津 300387)
胶原蛋白是天然细胞质基质的主要成分,是哺乳动物组织中最常见的蛋白质[1-3],它可以作为一种生物医用材料广泛应用于组织工程、医用创伤敷料、药物缓释等领域,同时在食品和化妆品行业也有着广泛的应用[4-6]。兔皮中胶原蛋白含量高,而且在功能性质等方面优于水产类胶原蛋白,同时不存在猪皮、牛跟腱胶原蛋白在疫病等方面的限制,因此可以作为一种新的胶原原料[7-8]。
胶原蛋白凝胶是胶原蛋白分子在溶液中形成的具有三维网格结构的一种生物材料,它作为胶原蛋白一种重要的应用形式,在食品、药物缓释材料、胶原海绵和胶原膜的制备等方面有着广泛应用[9-10]。国内外对于胶原蛋白凝胶的研究多集中在凝胶的功能性和应用性,而对于胶原蛋白形成凝胶条件的研究却鲜有报道[11-12]。本实验采用酸法从兔皮中提取胶原蛋白[13-15],并对其理化性能进行分析,其次采用透析法制备胶原蛋白凝胶[16],并且通过流变学分析pH值、温度、浓度对兔皮胶原蛋白(rabbit skin collagen,RSC)溶液存储模量(G’)和损耗模量(G”)的影响,进而探究这3 种条件对RSC形成凝胶的影响[17-18]。然后通过多组试验获得广泛的数据,最后构建多元非线性数学模型,从理论上阐述pH值、温度、质量浓度与G’和G”的数学关系,进而得到RSC溶液形成兔皮胶原蛋白凝胶(RSC-gel)的临界条件,为胶原蛋白凝胶的形成及应用提供理论基础。
1 材料与方法
1.1 材料与试剂
肉兔皮 山东中梁农业发展有限责任公司;乙酸、NaOH、NaCl(均为分析纯),KBr(光谱纯) 天津风船试剂有限公司。
1.2 仪器与设备
QSJ-C03A1打浆机 小熊电器股份有限公司;pH计 梅特勒-托利多仪器(上海)有限公司;TGL-16M离心机 湘仪(长沙)有限公司;SCIENTZ-10N真空冷冻干燥机 宁波新芝有限公司;MD 8000~14000透析袋 美国Sigma公司;CVO流变仪 英国Malvern公司;Evolution 201紫外-可见光分光光度计、Nicolet iS50型傅里叶变换红外光谱仪 美国Themo Fisher公司;LA8080型氨基酸分析仪 日本Hitachi公司。
1.3 方法
1.3.1 RSC的提取
将冷冻的兔皮用去离子水洗净后剪成1 cm2块状,然后置于0.1 mol/L的NaOH溶液中搅拌16 h,除去兔皮上的非胶原物质。将洗净后的兔皮放入1 mol/L的乙酸溶液中,待兔皮溶胀后,用打浆机将兔皮打成浆状,继续加入上述乙酸溶液,使兔皮与乙酸溶液料液比为 1∶30(g/mL)。水解48 h后以10 000 r/min离心30 min,用5 mol/L的NaOH溶液将上清液的pH值调至中性,边搅拌边加入NaCl盐析,使其最终浓度为5 mol/L。将盐析出来的蛋白质以10 000 r/min离心30 min后复溶在1 mol/L的乙酸溶液中,然后以去离子水为透析液,将离心得到的蛋白质置于透析袋中,每6 h更换一次透析液,透析72 h后进行冷冻干燥,得到白色的兔皮胶原海绵。
1.3.2 RSC的提取率
根据GB/T 9695.23—2008《肉与肉制品 羟脯氨酸含量测定》[19]分别测定兔皮(湿)和RSC的羟脯氨酸含量,根据羟脯氨酸的含量计算RSC的提取率,如式(1) 所示:

1.3.3 氨基酸分析
采用氨基酸分析仪对RSC进行分析。
1.3.4 有机波谱分析
紫外-可见光光谱分析:将RSC溶解在1 mol/L的乙酸溶液中,以该乙酸溶液为空白在190~600 nm波长范围内进行光谱扫描,步长1 nm,积分时间0.05 s。
傅里叶变换红外光谱分析:在干燥条件下,将RSC粉末与KBr混合、压片,光谱扫描范围500~4 000 cm-1, 分辨率2 cm-1。
1.3.5 热变性温度的测定
配制质量分数为1%的RSC溶液,通过流变仪测定溶液在不同温度下的黏度值,温度范围为10~50 ℃,升温速率为5 ℃/min。
1.3.6 外部条件对RSC-gel形成的影响
1.3.6.1 溶液pH值对RSC-gel形成的影响
配制质量浓度为10 mg/mL的RSC溶液,置于透析袋中透析,在不同pH值时取样,选用流变仪的振荡模式测定溶液的G’与G”,测试夹具为20 mm平板,间隙为1 000 μm,振荡频率为0.2 Hz,振荡应力为0.08 Pa,测试温度为25 ℃。
1.3.6.2 溶液质量浓度对RSC-gel形成的影响
配制质量浓度为7、7.5、8、8.5、9 mg/mL的RSC溶液,置于透析袋中透析,在溶液pH 5时取样,选用流变仪的振荡模式测定溶液的G’与G”,流变仪其他参数设置同1.3.6.1节。
1.3.6.3 温度对RSC-gel的形成的影响
配制质量浓度为8 mg/mL RSC溶液,置于透析袋中透析,在pH 5时取样,采用连续升温模式,选用流变仪的振荡模式测定溶液的G’与G”,温度测试范围为15~40 ℃,升温速率为2 ℃/min,流变仪其他参数设置同1.3.6.1节。
1.3.7 RSC-gel的凝胶临界条件分析
分别配制质量浓度为6、8、10、12、20 mg/mL的RSC溶液,置于透析袋中透析,在不同pH值时,选用流变仪的振荡模式分别测量不同温度条件下RSC溶液的G’与G”,流变仪其他参数设置同1.3.6.1节。
1.4 数据处理
将所得实验数据通过Matlab软件对数据进行分析并建立回归模型,使用SAS软件对回归模型进行检验。
2 结果与分析
2.1 RSC的提取率
羟脯氨酸是胶原蛋白特有的亚氨基酸,通过比色法测定提取前后羟脯氨酸含量的变化,可以准确描述胶原蛋白的提取率[20]。按照GB/T 9695.23—2008方法,以羟脯氨酸浓度为横坐标、吸光度为纵坐标,绘制标准曲线方程为Y=0.01+0.19X,R2=1。通过计算得RSC提取 率为69.18%。
2.2 氨基酸分析

表1 RSC氨基酸分析结果Table 1 Amino acid composition of RSC
从表1可以看出,RSC氨基酸总量为95.666%,含有7 种必需氨基酸与11 种非必需氨基酸,必需氨基酸质量分数为14.623%,非必需氨基酸质量分数为81.043%,其中羟脯氨酸质量分数为9.725%,可以作为一种补充氨基酸的食品源胶原蛋白。
2.3 有机波谱分析
2.3.1 紫外-可见光光谱分析
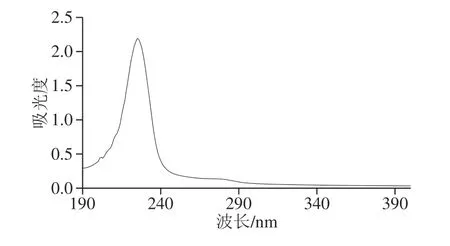
图1 RSC的紫外-可见光光谱图Fig. 1 UV spectrum of RSC
紫外吸收与肽链中的—COOH以及肽键中C=O的n→π*跃迁有关[20]。从图1可以看出,RSC的紫外最大吸收波长位于237 nm,与其他I型胶原蛋白类似,说明RSC为I型胶原蛋白[21]。而且RSC在283 nm和251 nm波长处均无明显的紫外吸收,表明RSC含有很少的苯丙氨酸和酪氨酸,与氨基酸分析结果一致,同时RSC紫外吸收图谱无其他的紫外吸收峰,表明提取得到的RSC纯度高,不含有其他种类的蛋白质[22]。
2.3.2 傅里叶变换红外光谱分析
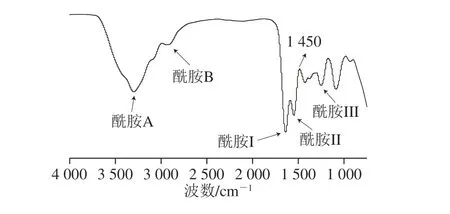
图2 RSC的红外光谱图Fig. 2 FTIR spectrum of RSC
由图2可知,RSC的红外光谱图的特征峰有酰胺A、B和酰胺I、II、III带。酰胺A(3 440 cm-1)是由N—H键的伸缩振动引起的,表明RSC之间具有较多的氢键[23];酰胺B位于2 930 cm-1处,它是由C—H键的伸缩振动导致的。与其他胶原蛋白相比[24],RSC酰胺I带的吸收峰(1 640 cm-1)和酰胺II带的吸收峰(1 550 cm-1)由高频区转入低频区,表明RSC具有更高的结构秩序。酰胺III带位于1 250 cm-1,1 450 cm-1处的峰面积与酰胺III带的吸收峰面积比接近1∶1,说明RSC保持了完整的三螺旋结构[25]。
2.4 热变性温度分析
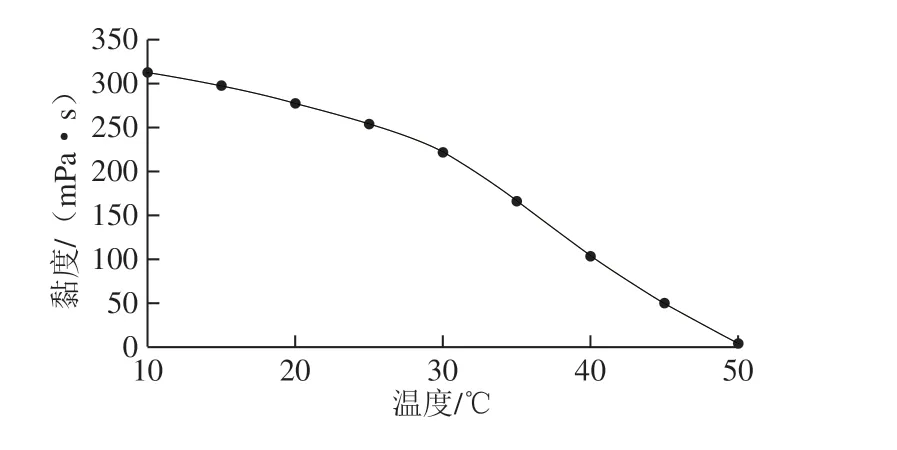
图3 RSC溶液黏度随温度变化关系Fig. 3 Relationship of collagen solution viscosity with temperature
胶原蛋白的变性温度可以通过测定其在不同温度下的黏度值获得,RSC溶液黏度值下降50%时的温度即为RSC变性温度[26]。由图3可知,随着温度的升高,RSC溶液黏度值逐渐下降,其热变性温度为35.8℃,与中华鳖裙边胶原蛋白的变性温度相当(36.5 ℃),但高于鳕鱼皮(20 ℃)胶原蛋白的变性温度[27-28]。
2.5 外部条件对RSC-gel形成的影响
胶原蛋白分子在溶液中形成凝胶的实质是溶液中分子由无序状态向有序空间结构的转变,可以通过测定Maxwell力学模型中G’和G”描述这种变化过程[16]。G’描述的是材料存储弹性变形能量的能力,是测定材料变形后回弹的指标,通常表征材料的类固体行为;G”是指材料在发生形变时,由于黏性形变而损耗的能量大小,反映材料黏性大小,通常表征材料的类液体行为。
当G’<G”时,溶液呈液态,可近似看作是一种黏性液体;随着G’增加,当G’=G”时,溶液呈半固态,凝胶开始形成;随着G’持续上升,当G’>G”时,溶液逐渐由半固态向类固态转变。
2.5.1 pH值对RSC-gel形成的影响
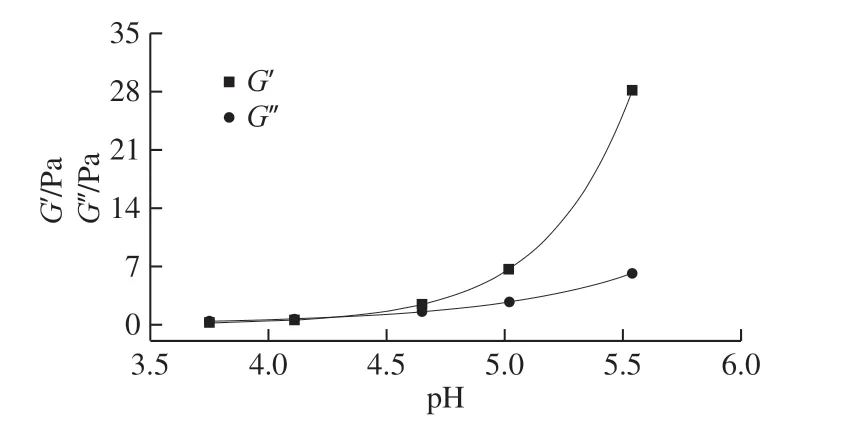
图4 RSC溶液pH值对凝胶的影响Fig. 4 Effect of pH on RSC gelation
从图4可以看出,开始时,随着pH值的升高,RSC溶液的G’和G”变化很小,且G’<G”,这是由于溶液中的 H+抑制了分子间氢键的形成,使得此时的RSC溶液具有液体的性质;而随着透析的进行,溶液pH值逐渐增大,H+浓度逐渐减小,氢键等分子间作用力逐渐增强,RSC分子间产生更多的纠缠和网格结构,溶液开始向凝胶态转变,G’和G”均逐渐增大,且G’增大的速率高于G”,当G’≥G”时,溶液处于凝胶态。当G’=G”时,RSC溶液处于临界凝胶态[29]。
2.5.2 RSC溶液质量浓度对RSC-gel形成的影响

图5 RSC溶液质量浓度对凝胶的影响Fig. 5 Effect of collagen concentration on RSC gelation
从图5可以看出,当溶液质量浓度较低时,两种模量值很小,这是由于溶液中RSC分子的数目较少,此时 G’<G”,溶液还处于液态;而随着胶原蛋白质量浓度的增加,溶液中RSC分子数增加,G’和G”都逐渐增大,且G’的增长速率大于G”,当G’=G”时,溶液处于临界 凝胶态[30]。
2.5.3 温度对RSC-gel形成的影响
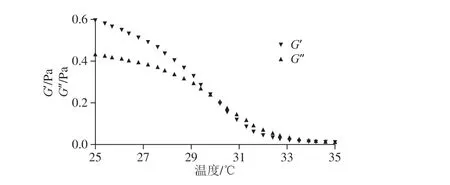
图6 RSC溶液温度对凝胶的影响Fig. 6 Effect of temperature on RSC gelation
从图6可以看出,当体系温度较低时,溶液的两种模量较高,这是由于分子热运动小,此时G’>G”,体系处于凝胶态;而随着温度的升高,分子热运动逐渐加剧,两种模量均呈下降趋势,且G’的下降速率大于G”,当G’=G”时,溶液处于临界凝胶态;当G’<G”时,分子热运动加剧,溶液处于非凝胶态。
从图4、5可以看出,RSC溶液的pH值和质量浓度与凝胶形成呈正相关,且两种模量随pH值和浓度的变化近似指数函数关系;而从图6可看出,RSC溶液温度与凝胶形成呈负相关,且在凝胶点附近,RSC溶液的两种模量随着温度的升高而降低,近似于负相关的指数关系,因此可以通过构建一个数学模型描述pH值、质量浓度、温度对RSC-gel模量的影响,以此确立凝胶的临界条件。
2.6 RSC-gel临界条件分析
2.6.1 数据处理与线性化转变
将pH值、温度、质量浓度3 个指标的数据作为自变量x,构建自变量矩阵:
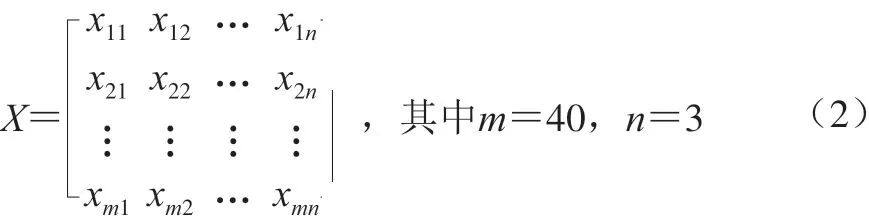
将多组试验所得的G’和G”分别作为因变量yG’和yG”,构建因变量矩阵:
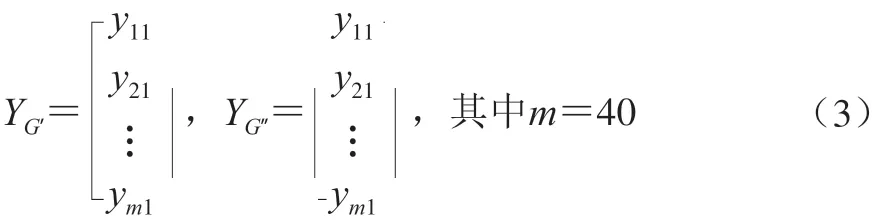
综合上述分析,构建pH值、温度、质量浓度与模量(G’和G”)的数学模型:

式中:G为存储模量G’或损耗模量G”;P为RSC溶液的pH值;C为RSC溶液的质量浓度;T为RSC溶液的温度;k为系数。由上述模型可知,该数学模型为多元非线性数学模型,经线性化得:
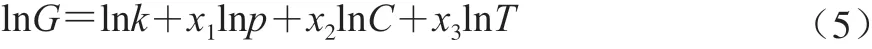
2.6.2 多元线性回归分析
2.6.2.1G’回归分析
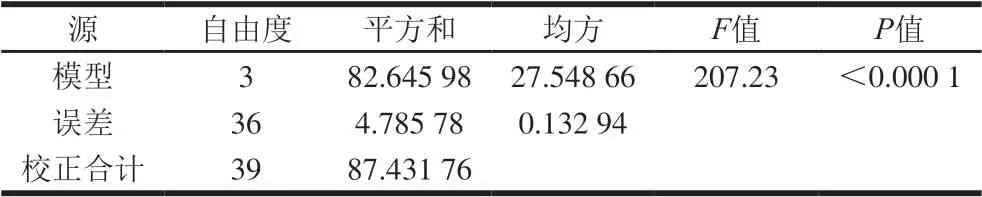
表2 G’方差分析 Table 2 Analysis of variance of G’ model
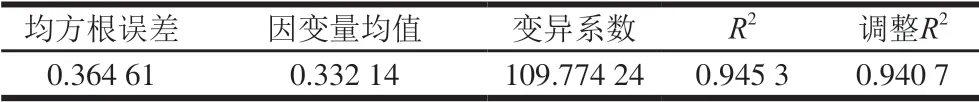
表3 G’回归分析Table 3 Regression analysis of G’ model
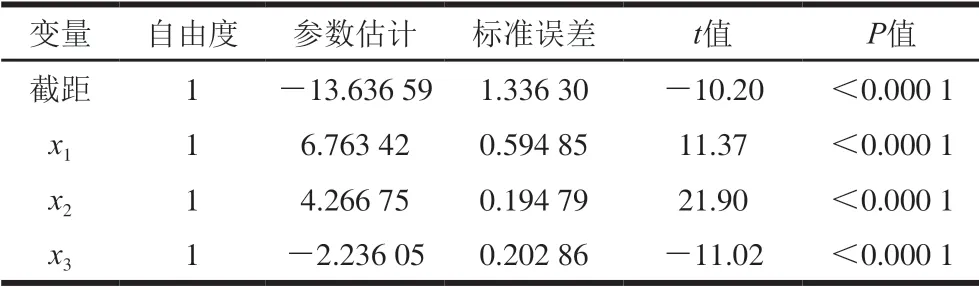
表4 G’参数估计 Table 4 Parameter estimates of G’ model
由表2可知,其F值为207.23,P值小于0.000 1,认为y1与x1、x2、x3之间具有显著的线性相关关系;由表3可知,R2值为0.945 3,说明该方程具有很高的拟合度。由表4可知,对于常数检验,t=-10.20,P值小于0.000 1,说明截距项通过检验,估计值为-13.64;对于自变量x1、x2、x3,P值均小于0.000 1,说明所有自变量的系数均通过检验,表明该模型具有正确性,自变量系数分别为6.76、4.27 、-2.24。
综合以上分析,可以得到线性回归方程:
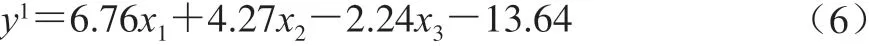
将上述线性回归方程非线性化可得:

2.6.2.2G”回归分析
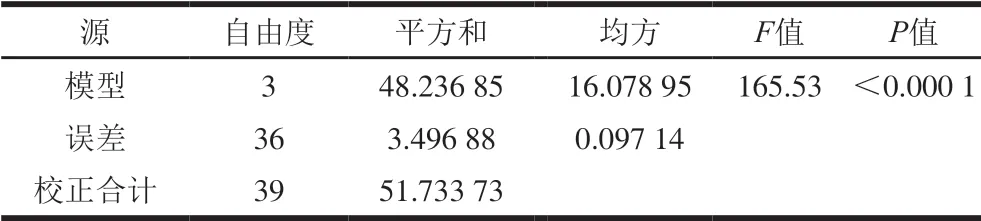
表5 G”方差分析 Table 5 Analysis of variance of G” model

表6 G”回归分析Table 6 Regression analysis of G” model

表7 G”参数估计Table 7 Parameter estimates of G” model
由表5可知,其F值为165.53,P值小于0.000 1,说明y2与x1、x2、x3之间具有显著的线性相关关系;由表6可知,R2为0.932 4,说明该方程的拟合度很高;由表7可知,对常数检验,t=-8.95,P值小于0.000 1,说明截距项通过检验,截距值为-10.22;对于自变量x1、x2、x3,P值均小于0.000 1,说明所有自变量的系数均通过检验,表明该模型具有正确性,自变量系数分别为4.74、3.36 、-1.59。
综合以上分析,可以得到线性回归方程:

将上述线性方程非线性化可得:

2.6.3 凝胶临界模型的建立
从式(7)和式(9)可知,凝胶的两种模量与体系的pH值、质量浓度呈正相关,与温度呈负相关,与单因素试验所得结论一致,且当G’=G”,即G’-G”=0时,胶原蛋白处于凝胶临界状态,联立可得胶原蛋白的临界凝胶条件方程:

式中:P为RSC溶液的pH值;C为RSC溶液的质量浓度;T为RSC溶液的温度。当处于非凝胶态,时,RSC溶液时,溶液处于凝胶态。根据临界方程用Matlab软件作出的三维曲面如图7所示,该曲面可直观表示RSC溶液的pH值、质量浓度与温度对凝胶形成的影响,曲面上所有的点都是凝胶的临界点,曲面的内侧为凝胶态,外侧为非凝胶态。

图7 凝胶临界曲面Fig. 7 Critical surface of RSC gelation
3 结 论
采用酸法从肉兔皮中提取并得到了胶原蛋白,提取率达到69.18%。通过紫外光谱图发现RSC的最大吸收波长为237 nm,属于I型胶原蛋白,红外光谱图表明胶原蛋白保持了原有的三螺旋结构,同时测得其变性温 度为35.8 ℃。
通过流变学对RSC凝胶条件进行研究后发现,RSC溶液pH值和质量浓度与RSC-gel形成呈正相关,而溶液温度与RSC-gel形成呈负相关。
通过构建数学模型分析pH值、温度、质量浓度对与RSC溶液形成凝胶的综合影响,得到RSC溶液G’和数学关系,其凝胶临界条件为。上述数学关系对于其他来源的胶原蛋白同样适用,上述数学模型也可为其他材料凝胶的成形提供理论基础。
