植物乳杆菌D1501发酵黄浆水的抑菌活性及其中细菌素的分离与鉴定
2020-12-29戴意强HafizAbdulRASHEED夏秀东董明盛
陆 洲,戴意强,Hafiz Abdul RASHEED,吴 寒,夏秀东,董明盛,
(1.南京农业大学食品科技学院,江苏 南京 210095;2.江苏省农业科学院农产品加工研究所,江苏 南京 210014)
豆制品作为中国的传统食品,深受人们喜爱。在传统豆制品生产过程中,为了保持特定的含水量和弹性,必须施加一定的压力排出多余的“废水”。由于其为棕黄色胶体混合物,因此被称为黄浆水(也称大豆乳清)[1]。 我国黄浆水产量极大,据统计每年约有0.55~0.7亿 t黄浆水产生[2]。由于豆制品企业规模小、分布散,黄浆水集中处理难度大成本高,生产过程中黄浆水常被当作废水直接排放到环境中,加工利用程度很低,资源浪费严重,也造成严重的环境污染[3]。黄浆水富含色素、盐类、蛋白质、脂类和碳水化合物,极易为微生物利用快速生长繁殖。黄浆水经微生物发酵酸化形成酸浆,只有很少一部分被重新利用制成豆腐酸凝剂,大部分都被视为废弃物直接排放[4]。这无形中又增加了环境污染,形成一种恶行循环。因此,合理利用酸浆实现黄浆水的回收利用具有很大现实意义。
细菌素是某些细菌在代谢过程中,通过核糖体合成机制产生并释放到胞外的对同种或亲缘关系较近的菌株一类具有抑菌活性的多肽或蛋白质[5-6]。相比其他化学防腐剂,细菌素在胃肠道中可被蛋白酶降解,因其天然、高效、耐高温、无残留、无抗药性以及良好的生物相容性等优点,常作为食品中的天然生物防腐剂,也常被用作饲料添加剂以及应用于医学等领域,具有广阔的发展前景[7-12]。
细菌素的分离纯化是解析细菌素结构和理化性质的重要基础,可为实现细菌素在食品工业上的应用提供理论依据。目前国内外已经有上百种细菌素被纯化出来,形成了较为成熟的纯化体系。但由于细菌本身的特异性,纯化方法很难统一。通常根据细菌素分子质量大小、疏水性、阴阳离子性等特点进行分离纯化。纯化过程通常分为3 个阶段:粗提、初步纯化和精细纯化。细菌素的粗提取主要采用硫酸铵沉淀法、丙酮低温沉淀法、有机溶剂萃取法和菌体吸附解析法等方法[13-16]。其中硫酸铵沉淀法在大多数细菌素的粗提中被广泛应用,而有机溶剂萃取法由于工序复杂已基本被淘汰。初步纯化的目的是去除大量的杂蛋白,得到50%~90%纯度的细菌素用于精细纯化,通常采用凝胶层析和离子交换色谱法[17]。 精细纯化是对细菌素进行进一步高度纯化,去除痕量的干扰杂质,使细菌素纯度达到99%,便于质谱分析其分子质量、结构以及进行氨基酸测序,这一阶段采用的方法主要是高效液相色谱法[18]。
本课题组已经研究发现植物乳杆菌D1501是细菌素的产生菌,其利用MRS(de Man Rogosa Sharpe)琼脂可以产生大分子细菌素。本实验以综合利用黄浆水及其酸浆为出发点,以植物乳杆菌D1501发酵黄浆水形成的酸浆为研究对象,采用超滤分离、RESOURCE-Q阴离子交换层析、C18柱反相层析、二次反相层析等方法,分离得出高纯度细菌素,并利用液相色谱-串联质谱(liquid chromatograph-tandem mass spectrometry,LC-MS/MS)法分析测定细菌素的分子质量和氨基酸组成。从而为深入研究其理化性质提供基础,为利用酸浆产业化生产新型生物防腐剂提供理论依据,为实现黄浆水资源的综合利用和保护环境提供新的可能。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
植物乳杆菌D1501,从贵州省剑河侗族酸肉中分离得到;其他指示菌株均为实验室保藏菌株。
1.1.2 培养基与试剂
黄浆水由南京果果豆制品有限公司提供,121 ℃高压蒸汽灭菌20 min备用;MRS培养基、LB(Luria-Bertani)液体培养基、LB固体培养、马铃薯葡萄糖琼脂(potato dextrose agar,PDA)固体培养基、胰酪胨大豆琼脂(trypticase soy-yeast extract agar,TSA-YE)固体培养基 北京陆桥技术股份有限公司;过氧化氢酶、脂肪酶、α-淀粉酶、胃蛋白酶、胰蛋白酶、蛋白酶K、 考马斯亮蓝G250(分析纯)、牛血清白蛋白(bovine albumin,BSA)(分析纯)、三氟乙酸(色谱纯)、 乙腈(色谱纯) 美国Sigma-Aldrich公司。
1.2 仪器与设备
UV-2450紫外分光光度计 日本Shimadzu公司; Powerdry LL3000冷冻干燥机 美国Heto公司; WD-9405A型脱色摇床 北京六一仪器厂;BF260生化培养箱 德国Binder公司;CP1502电子天平 奥豪斯仪器(上海)有限公司;HHS型电热恒温水浴锅 上海博迅实业有限公司;PHSJ-5实验室PH计 上海仪电科学仪器股份有限公司;BGG-907(A)电热鼓风干燥箱 上海恒一科学仪器有限公司;G154TW立式自动压力蒸汽灭菌器 致微(厦门)仪器有限公司;ST16R高速冷冻离心机、Thermo超净工作台、BSC.1300.B2生物安全柜 赛默飞世尔科技公司;Hei-VAP Advantage(HL)旋转蒸发仪 德国Heidolph公司;ÄKTA Purifier 10二维液相色谱系统 美国GE Healthcare公司。
1.3 方法
1.3.1 乳酸菌的制备
将甘油管保藏的植物乳杆菌D1501接种于MRS液体培养基,37 ℃静置培养16 h,传代2 次后备用。
1.3.2 指示菌的活化
将各指示菌按相应的培养基和培养温度传代2 次后,以1%接种量接种于相应培养基中,培养至对数生长期备用。
1.3.3 酸浆上清液的制备
将传代2 次的植物乳杆菌D1501以3%接种量接种于黄浆水液体培养基,37 ℃静置培养24 h。发酵液经4 ℃、12 000 r/min低温冷冻离心15 min后,收集酸浆上清液,置于4 ℃保存备用。
1.3.4 试样冻干将需要冻干浓缩的液体试样置于冷冻干燥机, -40 ℃、48 h得到冻干粉。
1.3.5 抑菌活性的测定
采用琼脂扩散牛津杯法,以游标卡尺测量抑菌圈直径,以此表示待测样液的抑菌活性[19]。将无菌牛津杯放于无菌平皿中,将指示菌菌落数量调至108CFU/mL,按1%接种量接种于冷却至46 ℃的LB固体培养基,振荡混匀后倾注平皿,待培养基凝固后,用无菌镊子将牛津杯取出,在孔内注入200 μL待测样液,4 ℃扩散5 h后,37 ℃静置培养12 h,观察并测量抑菌圈直径。
1.3.6 菌株D1501发酵黄浆水的抑菌特性
1.3.6.1 菌体残留细胞抑菌的排除
将酸浆上清液用0.22 μm微孔滤膜过滤除菌后做抑菌实验,排除离心上清液中残留菌体细胞对抑菌实验的影响。
1.3.6.2 酸性产物抑菌的排除
将酸浆上清液pH值调至6.0后进行抑菌实验测定活性,以排除代谢产物中乳酸、乙酸等酸性物质对抑菌活性的影响。
1.3.6.3 抑菌物质化学本质的定性
将酸浆上清液的pH值分别调至H2O2酶(pH 6.0)、胃蛋白酶(pH 2.0)、胰蛋白酶(pH 7.0)、蛋白酶K(pH 7.4)、脂肪酶(pH 7.0)和α-淀粉酶(pH 6.0),然后分别加入6 种酶,使酶的终质量浓度分别达到0.1、1.0、2.5、5.0 mg/mL,37 ℃反应2 h,沸水浴5 min将酶灭活。将pH值调至6.0,以金黄色葡萄球菌ATCC6538为指示菌进行抑菌实验,以未经酶处理发酵上清液的抑菌活性为100%进行相对活性比较,计算相对抑菌活性。
1.3.6.4 抑菌物质对温度的敏感性
取等量酸浆上清液于7 支离心管,分别在-20、4 ℃冰箱放置2 h,在37 ℃水浴2 h,在60、90、100 ℃水浴30 min,以及121 ℃高压灭菌15 min。放至室温后,以金黄色葡萄球菌ATCC6538为指示菌,测定抑菌活性,以室温未处理细菌素的抑菌活性为100%进行相对活性比较,计算相对抑菌活性。
1.3.7 细菌素的分离纯化
1.3.7.1 超滤分离
将发酵上清液pH值调至6.0,并用0.22 μm微孔滤膜过滤除菌得到无细胞中性上清液。用30、10、3 kDa的超滤管依次处理中性上清液,将其分为<3 kDa、3~10 kDa、10~30 kDa和>30 kDa四个组分,分别记为组分A、B、C、D,将其体积各自浓缩成25 mL,以金黄色葡萄球菌ATCC6538为指示菌,分别测定蛋白含量与抑菌活性。
1.3.7.2 RESOURCE-Q阴离子交换层析
先用20 mmol/L、pH 8.0的Tris-HCl缓冲液平衡RESOURCE-Q层析柱至电导值恒定不变。上样量2 mL,流速1.0 mL/min,先以含0~1 mol/L NaCl的Tris-盐酸(pH 8.0,0.02 mol/L)缓冲液体积分数15%洗脱,再按15%~50%进行线性洗脱,收集各峰组分,冻干定容至10 mL后,以金黄色葡萄球菌ATCC6538为指示菌,测定蛋白含量及抑菌活性。
1.3.7.3 反相高效液相色谱层析
将1.3.6.2节中有抑菌活性的组分采用反相高效液相色谱300SB-C18柱(150 mm×4.6 mm,5 μm)分析。洗脱条件为:流动相A:0.1%三氟乙酸溶液,流动相B:0.1%三氟乙酸-乙腈溶液;流速0.8 mL/min;进样量20 μL。0~10 min,95%~75% A,5%~25% B;1 0 ~1 5 m i n,7 5%~7 0% A,2 5%~3 0% B;1 5 ~3 0 m i n,7 0%~4 5% A,3 0%~5 5% B;30~35 min,45%~95% A,55%~5% B。在检测波长214 nm处收集蛋白峰。分别冻干定容成5 mL,以金黄色葡萄球菌ATCC6538为指示菌,测定各组分的蛋白含量及 抑菌活性。
1.3.7.4 二次反相高效液相色谱层析
将测定有抑菌活性的组分,进行二次反相色谱分析。洗脱条件为:流动相A:0.1%三氟乙酸溶液,流动相B:0.1%三氟乙酸-乙腈溶液;流速0.8 mL/min;进样量20 μL。0~10 min,97%~90% A,3%~10% B;1 0 ~2 0 m i n,9 0%~8 5% A,1 0%~1 5% B;20~30 min,85%~97% A,15%~3% B。在检测波长214 nm处收集蛋白峰。分别冻干定容成1 mL,以金黄色葡萄球菌ATCC6538为指示菌,测定各组分的蛋白含量及抑菌活性。
1.3.8 高效液相色谱检测细菌素纯度
将提纯的细菌素冷冻干燥后,用体积分数15%乙腈溶液溶解,用高效液相色谱SHIMADZU Inertsil ODS-SP柱(250 mm×4.6 mm,5 μm)检测细菌素纯度。洗脱条件为:流动相A:0.1%三氟乙酸溶液,流动相B:0.1%三氟乙酸-乙腈溶液;流速1.0 mL/min;进样量20 μL。0~25 min,95%~35% A,5%~65% B;25~28 min,35%~5% A,65%~95% B;28~32 min,5% A,95% B;32~35 min,5%~95% A,95%~5% B;在检测波长214 nm下观察出峰情况。
1.3.9 LC-MS/MS测定细菌素精确分子质量和氨基酸序列
将提纯的细菌素冷冻干燥后用15%三氟乙酸溶液溶解,取1 μL进行质谱分析。流速为0.2 mL/min, 流动相为5 0%水-5 0%甲醇,在正离子模式下 进行m/z300~200的全扫描,并用Peaks 7.0对所得数据进行分析。
1.3.10 纯化方案评价
1.3.10.1 蛋白质含量的测定
采用考马斯亮蓝G-250法测定蛋白质含量,以BSA为标准蛋白溶液,在595 nm波长下测得的吸光度A595nm与蛋白质量浓度呈正相关。以蛋白质量浓度为横坐标,以吸光度为纵坐标绘制标准曲线并测定各待测液中的蛋白质量浓度[20]。
1.3.10.2 细菌素Nisin效价曲线的测定
准确称取500 mg Nisin标准品(效价106IU/g),溶于50 mL无菌0.02 mol/L的稀盐酸溶液,配制成104IU/mL的Nisin标准液[21]。用0.02 mol/L HCl依次将104IU/mL的Nisin标准液稀释成效价为1.0、2.5、5、10、25、100、250、500、1 000、2 500、5 000、10 000 IU/mL的标准溶液,以金黄色葡萄球菌ATCC6538为指示菌,以琼脂扩散牛津杯法测定抑菌活性。以Nisin效价(IU/mL)的对数值为横坐标,以抑菌圈直径(mm)为纵坐标,绘制标准曲线。
2 结果与分析
2.1 菌株D1501发酵黄浆水的抑菌特性
将菌株D1501发酵黄浆水制备的酸浆中和离心,并用0.22 μm微孔滤膜过滤除菌,得到无细胞上清液(D1501酸浆),对其进行抑菌活性检测。图1表明,D1501酸浆对指示菌大肠杆菌K-12和金黄色葡萄球菌ATCC6538有明显抑菌活性,而未发酵黄浆水没有检测到明显的抑菌作用,表明D1501菌株在黄浆水中产生了有机酸以外的抑菌物质。
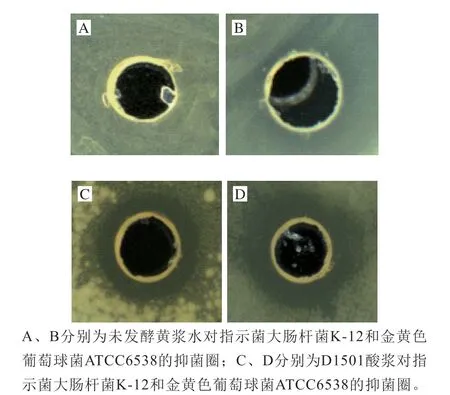
图1 未发酵黄浆水及D1501酸浆对指示菌的的抑制作用Fig. 1 Antimicrobial activities of unfermented soy whey and soy whey fermented by L. plantarum D1501

表1 D1501酸浆的抑菌活性Table 1 Inhibition zone diameters of soy whey fermented by L. plantarum D1501
表1结果可见,D1501酸浆对供试的植物乳杆菌70810、嗜热链球菌等6 株乳酸菌,金黄色葡萄球菌、李斯特菌、蜡样芽孢杆菌和粪肠球菌等14 株革兰氏阳性菌,及鼠伤寒沙门氏菌、大肠杆菌K-12、大肠埃希氏菌O157:H7、福氏志贺氏菌、铜绿假单胞菌和荧光假单胞菌等8 株革兰氏阴性菌有明显的抑制作用。同时D1501酸浆对假丝酵母表现出弱抑菌活性,但对酿酒酵母和2 株霉菌没有抑制作用。值得指出的是,D1501酸浆对植物乳杆菌D1501自身没有明显抑菌活性,这一结果暗示该酸浆中的抑菌物质可能是一种细菌素,因为Konisky[22]指出细菌素具有自身免疫性。
由表2结果可知,经过氧化氢酶、脂肪酶、α-淀粉酶处理的发酵上清液的抑菌活性均无明显变化,表明发酵上清液中表达抑菌活性的不是H2O2,从而排除了H2O2的抑菌干扰,且抑菌物质中不含碳水化合物和类脂物质。另一方面经过不同质量浓度的3 种蛋白酶处理后,D1501酸浆的抑菌活性明显下降。当蛋白酶质量浓度达到5 mg/mL 时抑菌活性均完全消失,说明植物乳杆菌D1501产生的抑菌物质对蛋白酶敏感。从而确定D1501酸浆中的抑菌物质是多肽或蛋白质类的细菌素。

表2 酶处理对D1501酸浆抑制金黄色葡萄球菌ATCC6538活性的影响Table 2 Effects of enzymes on antimicrobial activity of soy whey fermented by L. plantarum D1501
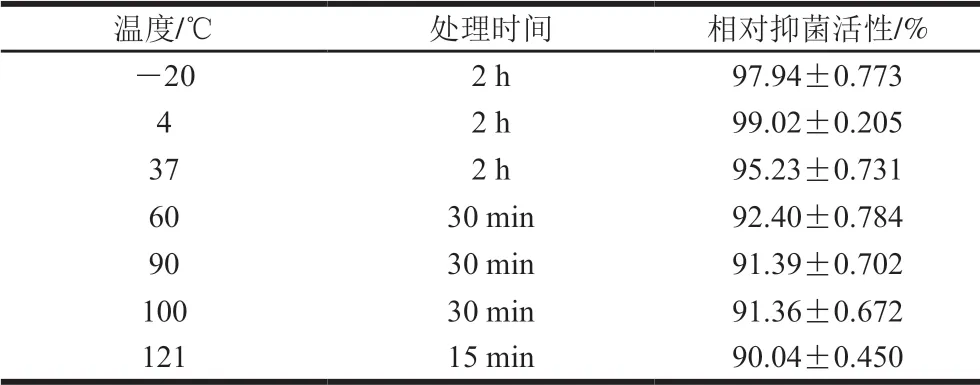
表3 D1501酸浆对温度的耐受性Table 3 Tolerance to temperature of soy whey fermented by L. plantarum D1501
由表3可知,D1501酸浆抑菌活性受温度影响较小,经低温或高温处理一定时间后,抑菌活性均能保持在90%以上。-20、4 ℃处理2 h后能保留97%以上的抑菌活性,37 ℃处理2 h后能保留95.23%的抑菌活性,60、90、100 ℃处理30 min后能保留91%以上的抑菌活性,甚至在121 ℃处理15 min后仍能保留90.04%的相对抑菌活性。结果表明,D1501酸浆具有良好的热稳定性,可应用于食品的热加工处理中。
2.2 细菌素的分离纯化
2.2.1 超滤分离
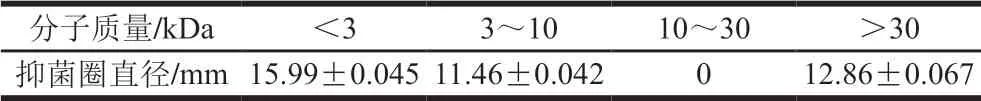
表4 不同分子质量的抑制金黄色葡萄球菌ATCC6538作用Table 4 Antimicrobial activities of ultrafiltration fractions with different molecular masses
如表4所示,相同体积的不同分子质量范围的4 个组分(<3 kDa,3~10 kDa,10~30 kDa,>30 kDa)的抑菌活性各不相同。而<3 kDa分子质量的抑菌活性最大,因此挑选这部分组分的蛋白进行下一步分离纯化。
2.2.2 RESOURCE-Q阴离子层析
图2为组分A(<3 kDa)经RESOURCE-Q阴离子交换层析的洗脱曲线,组分1为穿透峰,组分2、3、4为各洗脱峰。将各组分冻干浓缩至10 mL分别测定蛋白含量和抑菌活性。结果显示穿透峰无抑菌活性,洗脱峰表现出不同的抑菌活性(表5),而组分2抑菌活性最高,因此挑选组分2进行下一步纯化。同时由于该细菌素能被阴离子交换柱吸附,判断该细菌素带负电荷。

图2 RESOURCE-Q离子交换层析洗脱曲线Fig. 2 Elution curve of bacteriocin by RESOURCE-Q chromatography
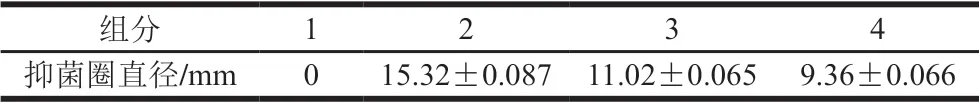
表5 不同组分的抑制金黄色葡萄球菌ATCC6538作用Table 5 Antimicrobial activities of fractions from RESOURCE-Q chromatography
2.2.3 反相高效液相色谱层析
图3为组分2经C18柱反相层析的高效液相色谱分离图,将各峰对应的管8、9、10、11、14分开收集,分别命名为组分a~e,将各组分浓缩至5 mL分别测定各组分的蛋白含量和抑菌活性。由表6可知,除组分e外均具有抑菌活性,而组分c抑菌活性最大,因此挑选组分c进行下一步分离纯化。
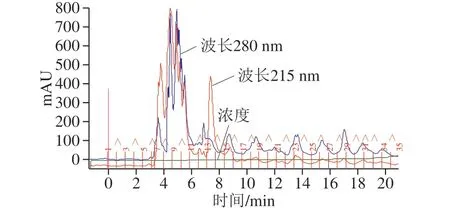
图3 组分2的高效液相色谱图Fig. 3 High performance liquid chromatogram of fraction 2
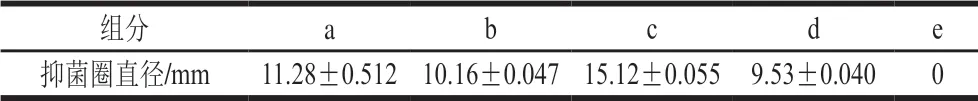
表6 不同组分对金黄色葡萄球菌ATCC6538的抑制作用Table 6 Antimicrobial activities of subfractions of fraction 2
2.2.4 二次反相高效液相色谱层析
图4为组分c经C18柱二次反相层析的高效液相色谱分离图,管6、7为组分I,管8为组分II,管9为组分III,管10为组分IV,管11~13为组分V,将各组分浓缩至1 mL,分别测定蛋白含量和抑菌活性。如表7所示,组分II、III、IV均具有抑菌活性,而组分II的抑菌活性最大,因此选其用于下一步检测。
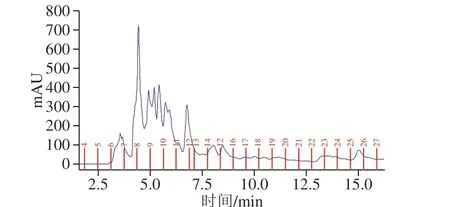
图4 组分c的高效液相色谱图Fig. 4 High performance liquid chromatogram of subfraction c

表7 二次反相层析不同组分对金黄色葡萄球菌ATCC6538的抑制作用Table 7 Antimicrobial activities of the components of subfraction c
2.2.5 高效液相色谱检测细菌素纯度
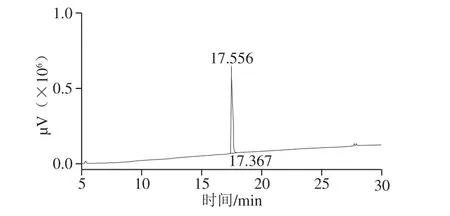
图5 D1501酸浆中细菌素高效液相色谱图Fig. 5 HPLC profile of bacteriocin in soy whey fermented by L. plantarum D1501
由图5可知,纯化后的细菌素经高效液相色谱检测,只出现单峰,说明该细菌素得到纯化,达到色谱纯,可用于进一步质谱解析。
2.2.6 LC-MS/MS测定细菌素精确分子质量及氨基酸序列
通过LC-MS/MS分析(图6),确定该细菌素分子质量约为1 434.90 Da,并通过Peaks7.0软件分析得出氨基酸序列为MCCKVLLLLSRR。将此氨基酸序列在NCBI(National Center for Biotechnology Information)数据库中进行比对,未找到完全匹配的序列。目前,已有多种植物乳杆菌产的细菌素被鉴定报道(表8),通过比较,并未发现与本研究分离出的细菌素完全一致的报道,判断该细菌素是一种未被报道的新型乳酸菌细菌素,并命名为Lp100。
植物乳杆菌来源广泛,多种发酵食品中都能分离出植物乳杆菌。不同植物乳杆菌菌株发酵产生的细菌素分子质量存在很大差异,但大多数被纯化的植物乳杆菌素都为大分子物质,有关小分子细菌素的报道较少。本实验室在植物乳杆菌D1501的MRS发酵液中纯化出一种大分子细菌素,分子质量62 425 Da,而本实验从D1501酸浆中纯化出的细菌素属于小分子物质,分子质量1 434.90 Da。由此可见,细菌素的种类不仅与产生菌株有关,并且发酵基质的不同也会造成产生的细菌素不同。
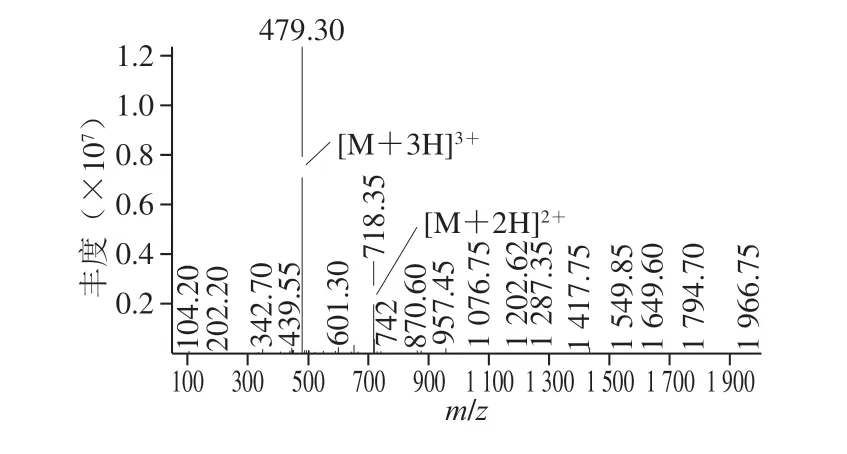
图6 D1501酸浆中细菌素LC-MS/MS图Fig. 6 LC-MS/MS profile of bacteriocin in soy whey fermented by L. plantarum D1501

表8 不同植物乳杆菌产细菌素比较Table 8 Comparison of bacteriocins produced by different strains of L. plantarum
2.3 纯化方案评价
2.3.1 蛋白质含量的标准曲线
在595 nm波长下,吸光度A595nm与蛋白质量浓度的回归方程为y=1.05x+0.002 9,相关系数R2=0.998 9。式中:y为595 nm波长处的吸光度;x为蛋白质质量浓度(mg/mL)。
2.3.2 细菌素Nisin效价曲线
Nisin标准效价的对数值与抑菌圈直径的回归方程为y=1.767 9x+0.463,相关系数R2=0.998 8。式中:y为抑菌圈直径(mm),x为效价的对数值。
2.3.3 植物乳杆菌产细菌素纯化结果
如表9所示,最终细菌素的比活力为747.00 IU/mg,纯化倍数为79.94 倍,回收率为1%。
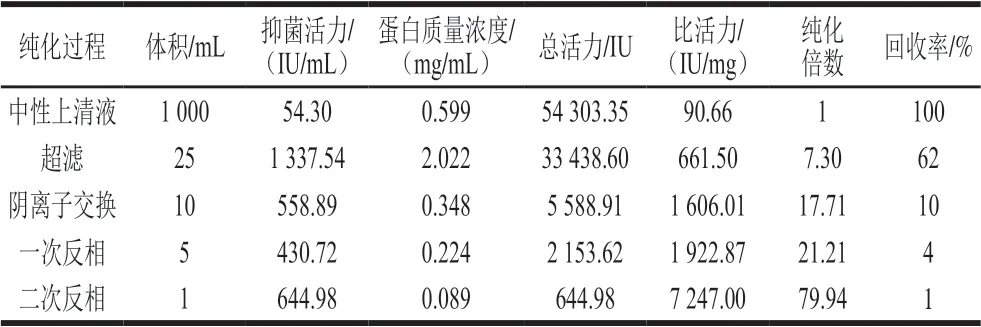
表9 D1501酸浆中细菌素纯化结果Table 9 Summary of purification of bacteriocin from soy whey fermented by L. plantarum D1501
2.4 细菌素Lp100的抑菌谱
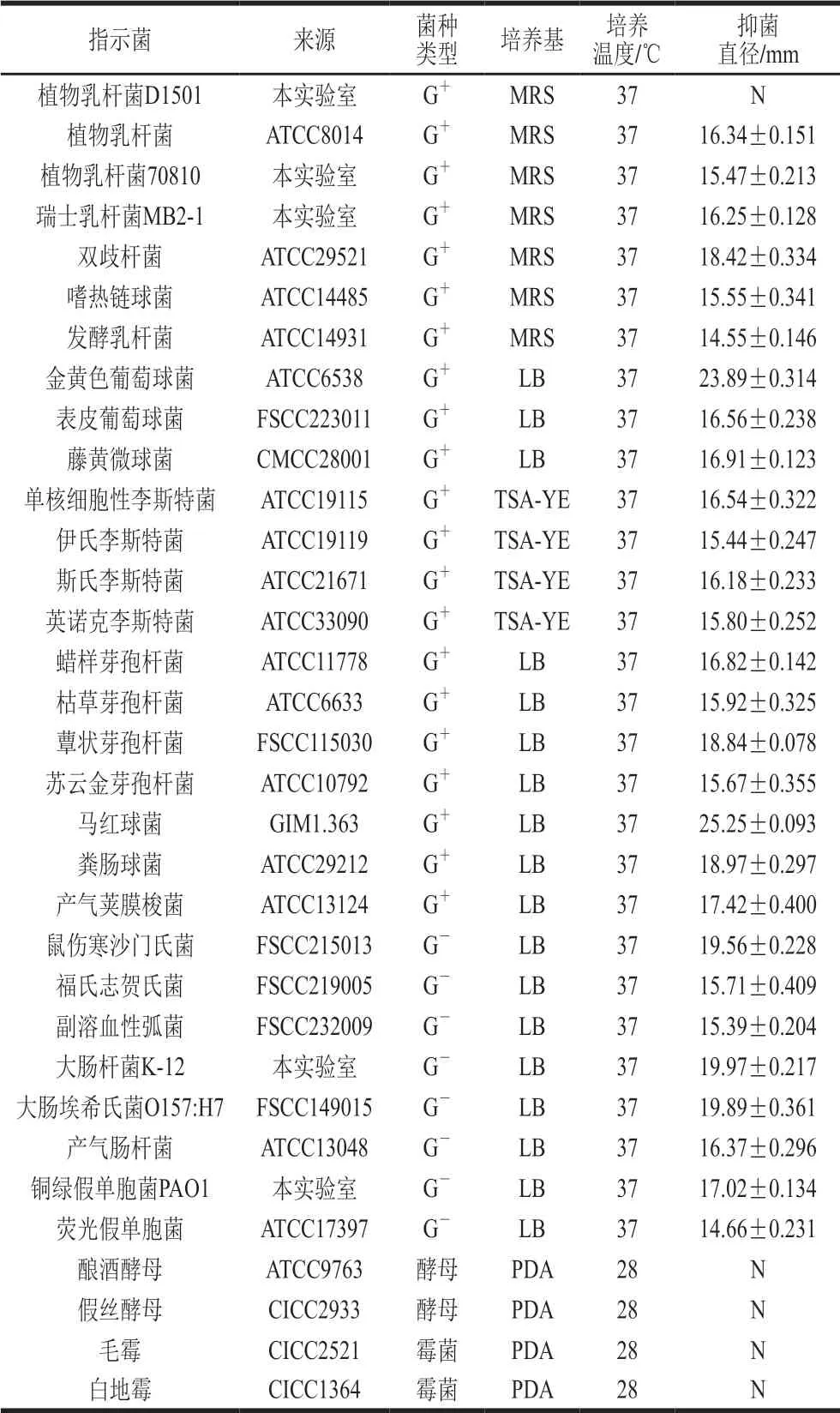
表10 细菌素Lp100的抑菌谱Table 10 Antimicrobial spectrum of bacteriocin Lp100
如表10所示,与D1501酸浆对供试菌株的抑菌效果相类似,细菌素Lp100对亲缘关系较近的乳酸菌具有抑制作用,而对细菌素产生菌植物乳杆菌D1501无抑制作用,表现出自身免疫性。同时,细菌素Lp100对供试的其他革兰氏阳性菌和阴性菌都有较好的抑制作用,表现出广谱抑菌活性。值得指出的是细菌素Lp100对单核细胞性李斯特菌表现出特异的抑菌活性,具有II类细菌素的特性。但细菌素Lp100对供试的霉菌和酵母菌都不表达抑菌活性,而D1501酸浆对供试的假丝酵母有抑制作用,侧面应证D1501酸浆中可能还含有其他细菌素在表达抑菌活性。
3 讨 论
D1501酸浆经RESOURCE-Q阴离子交换层析、反相层析和二次反相层析得到的多个分离峰都能检测出抑菌活性,推测D1501酸浆中可能含多种细菌素,且他们具有相似的离子性和疏水性。目前不乏存在产多种细菌素的植物乳杆菌的报道,与这一推论不谋而合。Diep[33]和Kleerebezem[34]等研究发现植物乳杆菌C11能产生Plantaricin N、Plantaricin EF和Plantaricin JK 3 种细菌素。Ehrmann等[35]研究发现植物乳杆菌TMW1.25能产生细菌素Plantaricin W和Plantaricin 1.25β。Maldonado等[36]研究发现植物乳杆菌NC8能产生细菌素Plantaricin W和Plantaricin NC8。Yi Lanhua等[37]也研究发现棒状乳杆菌XN8也能产生至少2 种细菌素。今后可以对其他具有抑菌活性的组分进行研究,以期分离出D1501酸浆中的多种细菌素,增加D1501酸浆的开发利用价值。
本研究细菌素的回收率仅有1%,在阴离子交换洗脱步骤中损失最多,分析原因可能是细菌素在不同pH值缓冲液中所带电荷与电荷数量不同,部分细菌素可能未吸附在具高度选择性的阴离子柱上,并且在洗脱过程中吸附上细菌素由于所带电荷数量不同而分离成几部分,而整个实验只是选取抑菌活性最高的一部分细菌素用于下一步分离纯化。今后应继续优化该细菌素的分离纯化条件,以提高回收率,为该细菌素投入生产做准备。
4 结 论
研究表明,植物乳杆菌D1501发酵黄浆水所产生的抑菌物质是细菌素,并建立了超滤分离、RESOURCE-Q阴离子交换层析、反相层析、二次反相层析的分离纯化体系,成功从D1501酸浆中分离纯化出色谱纯的小分子细菌素,并命名为Lp100。最终细菌素比活力达到7 247.00 IU/mg, 纯化倍数为79.94 倍,回收率为1%。该细菌素分子质量为1 434.90 Da,氨基酸序列为MCCKVLLLLSRR,属于II类细菌素,并且具有广谱抑菌活性。该细菌素的纯化鉴定为深入研究其理化性质并将其应用于食品的保鲜防腐及利用酸浆产业化生产新型生物防腐剂提供理论依据,为实现黄浆水资源的综合利用和保护环境提供新的可能。
