结合淀粉活性乳酸菌利用生淀粉产酶条件及代谢产物
2020-12-29郭浩男张莉力冯琳琳王天琪赵昕琪许云贺
郭浩男,张莉力,冯琳琳,王天琪,王 成,赵昕琪,许云贺
(锦州医科大学食品科学与工程学院,辽宁 锦州 121001)
肠道微生物作为人体微生物群中种类最丰富的生态系统之一,微生物群高度多样,在这个复杂的系统中,乳酸菌属既是非消化性碳水化合物发酵的贡献者,也是乳酸、醋酸等有机酸的生产者,产生的有机酸及短链脂肪酸具有调节肠道pH值、抑制肠道有害菌生长的功能[1]。 因此,为了促进胃肠道健康,人们食用发酵制品或含有乳酸菌等益生菌的制品作为营养补充剂,但考虑到肠道菌群对外来菌的定植抗性等因素,同时服用被这些益生菌选择性代谢的益生元更是尤为重要[2]。低聚果糖、低聚麦芽糖等是众所周知的益生元,在益生性食品加工中应用广泛[3-6]。Makras等[7]发现,有些乳酸杆菌通过分泌β-果糖苷酶水解利用菊粉型低聚果糖,且利用不同长度及聚合度的低聚果糖,其代谢产物也不同。Zhang Yi等[8]研究表明,莲子III型抗性淀粉对双歧杆菌具有比葡萄糖等单糖更好的增殖作用。然而,由于烹饪条件及饮食习惯等原因,人结肠中存在大量未被人体消化代谢的碳水化合物,如未经糊化的生淀粉、老化淀粉等不同类型的抗性淀粉,这些淀粉作为潜在益生元存在于结肠中[9]。因此,寻找1 株可代谢这种“天然益生元”的益生菌意义重大,但目前对这类具有代谢生淀粉能力的益生性乳酸菌研究较少。
课题组前期在酸浆法沉降加工淀粉的研究中发现,从自然发酵酸浆中分离的乳酸菌能够与淀粉特异性结合,将众多的淀粉颗粒凝集成大的絮凝体,达到沉降效果[10-13],并对其益生性进行了评价[14]。淀粉经过具有淀粉结合活性乳酸菌发酵后,可以显著改变淀粉的化学成分、直链淀粉含量、淀粉老化速率、黏度及其溶解度和膨润力[15]。Crittenden等[16]研究表明,一些双歧杆菌的菌株能够结合到淀粉颗粒表面,而这些能结合到淀粉颗粒上的菌均具有分泌淀粉酶并代谢淀粉的能力。Ze等[17]研究发现,结肠内的布氏瘤胃球菌属利用淀粉时,淀粉水解蛋白与淀粉黏连蛋白结合在一起,构成了一个对生淀粉颗粒水解作用的“淀粉小体”结构。菌体表面具有淀粉结合结构域的酶与淀粉或低聚糖水解能力的糖苷水解酶GH13家族的酶相互锚定[18-19]。由此推测,微生物对基质的黏附为其代谢该基质提供了有利条件。生淀粉酶是指对不经过蒸煮糊化的生淀粉颗粒能表现出水解活性的一类酶[20]。通过实验,初步证明了具有特异性结合淀粉活性的副干酪乳杆菌L1有代谢生淀粉的能力,推测L1具有分泌生淀粉酶的能力。
因此,选用1 株具有特异性结合淀粉活性的副干酪乳杆菌L1为研究对象,通过在生淀粉基质中培养,分析其产酶性质,纯化后确定蛋白分子质量,观察L1在不同来源生淀粉基质中的产酶情况,对产酶条件进行优化,并对水解淀粉过程中的代谢产物进行研究,对乳酸菌在淀粉类基质中的应用有重要意义。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
副干酪乳杆菌L1由锦州医科大学食品科学与工程学院微生物实验室保存,该菌株已保藏到中国普通微生物菌种保藏管理中心(CGMCC4163)。
1.1.2 试剂
甘薯、绿豆淀粉、玉米淀粉、甘薯淀粉均为市购;可溶性淀粉、葡萄糖、麦芽糖、麦芽三糖、麦芽四糖标准品 美国Sigma公司;甲醇、乙腈、磷酸均为 色谱纯;其余试剂均为国产分析纯。
1.1.3 培养基
甘薯汁培养基:甘薯200 g,无水乙酸钠5 g,磷酸氢二钾2 g,牛肉膏5 g,酵母浸粉10 g,葡萄糖22 g,蒸馏水1 000 mL,121 ℃灭菌15 min(前期优化的L1最优培养基)。
MRS肉汤培养基:葡萄糖20 g,蛋白胨10 g,牛肉膏5 g,酵母浸粉4 g,乙酸钠5 g,磷酸氢二钾2 g,硫酸镁0.2 g,柠檬酸三铵2 g,硫酸锰0.05 g,吐温80 1 mL,蒸馏水1 000 mL。
tMRS培养基:未添加碳源的MRS肉汤培养基。
1.2 仪器与设备
立式压力蒸汽灭菌锅 上海博迅实业有限公司医疗设备厂;JB-VS-1300超净工作台 金坛市鑫鑫实验仪器厂;DHP-9082恒温培养箱 苏州佳宝净化工程设备有限公司;T20MM立式高速冷冻离心机 湖南赫西仪器装备有限公司;LC-15C型高效液相色谱仪(配有RID示差检测器) 岛津企业管理(中国)有限公司;Mini-Trans-Blot电泳系统 美国Bio-Rad公司。
1.3 方法
1.3.1 菌种的活化
取-80 ℃冰箱保存的菌种以10%接种量接于甘薯汁培养基,31 ℃培养24 h后,以4%接种量依次传代,至菌液恢复絮凝活力后,扩大培养后备用,所有步骤均在超净台中操作。
1.3.2 L1产酶位置分析
将活化后的L1种子菌液以4%接种量接入无碳源的甘薯汁培养基,种子菌液用无菌水稀释至OD600nm为1.0,生淀粉在热空气干燥箱中,以140 ℃干热灭菌2 h后于超净台中加入培养基,在31 ℃连续培养5 d,每天测定酶活力。在4 ℃条件下,12 000 r/min离心10 min,收集上清液,并通过0.45 nm细菌滤器过滤,沉淀用无菌蒸馏水洗涤2 次,相同条件下离心去上清液,并重悬于等体积无菌蒸馏水,以二硝基水杨酸(dinitrosalicylic acid,DNS)法对发酵液上清液、沉淀以及未离心全菌液进行酶活力测定。
1.3.3 生淀粉酶活力测定
参照Velikova等[21]的方法测定酶活力。以可溶性淀粉为底物,利用0.1 mol/L磷酸氢二钠-柠檬酸缓冲液配制成质量分数2%的生淀粉悬液。首先在250 mL三角瓶中加入19 mL底物,于摇床培养箱中40 ℃预热10 min,之后加入5 mL粗酶液,40 ℃、140 r/min恒温振荡1 h后,加入质量分数4%的NaOH溶液终止反应,取10 mL反应液于 5 000 r/min离心5 min,取上清液利用DNS法OD520nm测定还原糖含量。
酶活力定义为在40 ℃、pH 6.0条件下,1 h水解生淀粉酶产生1 μmol还原糖(以麦芽糖计)所需的酶量。
1.3.4 产酶诱导性及稳定性分析
以tMRS培养基为基础培养基,分别以淀粉、葡萄糖、淀粉和葡萄糖混合物为碳源,并以tMRS为空白对照31 ℃下进行发酵,以24 h为一代次,进行5 次连续传代,分别测定去细胞上清液及菌体沉淀的酶活力,并将上清液、沉淀酶活力之和作为总酶活力进行分析。
1.3.5 生淀粉酶的浓缩纯化
取100 mL酶活力较高的菌液,于4 ℃、10 000 r/min离心10 min,收集上清液,加入硫酸铵至30%,过夜,将样品离心,取上清液后加入硫酸铵至80%,充分沉降后,再次离心,取沉淀,加入等体积0.1 mol/L pH 6.0磷酸氢二钠-柠檬酸缓冲液,置于透析袋中透析过夜,每2 h换一次水,用硫酸钡检测透析是否完全。将样品置于截流量50 kDa的超滤管中,4 ℃、12 000 r/min 离心30 min,浓缩至1 mL,冷冻保存。
1.3.6 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)及基于Native-PAGE的酶谱分析
SDS-PAGE根据Komatsu等[22]的方法,使用10%分离胶和5%浓缩胶。在β-巯基乙醇存在下,将10 μL上样缓冲液混合40 μL蛋白质溶液在100 ℃下加热5 min,进行变性。电泳条件为浓缩胶80 V、分离胶120 V,考马斯染色检测蛋白条带。
根据Karim等[23]的方法并加以改进,以Native-PAGE为基础进行酶谱分析,将蛋白质溶液混合上样缓冲液在70 ℃水浴4 min,然后进行(分离胶中加入1%可溶性淀粉)。电泳结束后,将凝胶在0.1 mol/L pH 6.0磷酸氢二钠-柠檬酸缓冲液的冷溶液中振荡30 min。将凝胶用水漂洗并置于0.3% I2、3% KI中染色5 min,然后将凝胶置于0.1 mol/L pH 6.0磷酸氢二钠-柠檬酸缓冲液中,直到从深蓝色背景中可以看到亮带。与SDS-PAGE不同的是,Native-PAGE的电泳液及上样缓冲液中,均不含SDS和 β-巯基乙醇,且电泳电压为浓缩胶60 V、分离胶100 V,电泳过程中冰浴,防止蛋白变性。
1.3.7 不同来源生淀粉对L1产酶活力分析
以tMRS为基础培养基,甘薯生淀粉、绿豆生淀粉、玉米生淀粉、可溶性淀粉于热空气干燥箱中140 ℃干热灭菌2 h,无菌条件下分别加入tMRS培养基中,L1菌液以4%接种量分别接入培养基中,在31 ℃培养48 h后,以1.3.3节方法测定淀粉上清液及沉淀酶活力,并对总酶活力进行分析。
1.3.8 副干酪乳杆菌L1产酶单因素试验
淀粉占混合碳源(葡萄糖+淀粉)的比例50%、碳源添加量2%、接种量4%、培养基初始pH 6.0、培养温度35 ℃为单因素试验固定条件,以淀粉酶活力为指标,选择淀粉占碳源比例(50%、60%、70%、80%、90%)、碳源添加量(1.0%、1.5%、2.0%、2.5%、3.0%)、接种量(1%、2%、3%、4%、5%)、培养基初始pH值(5.5、6.0、6.5、7.0、7.5)、培养温度(20、25、30、35、40 ℃)5 个因素进行单因素试验,并选出3 个对总酶活力影响较大的因素进行响应面分析。
1.3.9 乳酸菌产酶条件响应面试验
根据单因素试验结果,确定产酶影响显著且有意义的因素,设计3因素3水平的响应面试验,确定最佳的产酶条件。
1.3.10 代谢产物分析
1.3.10.1 L1淀粉水解产物变化情况
利用高效液相色谱测定葡萄糖与淀粉混合碳源、以淀粉为碳源的2 个实验组在48 h内的发酵液中,葡萄糖、麦芽糖、麦芽三糖、麦芽四糖含量及变化情况。色谱柱:Waters Spherisorb NH2(250 mm×4.6 mm,5 μm),色谱检测条件:检测器为RID示差检测器,流动相(乙腈∶水=75∶25,V/V),进样量20 μL,流速0.8 mL/min。
1.3.10.2 L1水解淀粉过程中产酸情况
根据响应面试验的最优产酶条件,利用高效液相色谱测定无碳源、葡萄糖与淀粉的混合碳源、以淀粉为碳源以及葡萄糖为碳源的4 个实验组在48 h内的发酵液中乳酸、乙酸、柠檬酸、草酸、酒石酸的含量及变化情况。色谱柱:Cosmosil C18-PAQ(250 mm×4.6 mm,5 μL),色谱检测条件:流动相(pH 2.0,磷酸∶乙腈= 98∶2,V/V),检测波长210 nm,进样量10 μL,流速0.8 mL/min。
1.4 数据处理
采用SPSS 22.0软件中的One-Way ANOVA、Design-Expert V8.0.6响应面设计软件进行数据处理,结果以±s表示;采用GraphPad Prism 8.0软件进行绘图。
2 结果与分析
2.1 L1产酶位置分析
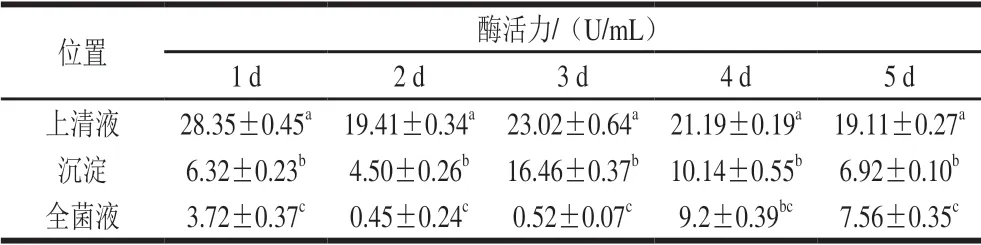
表1 L1产酶位置分析Table 1 Amylase activity in the fermentation broth of L1 and centrifugal supernatant and precipitate
由表1可以看出,L1具有利用淀粉的能力,但不同位置酶活力差异显著(P<0.05)。去细胞上清液、菌体沉淀以及未离心的全菌液均检测到淀粉酶活力,上清液中检测出较高的淀粉酶活力,在培养第1天检测出最高酶活力为(28.35±0.45)U/mL;菌体沉淀检测出的酶活力显著低于去细胞上清液(P<0.05),在第3天检测出最高酶活力为(16.46±0.37)U/mL,且5 d内,去细胞上清液的酶活力均显著高于菌体沉淀(P<0.05),由此可以看出,L1对淀粉的水解利用是胞外淀粉酶及菌体细胞表面淀粉酶共同作用的结果,并以去细胞上清液中的胞外淀粉酶占主导。不同的淀粉酶在淀粉颗粒上表现出不同的降解模式,包括离心水解和向心水解,通常α-淀粉酶比β-淀粉酶更有效[20],这种复杂的酶水解系统使L1可能具有更复杂的淀粉水解模式。
与去细胞上清液、菌体沉淀的酶活力相比,未离心的全菌液酶活力显著低于上清液及沉淀酶活力,可能的原因是,测定酶活孵育底物过程中,未离心的菌液具有满足细菌生长的氮源、无机盐等,而酶解出的还原糖为菌体生长提供碳源,被细菌所利用,导致检测出酶活较低。
2.2 L1产酶的诱导性

表2 L1产酶诱导性及产酶稳定性分析Table 2 Induction and stability analysis of amylase production by L1
如表2所示,L1在4 种培养基中连续传代5 次,记录每一代产酶情况,并对产酶诱导性及稳定性进行分析。tMRS与tMRS+淀粉组以及tMRS+葡萄糖与tMRS+葡萄糖+淀粉组相比,添加淀粉组的酶活力均显著高于不添加淀粉组(P<0.05),且不同代次,这种现象均显著 (P<0.05),说明添加淀粉可以诱导L1分泌产生淀粉酶,且这种诱导性稳定。这与大多数的淀粉分解乳酸菌(amylolytic lactic acid bacteria,ALAB)类似,在对ALAB的全基因组研究中,发现许多乳酸菌都含有负责水解淀粉的染色体,但只有被迫在淀粉环境中生存的菌株才能显示出这些遗传特征[24]。
通过对比添加淀粉为碳源的tMRS培养基中的酶活力(tMRS+淀粉)及添加以葡萄糖和淀粉混合物为碳源的tMRS(tMRS+葡萄糖+淀粉)中酶活力,发现2 种培养基中淀粉存在的同时,葡萄糖的存在使tMRS+葡萄糖+淀粉组的酶活力显著增加,检测出了最大酶活力为(177.75±0.75)U/mL,与同代次的tMRS+淀粉组的酶活力相比差异显著(P<0.05),最大酶活力为(67.52±0.57)U/mL。可能的原因是葡萄糖作为更易利用的碳源,促使乳酸菌迅速生长,菌数的增加导致了酶活力的增加。Goh等[25]研究发现,葡萄糖的存在也可能会与同为碳源的淀粉形成竞争抑制,过量的葡萄糖可能会抑制部分淀粉酶的表达,因此寻找葡萄糖与淀粉的最适比例尤为重要。
2.3 SDS-PAGE及酶谱分析
对初步纯化的蛋白进行SDS-PAGE及酶谱分析,在变性条件和非变性条件下均显示出了单一条带,说明为同一蛋白。图1A显示出该生淀粉酶的估计分子质量为105 kDa。该分子质量在其他ALAB产的淀粉酶分子质量范围内,如植物乳杆菌A6的分子质量为135 kDa[26]、木薯乳杆菌LMG18010的分子质量为140 kDa[27]。经碘染后,如图1B所示,深蓝色凝胶背景下出现一条浅色透明条带,说明该位置的淀粉被水解,成功纯化出了生淀粉酶。

图1 生淀粉酶的SDS-PAGE(A)及酶谱(B)Fig. 1 SDS-PAGE (A) and zymogram (B) of raw starch-degrading amylase
2.4 不同来源生淀粉对L1产酶的影响
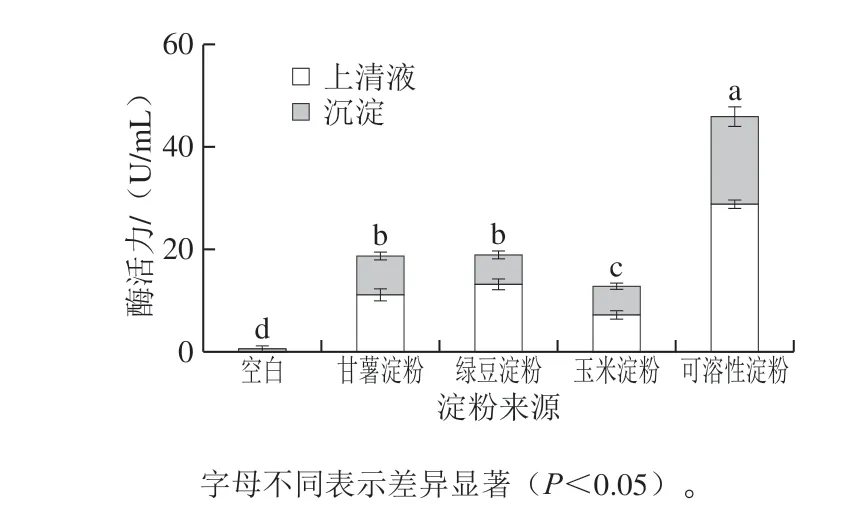
图2 不同来源生淀粉对产酶活力的影响Fig. 2 Effect of raw starch from different sources on raw starchdegrading amylase activity
由图2可知,L1对4 种不同来源生淀粉均具有水解利用能力。以不同来源淀粉为碳源的4 组,总酶活力均显著高于未加碳源组的酶活力(P<0.05),说明L1具有利用这4 种不同来源生淀粉的能力。可溶性淀粉组去细胞上清液酶活力为(29.193±0.30)U/mL,菌体沉淀的酶活力为(17.023±0.96)U/mL,其总酶活力显著高于其他各组(P<0.05)。甘薯淀粉组和绿豆淀粉组差异不显著,总酶活力分别为(19.05±0.53)、(19.38± 0.43)U/mL,但均显著高于玉米淀粉组(13.25± 0.29)U/mL(P<0.05)。造成这种结果的因素有很多,淀粉颗粒的大小、淀粉的结晶程度、颗粒的形状、磷含量以及直链、支链淀粉的比例等[28],由于甘薯、绿豆、玉米淀粉的颗粒大小,结晶程度,直链、支链淀粉占碳源比例无法统一,为了下一步产酶优化实验具有良好的重复性,故选择产淀粉酶活力最高,产酶最稳定的可溶性淀粉为碳源。
2.5 L1产酶条件优化
2.5.1 单因素试验结果

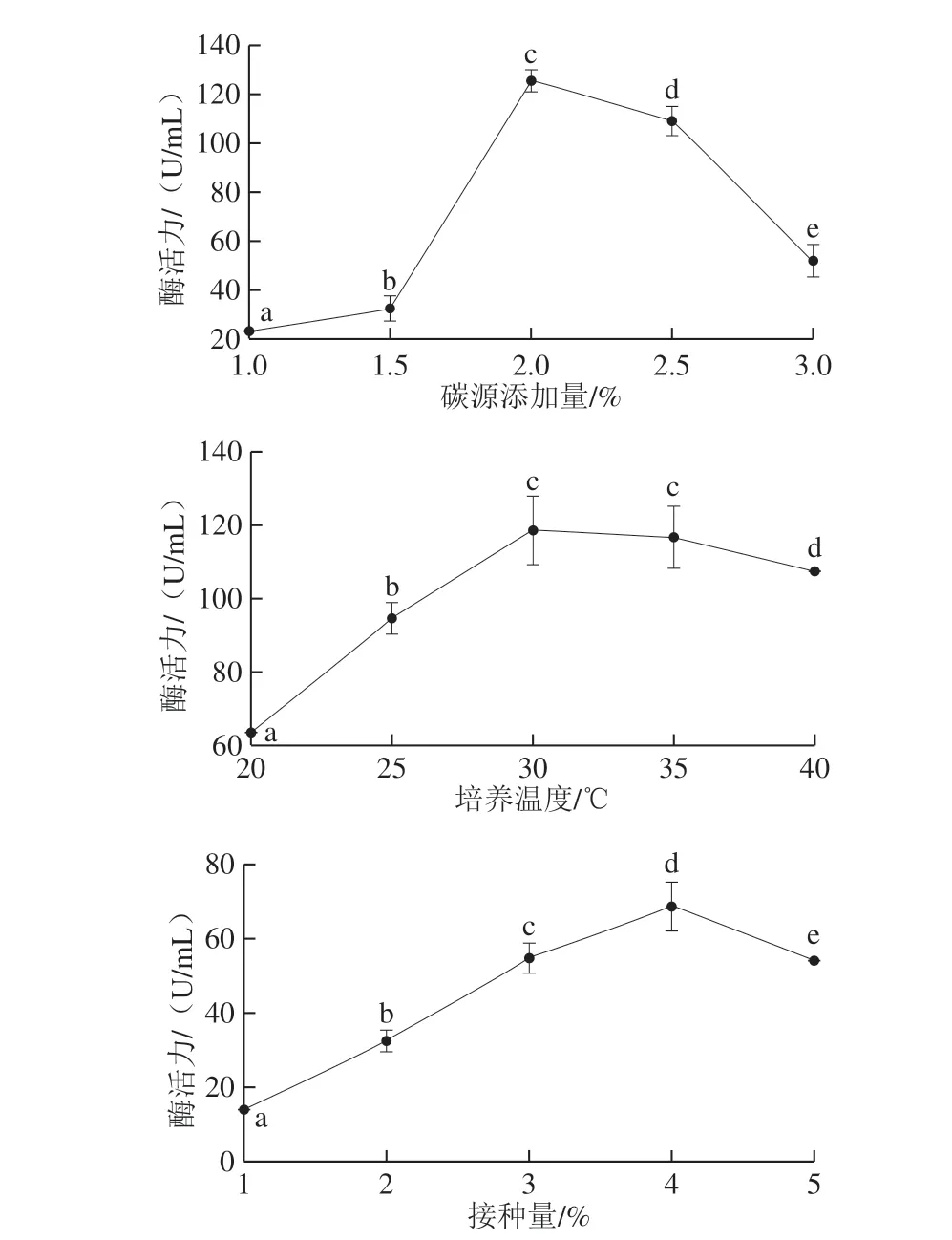
图3 5 种因素对L1产淀粉酶的影响Fig. 3 Effects of initial medium pH, starch proportion in total carbon source, carbon source concentration, culture temperature and inoculum amount on amylase production by L. paracasei L1
如图3所示,初始pH 6.5、淀粉占碳源比例70%、碳源添加量2%、培养温度30 ℃、接种量4%时酶活力最高,由于初始pH值、淀粉占碳源比例、碳源添加量对淀粉酶活影响较大,因此选择此3 个因素进行响应面优化。
2.5.2 响应面设计与结果
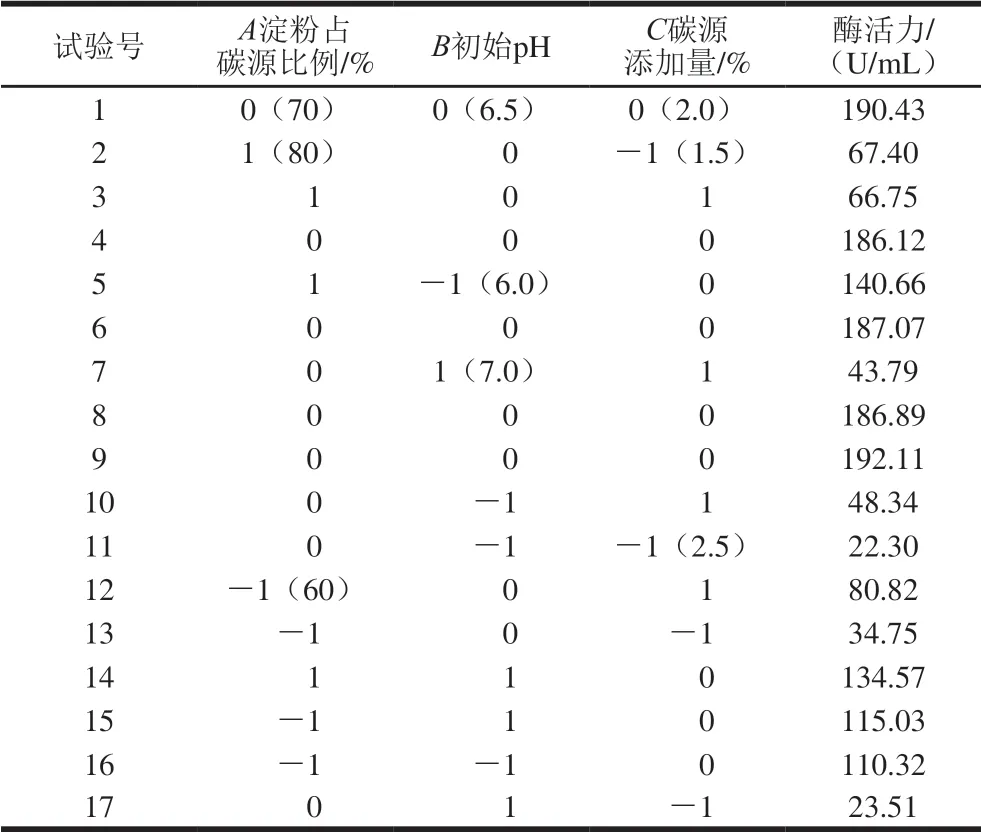
表3 Box-Behnken试验设计及结果Table 3 Box-Behnken design with experimental values
在单因素试验基础上,选择培养基初始pH值、淀粉占碳源比例及碳源添加量3 个因素对产酶条件进行响应面优化设计,响应面Box-Behnken试验设计及结果见表3。
2.5.3 模型方差分析及响应面分析

表4 回归方程方差分析Table 4 Analysis of variances for the developed regression equation
由表4 可以看出, 响应面模型影响极显著 (P<0.01),而失拟项影响不显著(P=0.760 3>0.05),说明该回归模型实际值与预测值拟合度高,适用于对酶活优化的分析预测。回归系数R2为0.999 5,模型校正决定系数R2Adj为0.998 8,表明因变量与试验考察的自变量间线性关系显著,数据误差较小,结果可信。该模型的A、C、AB、AC、A2、B2、C2影响极显著(P<0.01),考虑显著项,得到回归模型方程:Y=188.52+3.67A-0.59B+11.47C-12.47AB-11.68AC-1.44BC-17.72A2-45.66B2-108.38C2。方程中,一次项系数的绝对值决定了该模型中各个因素对结果影响的主次顺序,因此,各因素影响排序为:碳源添加量>淀粉占碳源比例>初始pH值。各因素交互作用响应面见图4。
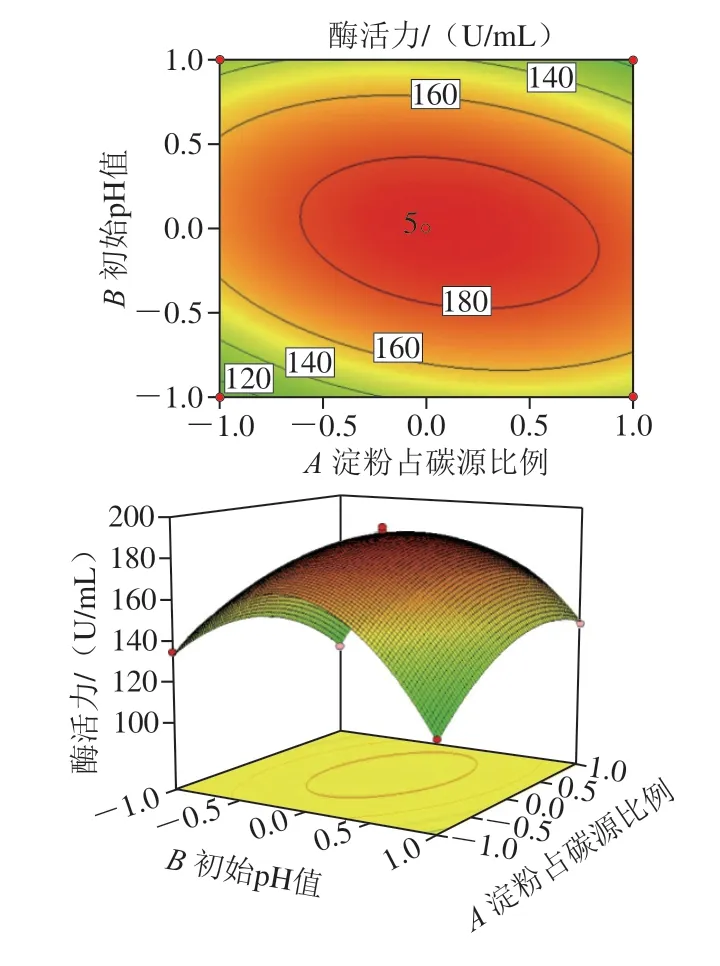
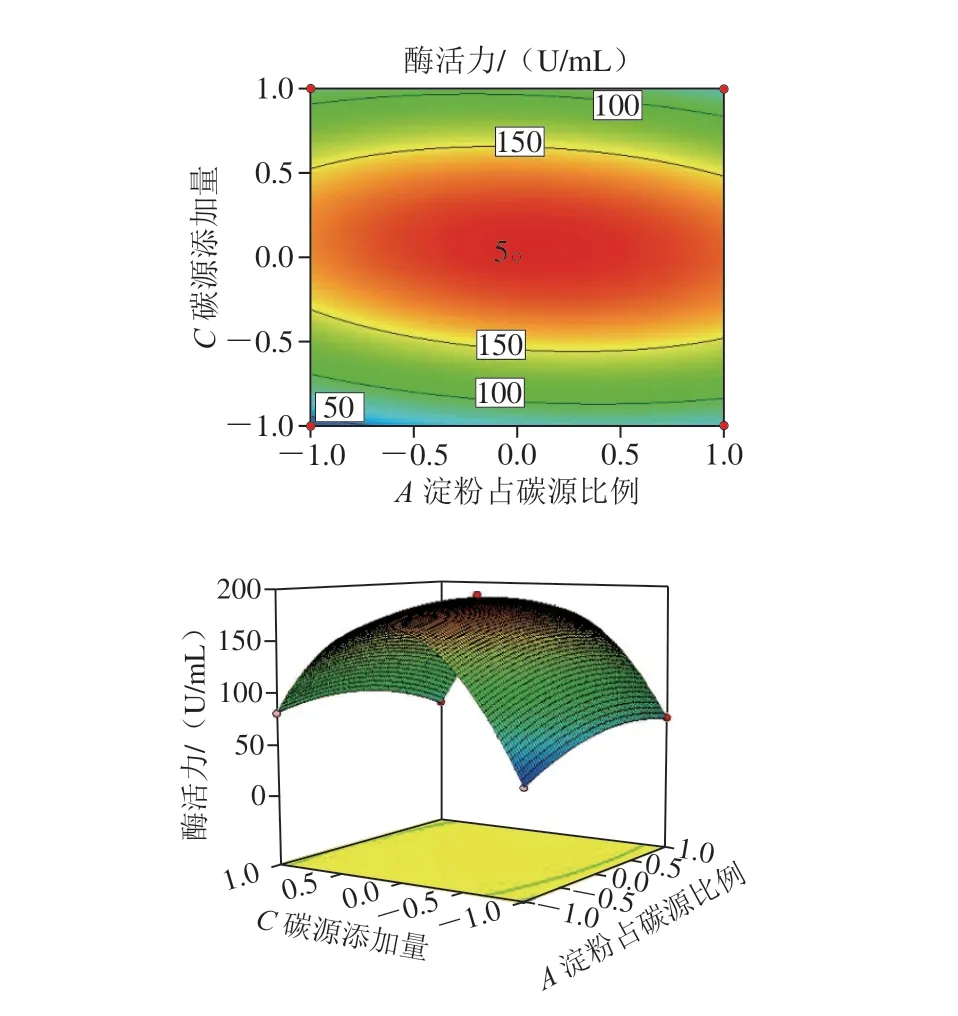
图4 各因素交互作用对生淀粉酶活力影响的响应面和等高线图Fig. 4 Response surface and contour plots showing the interactive effects of various factors on the activity of raw starch-degrading amylase
2.5.4 产酶最佳条件确定及验证实验
使用Design-Expert 8.0.6得到模型极值点,pH 6.5、淀粉占碳源68%、碳源添加量2.03%条件下,酶活力最高为193.83 U/mL,以此结果进行了3 次重复独立验证实验,得到的酶活力平均值为(191.64±0.63)U/mL,是理论回归预测值的98.87%,说明该模型理论值与实际情况拟合度良好,适用于L1产酶条件的优化。
2.6 L1利用淀粉代谢产物分析
2.6.1 L1水解淀粉产物变化分析
通过对L1在48 h利用淀粉的水解产物分析,检测其水解产物在不同时间的变化情况,对L1的淀粉代谢途径进行初步分析。
如图5A所示,L1以淀粉为碳源代谢过程中,产生了葡萄糖、麦芽糖,以及不同聚合度的麦芽低聚糖。0~6 h水解初始阶段,葡萄糖、麦芽糖、麦芽三糖质量浓度迅速上升,分别达到(0.52±0.01)、(2.47±0.03)、(1.51±0.35)mg/mL;6 h后,麦芽三糖含量逐渐减少,葡萄糖及麦芽糖含量增加,并于20 h时达到峰值,质量浓度分别为(1.02±0.03)、(2.99±0.64)mg/mL。20 h后,葡萄糖、麦芽糖质量浓度缓慢减小,而麦芽三糖被大量消耗。而在整个反应过程中,只检测到了低质量浓度的麦芽四糖,这与Kanpiengjai等[29]研究的淀粉酶水解淀粉的代谢产物种类类似。
如图5B所示,当L1代谢混合碳源初期,易于被菌体代谢的单糖首先被利用,抑制了麦芽糖及麦芽低聚糖的产生,随着生长时间的延长,麦芽糖及麦芽三糖含量增加,10 h时达到峰值,质量浓度分别为(4.15±0.43)、(1.79±0.11)mg/mL。且在生长过程中,麦芽糖及麦芽三糖浓度出现短暂上升趋势,这可能是淀粉酶水解的结果。
尽管混合碳源中存在菌体更易代谢的单糖,淀粉的水解作用依然存在。但容易代谢的单糖被优先代谢至一定质量浓度后,淀粉水解作用才开始,从图5可以看出,B组中麦芽糖和麦芽三糖出现时间与A组相比出现了延后。葡萄糖的存在没有影响淀粉水解产物种类,这种淀粉水解代谢情况的可能作用途径为:来源L1的淀粉酶首先将淀粉颗粒水解为大量麦芽糖和麦芽三糖,葡萄糖由麦芽糖或麦芽三糖水解而来,但葡萄糖是由麦芽三糖一步水解而来,还是通过麦芽糖这一中间产物代谢而来,就此问题讨论大致分为两个观点。Busch等[30]研究结果表明,麦芽三糖可同时水解出麦芽糖和葡萄糖,与大部分文献报道中淀粉酶水解淀粉反应类似。Suganuma等[31]研究提出,麦芽三糖作为催化剂,促进麦芽糖基转移,从而降解麦芽糖生成葡萄糖。L1水解淀粉的淀粉酶种类将作为下一步的研究内容,进一步探究L1代谢生淀粉的机制。
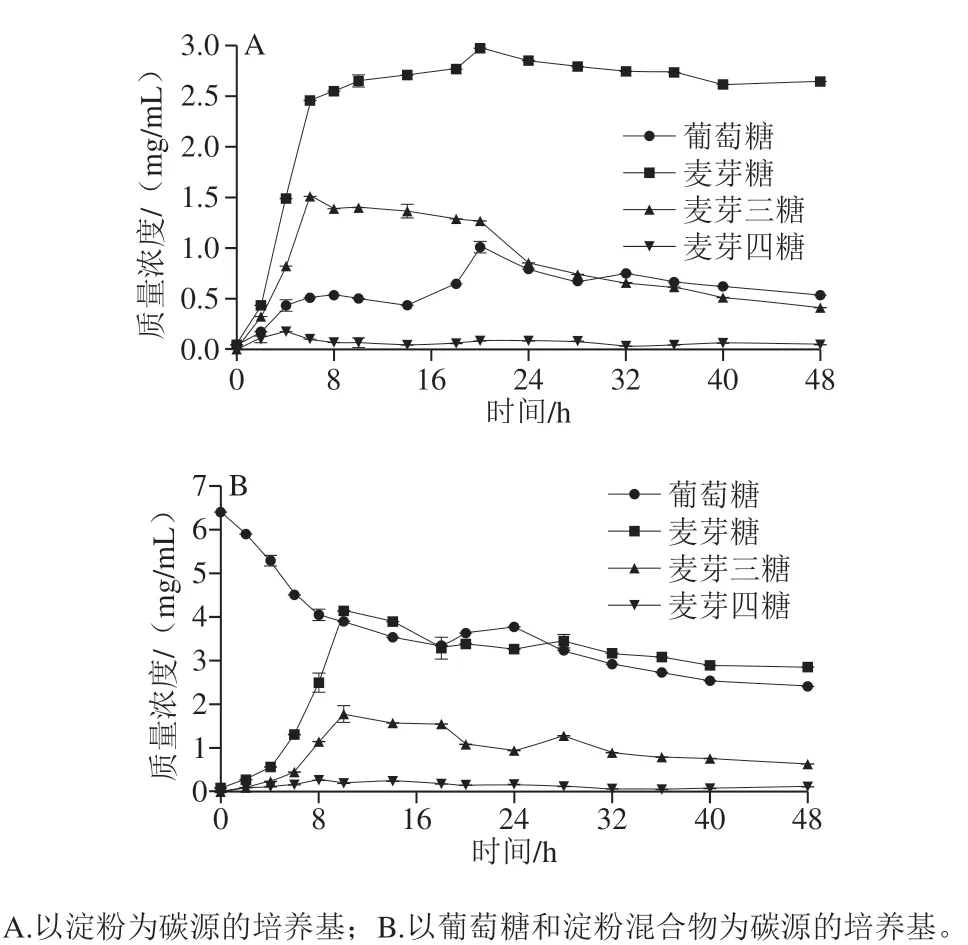
图5 副干酪乳杆菌L1碳水化合物变化分析Fig. 5 Changes in carbohydrates during fermentation of L. paracasei L1
2.6.2 L1代谢淀粉产酸分析
大多数乳酸菌产乳酸的同时,还有乙酸的产生,部分还产生甲酸、柠檬酸及琥珀酸[32-33]。在L1代谢过程中,未检测出乙酸,属于同型发酵菌株,草酸、酒石酸含量微少,且质量浓度在生长代谢过程中基本保持不变。
如图6所示,与空白组相比,以淀粉组乳酸产量增加显著(P<0.05),12 h后乳酸含量趋于稳定,第20小时乳酸质量浓度达到最大值(14.32±0.43)mg/mL,与江杨娟等[34]研究的乳酸菌代谢大豆糖蜜生产乳酸的最高产量12.18 mg/mL接近,说明L1在以淀粉为单一碳源的条件下,也具有较高的产乳酸能力。
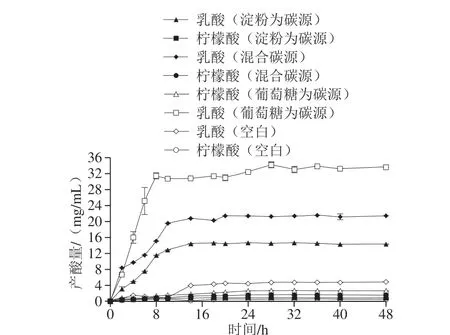
图6 副干酪乳杆菌L1产酸分析Fig. 6 Analysis of acid production during fermentation of L. paracasei L1
混合碳源组与淀粉组相比,L1生长前期产乳酸速率更高,可能的原因是,葡萄糖的存在缩短了L1的迟缓期,更快的到达对数期,菌数的增加导致产酶量增加,在这两因素的共同作用下,产酸量显著增加,第20小时乳酸质量浓度达到峰值为(21.45±0.20)mg/mL。 葡萄糖为碳源组与混合碳源组相比,尽管乳酸质量浓度最高为(32.42±0.76)mg/mL,但混合碳源组的葡萄糖添加量仅为32%,尽管以生淀粉为碳源略微降低了乳酸的产量,但由于生淀粉的廉价且不需要进行预处理,这种碳源显示出了更高的经济价值,在一步法生产乳酸的工艺中有着重要意义。
综上所述,在生淀粉基质中,L1具有较好的产乳酸能力,在混合碳源中产酸,表现出了高效、高产的特点,是利用生淀粉一步法生产乳酸的潜力菌株。同时,同型发酵的特点也使其在食品发酵生产中有着更好的感官评价。
3 结 论
在对L1代谢生淀粉的研究中,发现L1在特异性结合淀粉的同时,水解并利用生淀粉来维持其生长。研究发现,生淀粉酶存在于菌体表面及上清液。生淀粉可以诱导L1分泌淀粉酶,该酶对不同来源的生淀粉均有代谢能力,纯化后检测其分子质量估计值为105 kDa,对培养条件优化后酶活力可达到(193.83±0.63)U/mL。淀粉水解产物中的碳水化合物以葡萄糖、麦芽糖为终产物,麦芽低聚糖为中间产物,碳源中引入葡萄糖后,显示出了葡萄糖优先利用,淀粉次级利用的模式;L1具有较强的产乳酸能力,在混合碳源中,乳酸质量浓度最高可达(21.45±0.20)mg/mL,表现出高效、高产的特点,以生淀粉为碳源大大降低了成本,对乳酸菌在淀粉类基质中的应用有着重要意义,同时从代谢角度证明了副干酪乳杆菌L1有代谢生淀粉的能力。
