右美托咪定减轻大鼠肾缺血再灌注损伤中的作用机制研究
2020-12-29杜晓宣陈燕赵志静李亚璇孙永东
杜晓宣,陈燕,赵志静,李亚璇,孙永东
预防肾缺血再灌注损伤及对器官的影响一直是临床亟待解决的问题,但目前肾缺血再灌注损伤的发生机制尚未明确[1-3]。白介素-17A(IL-17A)是一种促炎性因子,已被证实肾缺血再灌注后期IL-17A升高,引起中性粒细胞靶向器官浸润,是导致术后多器官功能障碍的关键[4-5]。研究发现右美托咪定可降低小鼠肾缺血后IL-17A水平、减少靶器官炎性细胞浸润、上调抗凋亡蛋白表达[6]。目前国外针对IL-17A及右美托咪定的研究逐渐增多,然而针对右美托咪定与IL-17A之间联系的研究报道较少。现分析右美托咪定在肾缺血再灌注损伤中的保护作用及其作用机制与IL-17A的关系,分析右美托咪定所产生的内源性肾保护作用机制,以期为肾脏保护提供新的方向,报道如下。
1 材料与方法
1.1 实验材料 (1)动物:清洁级Wistar大鼠(45只购自新疆医科大学动物中心,雄性,6~8周龄,动物合格证号65000700001017),体质量(220±10)g,经适应性饲养后随机数字表法分为假手术组(Sham组)、肾缺血再灌注组(IRI组)、右美托咪定干预组(IRI+DEX组),每组15只。(2)材料与试剂:TUNEL凋亡检测试剂盒(MK1020)购自武汉博士德生物工程有限公司;大鼠IL-17A和肿瘤坏死因子α(TNF-α)ELISA检测试剂盒均购自杭州联科生物技术有限公司;BUN试剂盒(C013-2)和CRE试剂盒(C011-2)均购自南京建成生物科技有限公司;琼脂糖(A811BA0014)购自生工生物工程(上海)股份有限公司;苏木素染液和DAB显色试剂盒购自福州迈新生物技术开发有限公司;中性树胶和伊红染液购自北京中杉金桥生物技术有限公司。(3)仪器设备: 凝胶成像系统(上海天能2500,上海天能科技有限公司)、 Real Time PCR instrument(美国ABI QuantStudioTM6 Flex Real-Time PCR Syste)、PCR仪(美国Bio-Rad MyCycler Thermal Cycler)、酶标仪(美国Bio-Rad xMarkTM)、显微镜(日本尼康E200,上海土森视觉科技有限公司)。
1.2 造模方法 Sham组:仅切除大鼠右肾并分离左侧肾蒂,不进行钳夹处理。IRI组:2%戊巴比妥钠(40 mg/kg)腹腔注射麻醉,待翻正反射消失后,气管插管,接小动物呼吸机,俯卧位于24~29 ℃的体温毯上,沿腹正中线1.5~2.0 cm切口逐层分离皮肤至腹腔,沿肠道找到肾蒂并分离,游离输尿管,切除右侧肾脏,左侧肾蒂使用无损伤血管夹夹闭30 min。根据左肾颜色判断缺血情况,确认其由鲜红转为整体肾脏暗红色时即可。30 min后松开血管夹进行再灌注,待肾脏由暗红色转为鲜红色,恢复血液供应后再将其还纳入腹腔并缝合伤口。IRI+DEX组:于缺血前30 min腹腔注射右美托咪定100 μg/kg干预,其余处理与IRI组相同。
1.3 观测指标与方法
1.3.1 样本收集:各组分别在术后8 h处死大鼠。从其腹正中线切开皮肤进入腹腔,使腹主动脉清楚暴露并采集血液,离心,将血清冻存于-80℃冰箱;迅速剥离大鼠肾脏,记录双肾肉眼外观,然后用剪刀将肾脏组织剪成小块(约1 cm3),每侧肾各取1块组织置于10%中性甲醛中4℃固定过夜,用于HE染色及TUNEL实验,其余组织立刻存入液氮中,再于-80℃保存。
1.3.2 肾脏组织病理变化:上述肾脏组织固定脱水包埋制片,而后置于65℃恒温箱中烘烤1.5~2.0 h,二甲苯脱蜡,酒精水化,苏木素染色,盐酸酒精分化,伊红复染,二甲苯透明,中性树胶封片。
1.3.3 TUNEL检测细胞凋亡:肾脏组织固定脱水包埋制片,烤片,二甲苯脱蜡,酒精水化,0.01 mmol/L柠檬酸缓冲液(pH 6.0)进行抗原修复,3%H2O2去除内源性过氧化物酶,洗涤3次,加Proteinase K消化,加入TdT 和 DIG-d-UTP 各 1μl,加标记液20 μl/片,标记2 h。洗涤3 次,加封闭液 50 μl /片,室温 30 min,甩掉封闭液,不洗。加入1︰100稀释生物素化抗地高辛抗体50 μl /片,反应 30 min,洗涤3 次,加入1︰100稀释 SABC 50 μl/片,37℃反应 30 min。洗涤4 次,DAB显色3~10 min,苏木精复染,盐酸酒精分化,反蓝,脱水,二甲苯透明,中性树胶封片。镜下判断和计算细胞凋亡指数以评估细胞凋亡程度,细胞凋亡指数计算:在高倍视野中计数细胞核内有棕黄色颗粒者,计算其所占细胞百分比。
1.3.4 ELISA法检测血清IL-17A、TNF-α及肾组织匀浆中Cre、BUN表达:上述血清样本按照IL-17A、TNF-α试剂盒说明书具体实验步骤进行,以ELISA法检测。将收集好的肾脏组织样本在液氮包围的情况下,研磨成粉,按照Cre、BUN试剂盒说明书进行匀浆处理,而后再按照试剂盒说明书具体实验步骤进行,以ELISA法检测。
1.3.5 qPCR实验检测IL-17A、mTOR、NF-κB、AMPK表达: 将上述肾组织研磨成粉,取25~50 mg加入有TRLZOL 1 ml的离心管中,混匀,加入氯仿200 μl,混匀后离心吸取上清,加入等体积的异丙醇混匀,再离心弃除上清液,加入75%乙醇,使沉淀漂浮起来洗涤。4℃离心15 min,倒掉上清液。空管离心,吸尽液体,晾干,用无RNA、DNA酶的水溶解沉淀。进行浓度测定和凝胶成像仪观察结果,剩余RNA进行第一链cDNA合成:按照反应体系配制,25℃反应10 min,42℃反应30 min,85℃ 反应5 s。将反转录得到的cDNA使用RNase-free Water按照1︰1的比例稀释进行反应,然后进行荧光定量实验。
2 结 果
2.1 3组肾脏病理组织学变化比较 Sham组:镜下肾脏结构大体正常,肾小球结构规则,肾小管结构完整,肾间质有极少量的空泡变性。IRI组:镜下部分肾间质空泡变性、水肿伴充血、出血,肾小管上皮细胞肿胀、脱落,近端小管刷状缘消失,部分肾小管坏死明显,管腔内可见脱落的细胞碎片及管型形成,少部分肾小球轻度萎缩。IRI+DEX组:镜下少部分肾间质空泡变性,水肿,部分肾小管上皮细胞肿胀、脱落,局灶肾小管坏死,管腔内可见少量的脱落细胞碎片和管型形成,肾小球未见明确改变,见图1。
2.2 3组大鼠肾小管细胞凋亡情况比较 Sham组镜下观察发现凋亡细胞少,凋亡指数为(6.296±0.852)%;IRI组凋亡细胞明显增多, 凋亡指数为(25.927±1.597)%,较 Sham 组肾小管细胞凋亡明显增多(q=47.536,P=0.000);IRI+DEX组凋亡指数为(7.158±0.749)%,较IRI组凋亡细胞明显减少,凋亡指数降低(q=45.448,P=0.000),见图2。
2.3 3组大鼠肾脏组织匀浆中BUN、Cre水平比较 与Sham组比较,IRI组大鼠肾脏组织匀浆中BUN、Cre水平升高(q/P=12.514/0.000、3.259/0.007);与IRI组比较,IRI+DEX组降低,差异均有统计学意义(q/P=11.458/0.000,2.638/0.035),见表1。

表1 3组大鼠肾组织匀浆中BUN、Cre水平比较
2.4 3组大鼠血清炎性因子比较 与Sham组比较,IRI组大鼠血清IL-17A 、TNF-α水平升高(q/P=12.623/0.000、13.037/0.000);与IRI组比较,IRI+DEX组降低,差异均有统计学意义(q/P=10.388/0.000、10.460/0.000),见表2。
表2 大鼠血清IL-17A、TNF-α水平比较
2.5 3组大鼠肾组织各基因mRNA水平比较 与Sham组比较,IRI组IL-17A、NF-κB、AMPK显著升高,mTOR显著降低(q/P=10.441/0.000、6.722/0.000、2.649/0.034、10.110/0.000);与IRI组比较,IRI+DEX组IL-17A、NF-κB显著降低,mTOR显著升高(q/P=6.262/0.000、3.608/0.002、6.010/0.000),见表3。
3 讨 论
肾缺血再灌注损伤的发生机制涉及多种细胞因子水平的升高及炎性反应的增强等,其作用机制一直是研究的热点。探讨肾缺血再灌注损伤发病机制的基础条件是建立合格有效的动物模型。本研究参照国内余晓东等[7]提出的造模方法建立肾缺血再灌注损伤大鼠模型,该模型的优势在于造模成功率高和实用性强,通过切除右肾、夹闭左肾动脉,模拟出接近临床上常见的由于单纯缺血而引起的再灌注损伤,这是目前最常用于研究肾缺血再灌注损伤相关发病机制的理想模型。本研究大鼠造模后肾脏病理形态学、肾小管细胞凋亡及肾功能变化的结果,均证明了肾缺血再灌注损伤造模成功。
右美托咪定是临床中常用的镇静药物,具有抗炎、镇静、镇痛、抗焦虑及抗交感作用,同时具有较好的围术期器官保护作用,目前实验研究结果表明,右美托咪啶术中用药,能有效改善脑、心、肾、肺等重要器官的缺血/再灌注损伤[8],但具体作用机制尚未进一步阐明。本研究在大鼠肾缺血再灌注模型中采用右美托咪定预处理,肾脏组织病理形态学、肾小管细胞凋亡及肾功能变化的结果显示,右美托咪定预处理组中肾小管细胞凋亡数目明显下降,肾脏损伤明显减少,提示右美托咪定可减轻大鼠肾缺血再灌注损伤。
目前对右美托咪定在肾脏缺血再灌注中保护作用的具体机制尚不明确,本研究提出“右美托咪定预处理可抑制IL-17A分泌,减轻缺血再灌注损伤亚急性期炎性细胞向靶器官浸润及可能存在的过度自身免疫反应”新假说。IL-17A 主要由一类特殊的 CD4+T细胞亚群分泌,能够刺激成纤维细胞和表皮细胞释放大量的炎性因子,包括IL-6、IL-8、TNF-α 和 IL-1β等,参与机体自身免疫性疾病和多种炎性疾病,尤其在器官缺血再灌注损伤中的作用越来越受到关注[9-10]。TNF-α 是单核—巨噬细胞产生的重要炎性因子,参与调控单核细胞在组织上的黏附功能,同时可以刺激 Th1 细胞产生多种炎性介质,产生炎性反应。IL-17A、TNF-α均是缺血再灌注损伤中典型的炎性因子,其表达水平反映了缺血再灌注损伤的炎性反应水平[11-13]。本结果显示,肾脏缺血再灌注损伤可显著增加 TNF-α 和IL-17A 的表达,而右美托咪定预处理能有效调控炎性反应,推测右美托咪定对肾缺血再灌注损伤的保护作用可能与其降低促炎介质TNF-α 和IL-17A有关。
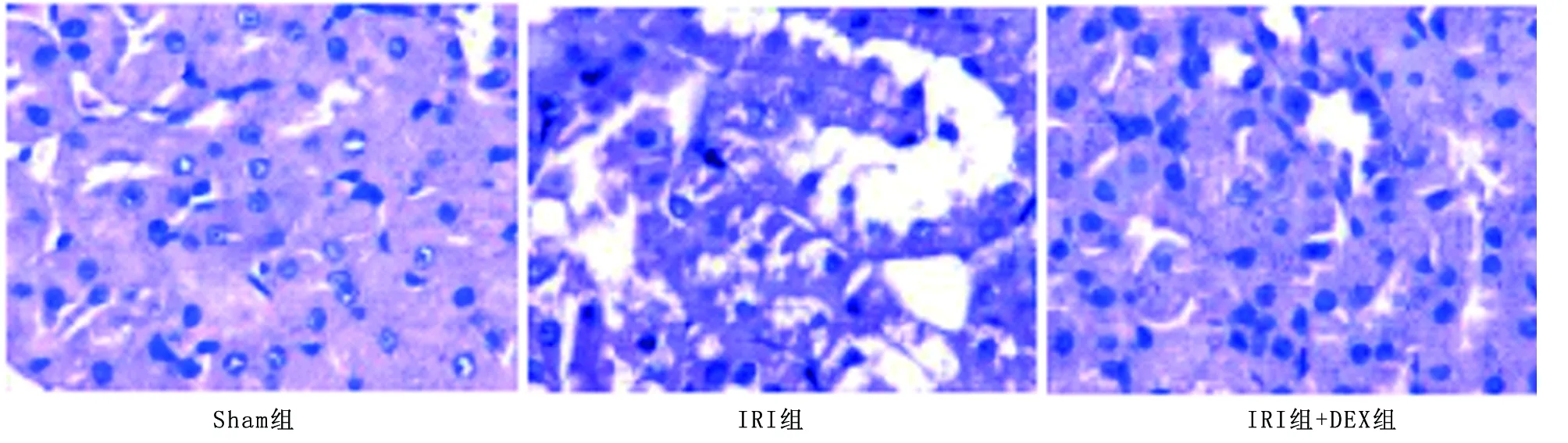
图1 3组大鼠肾脏病理组织学变化比较(HE染色,×400)
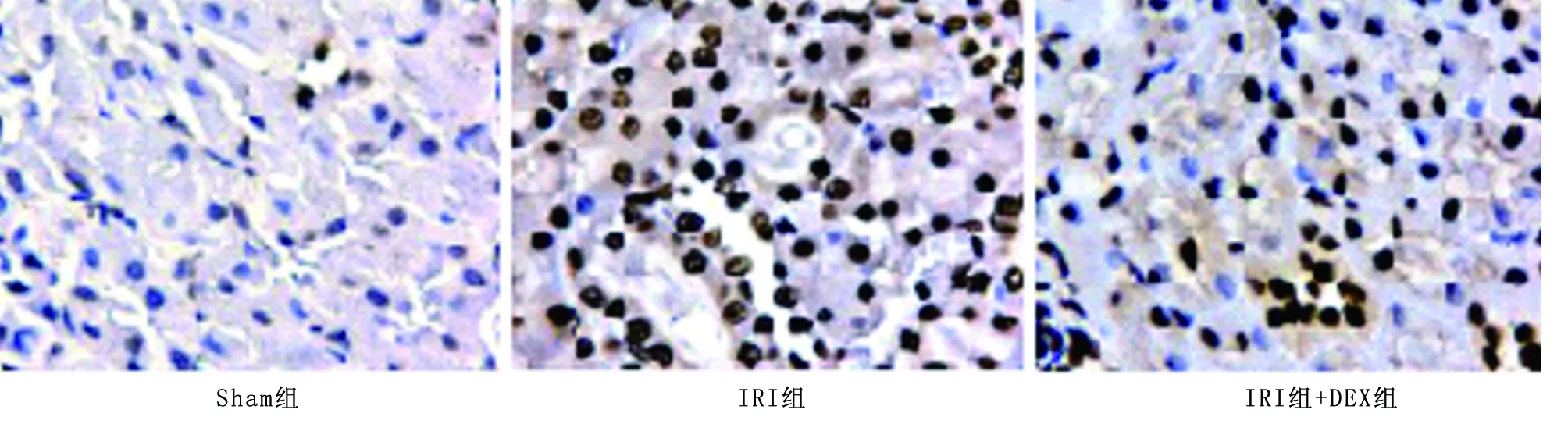
图2 3组大鼠肾小管细胞凋亡比较(TUNEL法,×400)

表3 3组大鼠肾脏组织中各基因mRNA水平比较
本结果发现,肾脏缺血再灌注造模后大鼠肾脏组织中IL-17A、NF-κB、AMPK表达水平均明显升高,而mTOR表达明显降低,提示IL-17A具有调控炎性因子的作用,NF-κB、AMPK及mTOR信号通路均可能在肾脏缺血再灌注损伤发生过程中发挥作用。经过右美托咪定预处理,肾脏缺血再灌注造模后大鼠肾脏组织中IL-17A、NF-κB显著降低,mTOR显著升高,提示右美托咪定保护缺血再灌注后肾脏损伤的作用机制可能与降低 IL-17A 的表达,抑制NF-κB 通路的活化和激活mTOR信号通路存在一定关系[14-16]。
综上所述,IL-17A与大鼠肾缺血再灌注损伤的发生、发展密切相关,右美托咪定可能通过降低IL-17A表达,抑制NF-κB 通路的活化和激活mTOR信号通路,改善炎性反应及细胞凋亡,从而保护肾缺血再灌注损伤。
利益冲突:所有作者声明无利益冲突
作者贡献声明
杜晓宣:设计研究方案,实施研究过程,论文撰写;陈燕:实施研究过程,数据收集,分析整理,论文修改;赵志静、李亚璇、孙永东:实施研究过程,资料搜集整理
