液基薄层细胞p16免疫组化检测对宫颈非典型鳞状上皮的分流价值
2020-12-29赵芳马德勇王婷婷张岩董颖赵健
赵芳,马德勇,王婷婷,张岩,董颖,赵健
宫颈癌是严重危害妇女健康的第二大恶性肿瘤,病死率仅次于乳腺癌,已经成为全球性的公共卫生问题[1]。若要达到2030年全世界范围内消除宫颈癌的目标,宫颈癌筛查仍然是目前我国宫颈癌诊治工作的基础。非典型鳞状细胞(atypical squamous cells,ASC)在巴氏(TBS)诊断系统判读结果中比例占第二,常规的分流方法对高危型人乳头瘤病毒(HR-HPV)检测存在特异度、阳性预测值偏低的局限性。因此临床亟待寻找新的技术手段或新的生物学标志物实现ASC风险分层管理。p16抑癌基因蛋白表达作为早期宫颈癌的生物学标志物,因其具有较高的敏感度和特异度而备受关注[2]。但研究多集中在对活检组织学标本进行p16检测,尽管标本常规病理诊断是“金标准”,但需完成筛查转诊阴道镜下有创操作才能取到标本,不能作为宫颈癌筛查手段。本研究对ASC宫颈癌筛查液基薄层细胞学检查剩余标本进行p16免疫组化染色检测,并与阴道镜活检组织病理p16免疫组化结果对比,探讨液基薄层细胞学p16对ASC人群分流的应用价值,以有效分流管理ASC,提高子宫颈癌前病变检出率,报道如下。
1 资料与方法
1.1 临床资料 选取2018年1月—2019年10月于北京大学第一医院妇产科就诊的ASC患者109例,均经宫颈细胞学检查确诊,年龄21~68(38.57±9.74)岁。排除早孕、哺乳期、HPV治疗史、宫颈病变或宫颈癌手术史、放化疗史患者。所有患者进行标本刷宫颈脱落细胞采样、液基薄层细胞学p16检测和HR-HPV检测。全部患者72 h内无性生活、阴道上药、阴道检查和手术操作史。脱落细胞学采用2014年新修订的TBS报告方式进行判读获得ASC有效分析[3]。ASC又分为不明确意义的不典型鳞状细胞(ASC-US)74例,不能除外上皮内高度病变(ASC-H)35例。本研究经医院伦理委员会批准,患者或家属知情同意并签署知情同意书。
1.2 HR-HPV检查 采用HC-Ⅱ检测系统(美国DIGENE公司生产)对宫颈脱落细胞进行HR-HPV DNA检测,高危型别包括18、31、33、35、39、45、51、52、56、58、59和68型,严格按试剂盒要求步骤依次完成。以检测结果HR-HPV≥1.0 pg/ml判读为HR-HPV阳性。
1.3 液基薄层细胞p16检测 收集109例ASC患者液基薄层细胞检测剩余标本,采用广州江元医疗科技有限公司生产提供的全自动免疫细胞独立温控单独滴染染色机(JY-6000)和配套的p16抗体检测试剂盒(免疫细胞化学法),严格按试剂盒要求步骤依次完成。普通光学显微镜下,以上皮细胞胞浆(或伴胞核)染为黄色为阳性,上皮细胞胞浆及胞核未见黄色为阴性,见图1。所有标本均由同一名经验丰富的细胞学诊断医师阅片诊断。

p16阳性 p16阴性
1.4 阴道镜取材与组织学检查 液基薄层细胞学结果为ASC-US且HR-HPV阳性,或液基薄层细胞学结果为ASC-H及以上的患者转诊阴道镜,由阴道镜专职医师依据阴道镜操作规范进行检查。阴道镜检查发现宫颈可疑病变部位取活检,未发现病变需在血液循环丰富的区域取活检包括颈管内膜诊刮(ECC),并进行组织病理学检测。病理组织学阅片由2位专门的病理专家完成。分为慢性宫颈炎、低级别鳞状上皮内病变(LSIL,包括HPV相关改变和CIN Ⅰ级)、高级别鳞状上皮内病变(HSIL,包括CINⅡ和CINⅢ级和宫颈癌)。
1.5 统计学方法 采用SPSS 21.0软件进行统计学处理。计数资料用频数或率(%)表示,比较采用χ2检验。采用受试者工作特征(ROC)曲线分析法,绘制ROC曲线并计算曲线下面积(AUC)检验2种方法对高级别病变的检验效能,分析两者临床诊断价值。P<0.05为差异有统计学意义。
2 结 果
2.1 ASC-US和ASC-H中p16在组织病理结果中分布情况 在液基薄层细胞学判读为ASC-US的74例标本中,p16染色阳性37例(50.00%)。组织病理诊断结果为炎性反应或正常组中p16染色阳性率为38.18%,LSIL组为57.14%,而HSIL组阳性率100%。ASC-US患者中,组织病理结果HSIL组p16染色阳性率>LSIL组>炎性反应或正常组,p16阴性和阳性的病理结果分布差异有统计学意义(χ2=15.216,P=0.001),见表1。
在液基薄层细胞学判读为ASC-H的35例标本中,p16染色阳性结果33例(94.29%)。组织病理诊断结果为炎性反应或正常组p16染色阳性率为85.71%,LSIL组为75.00%,HSIL组为100%。ASC-H患者中,组织病理结果p16染色阳性率HSIL组>炎性反应或正常组>LSIL组,p16阴性和阳性的病理结果分布差异无统计学意义(χ2=5.171,P>0.05),见表1。
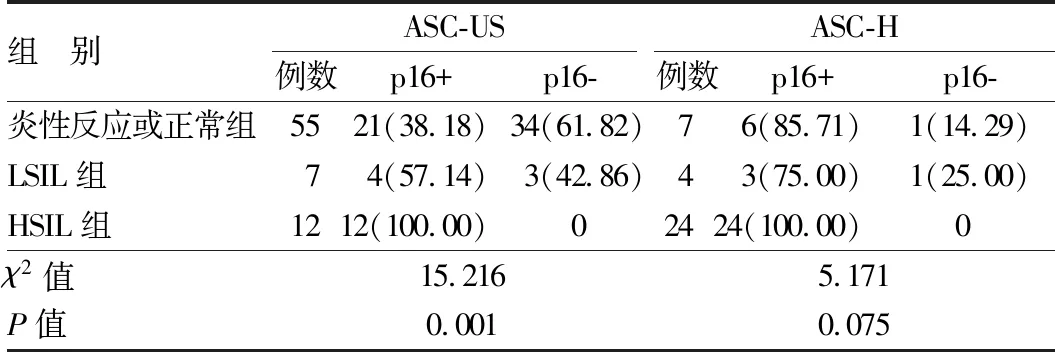
表1 组织病理学结果不同类型患者的p16阳性分布 [例(%)]
2.2 ASC-US和ASC-H中HPV在组织病理结果中分布情况 在液基薄层细胞学判读为ASC-US的74例标本中,HPV阳性44例(59.46%);组织病理诊断结果为炎性反应或正常组HPV阳性率50.91%,LSIL组为57.14%,HSIL组为100%。ASC-US患者中,HPV阳性和阴性的病理结果分布差异有统计学意义(χ2=9.866,P=0.007)。ASC-H患者中,HPV阳性和阴性的病理结果分布差异无统计学意义(χ2=5.367,P=0.068),见表2。

表2 组织病理结果不同类型患者的HPV阳性分布比较 [例(%)]
2.3 p16、HPV在 ASC-US中的诊断价值 在液基薄层细胞学判读为ASC-US的74例标本中,p16、HPV的敏感度和阳性预测值均为100%,p16的特异度为59.68%,稍高于HPV的48.39%,p16的阴性预测值为59.68%,稍高于HPV的48.39%。p16的AUC为0.884,高于HPV的0.798,见图2,说明p16检验准确性高于HPV,见表3。

图2 p16、HPV识别高级别以上病变的ROC曲线
3 讨 论
3.1 液基薄层细胞学p16检测 大量的流行病学调查和研究证实,持续性HR-HPV感染是宫颈癌和癌前病变的必要因素[4],肿瘤抑制基因p16与HPV等多因素导致的宫颈癌发生、发展及预后密切相关[5]。p16 基因为多肿瘤抑制基因,其表达的蛋白可直接参与调控细胞周期,通过抑制细胞增殖和分裂达到抑癌作用。正常细胞周期中表达的p16表现为抗增殖效应,因此在终末分化的上皮细胞中,正常水平下不能用免疫组化方法检测到。但在HPV相关的癌前病变和癌变中,代表确立和维持恶性表型的必要因素E7癌蛋白整合到宿主基因组内,结合Rb蛋白使其失活,细胞持续增殖聚集形成肿瘤,相应p16出现了强烈的过度表达而被测得。因此p16被认为是HPV感染转化的一个替代性标志物,用于在宫颈癌筛查中分流管理HR-HPV阳性的女性[6-7]。
p16检测CINⅡ级和更严重病变的敏感度与HPV检测相似,但特异度更高,可以显著增加高级别病变的诊断准确率,并作为组织病理学医生识别难以鉴别的LSIL和HISL的依据。p16阳性表达表示病毒存在,伴随着宫颈组织由正常发展到低级别病变、高级别病变、直至浸润癌的全过程,其阳性率逐渐增强,与CIN疾病具有显著的一致性[8],并且p16蛋白的高表达代表了病毒活动整合能力,检测p16可以反映细胞恶变增殖能力,预示恶性肿瘤的侵袭性,初步推测宫颈癌的恶性程度[9]。

表3 p16、HPV在ASC-US中的诊断价值
3.2 液基薄层细胞p16、HR-HPV在ASC-US的应用价值 宫颈癌和癌前病变从组织类型分为鳞癌和腺癌,鳞癌来源于鳞状上皮,占宫颈癌的80%~85%,识别鳞状上皮病变有助于做到大部分宫颈癌的早期识别。ASC-US在子宫颈细胞学筛查结果中占5.2%~28%[10],仅次于未见上皮内病变或恶性病变(NILM),在细胞学异常中占59.3%[11]。由于TCT的TBS系统分类法将标本质量作为报告的一部分,ASC-US的判读多数是由于炎性反应刺激、制片技术差异、细胞数量少或细胞异常程度不足以诊断上皮病变等,干扰临床病理学医生而导致的排除性诊断。因此ASC-US的最终组织病理报告跨度很大,由正常的宫颈到早期浸润癌都有可能,其中仅有约9.7%ASC-US患者组织学病理确诊为高级别病变[12]。本研究中ASC-US 74例,病理组织证实HSIL者12例,占比16.22%。ASC-US处理不当,可以导致漏诊或诊疗过度,为后续的不规范宫颈病变治疗带来隐患,因此更需要引起临床高度关注[13-14]。
宫颈细胞学检查为初筛手段,在宫颈癌早期筛查中发挥了十分重要的作用。但一致性差,漏诊和误诊率高,尤其漏诊容易发生在细胞学诊断为HSIL以下的标本和腺癌。而HR-HPV阳性仅证明处于感染状态,对于大部分年轻女性可以在感染后的6~9个月通过表层宫颈细胞的自然脱落而清除掉HPV,成为暂时性的一过性感染。但目前HR-HPV检测手段不能区分属于一过性感染还是持续性感染,即使持续性感染也不一定就是宫颈癌前病变或宫颈癌,也不能明确宫颈癌的发展阶段[12]。因此尽管HPV检测具有较高的敏感度和阴性预测值,但特异度和阳性预测值较低[15],而导致过度的治疗和干预造成医疗资源浪费。
本研究中细胞学ASC-US的74例患者中,炎性反应性疾病或正常高危型HPV阳性率可达50.91%(28/55),因此单纯依靠HPV分流,会增加更多的阴道镜转诊次数。迫切需要引入有效简便用于分流的生物学标志物。本研究显示,p16在正常宫颈鳞状细胞中或炎性反应中仅有38.18%(21/55)表达,但在HSIL中100%表达。p16在一定程度上可以评估HR-HPV感染者发生高级别病变的可能性,以p16分流,双阳性转诊阴道镜检查,必要时取活检;单阳性可随访;双阴性可常规筛查,且适当延长随访时间[16-17]。
3.3 液基薄层细胞p16、HR-HPV在ASC-H中的应用价值 细胞学ASC-H为细胞学形态的异常改变,具有HSIL某些细胞学的一些特征,但缺乏明确诊断HSIL的证据,被认为是特殊的可疑或不确定的HSIL。ASC-H的诊断特异度和一致性差,具有较高的误诊和漏诊率,且发生CINⅡ级以上的风险高。本研究发现,细胞学ASC-H的35例标本中,24例组织学证实为CINⅡ级以上,占比68.57%,与相关文献报道接近[10]。研究发现,细胞学表现为ASC-H,漏诊为CINⅡ级以上的几率高达63.4%,这一诊断本身也是对CINⅡ级以上漏诊的独立高危因素[18],因此对细胞学ASC-H的病例需更加关注,应直接转诊阴道镜,根据阴道镜检查结果选择不同的随访方式。ASC-H的HR-HPV感染阳性率更高,因此采用HR-HPV分流没有更好的证据支持。本研究发现,在ASC-H患者中p16在正常宫颈鳞状细胞中或炎性反应中有85.71%(6/7)表达,在HSIL中仍是100%表达,考虑是因为ASC-H中炎性反应和正常的人数较少仅7例,导致差异无统计学意义,但HSIL中p16表达比率100%,可见p16作为ASC-H的分流同样有较高的特异度。可以作为ASC-H的辅助检查手段,能减少漏诊高级别子宫颈病变的风险并指导后续的随访监测。
3.4 液基薄层细胞学p16弥补TCT的不足 TCT和p16由同一病理医师阅片,对于p16阳性,即使细胞学未见异常,病理医师会有较高的警觉性进行重复仔细阅片以免漏诊,尤其对于HSIL和腺上皮病变。此外阴道镜检查时,对细胞学HSIL、ASC-H、AGC且p16阳性者,应增加血管丰富的部位活检率和颈管诊刮率。由于p16结果判读基于颜色的区别,相比TCT对细胞形态学的判读更为简单,易于实现数字化自动阅片,节省细胞学筛查的时间,增加结果的重复性和准确性。因此敏感度高的p16检测可一定程度弥补TCT的不足。
总之,液基薄层细胞学p16对CINⅡ级以上病变具有良好的敏感度和特异度,敏感度与HR-HPV相似且特异度更好,其表达与宫颈病变级别显著一致,有望成为ASC-US和ASC-H的有效分流方法,避免不必要过度的阴道镜转诊活检而破坏宫颈完整性。待今后扩大样本量进一步探讨液基薄层细胞p16在宫颈病变诊断和疾病治疗检测的价值。
利益冲突:所有作者声明无利益冲突
作者贡献声明
赵芳、马德勇:设计研究方案,实施研究过程,论文撰写;王婷婷:进行统计学分析;张岩、董颖、赵健:提出研究思路,分析试验数据,论文审核
