岩藻聚糖硫酸酯降解酶产生菌的筛选鉴定及酶学特性研究
2020-12-28刘淮德徐文飞王菲菲王晶
刘淮德 徐文飞 王菲菲 王晶

摘要 [目的]從水环境中筛选高活性降解菌,从而将高分子多糖降解为低分子量、药用价值更高的多糖。[方法]通过唯一碳源、富集培养等方法对淡水来源的细菌进行筛选获得活性较高的岩藻聚糖硫酸酯降解菌,然后根据菌株的形态、生理生化特征及16S rDNA分析和进化树构建进行种属鉴定,进一步对降解菌粗酶液的热稳定性、最适反应温度、最适pH和金属离子对酶稳定性影响进行研究。[结果]筛选获得了2株活性较高的岩藻聚糖硫酸酯降解菌JS3和JN3,这2株菌菌液酶活达384、410 U。菌株JS3和JN3归属于克雷白氏杆菌属(Klebsiella sp.)。酶学分析表明,JS3和JN3菌株粗酶液在40~70 ℃具有比较好的热稳定性,在pH 4.0~7.0内,该酶能保持良好的稳定性。JS3和JN3粗酶液与底物反应的最适温度分别为45、40 ℃,最适pH均为5.0。金属离子对酶的活性有一定影响,离子浓度为1×10-2 mol/L时,Mg2+、Ca2+、Zn2+对该酶有激活作用,Cu2+则强烈抑制酶活,Ni2+也在一定程度上抑制该酶活性。[结论]该研究发现的产酶菌株可以用于岩藻聚糖硫酸酯低聚糖的制备,为岩藻聚糖硫酸酯降解酶的制备和应用提供依据和基础。
关键词 岩藻聚糖硫酸酯降解酶;降解菌;筛选;鉴定;酶学特性
中图分类号 TS 254.1文献标识码 A
文章编号 0517-6611(2020)23-0016-05
doi:10.3969/j.issn.0517-6611.2020.23.004
Isolation and Identification of a Fucoidanase-producing Freshwater Bacterium and Enzymatic Properties Research
LIU Huai-de,XU Wen-fei,WANG Fei-fei et al
(Nantong University,Nantong,Jiangsu 226019)
Abstract [Objective]In this paper,high activity degrading bacteria were screened from water environment to degrade high molecular weight polysaccharides into polysaccharides with low molecular weight and higher medicinal value.[Method]Two fucoidanase-producing freshwater bacterium which have high enzyme activity were isolated by the methods of sole carbon source and enrichment culture.Strains were identified by a variety of methods including the morphological and physiological characteristics,as well as 16S rDNA analysis.Furthermore,the effects of thermal stability,optimal reaction temperature,optimal pH and metal ions on the enzyme stability were studied.[Result]The enzyme activity of two strains JS3 and JN3 reached 384,410 U.They were identified to be Klebsiella sp..Fucoidanase producing Klebsiella sp.had not been reported from freshwater before.The results showed that the fucoidanases of those strains remained stable at 40-70 ℃ and efficiently degraded at pH 4.0-7.0.The optimal reaction temperature of fucoidanases JS3 and JN3 were 45 ℃ and 40 ℃ respectively,while the most stable pH for both of the enzyme was 5.0.The presence of Mg2+,Ca2+ and Zn2+ activated the enzyme,however,Cu2+ had strongly inhibitory effects on the enzymatic activity.And Ni2+ can also inhibit the enzyme activity to a certain extent.[Conclusion]This study has laid a foundation for the further characterization of the enzyme and paved the way for the production of lower molecular weight fucoidan as well as fucoidan oligosaccharides in the future.
Key words Fucoidanase;Degrading bacterium;Isolation;Identification;Enzymatic characteristics
岩藻聚糖硫酸酯是一种独特的活性多糖,具有抗凝血、降血压、降血脂、治疗慢性肾衰等多种生物活性[1],但是由于多糖结构复杂、溶解性差、生物吸收利用度低等缺点限制了其在医学中的应用,对糖类药物的研究逐渐从多糖转到低聚糖和寡糖。近年来,低分子量岩藻聚糖硫酸酯的研究受到了广泛的关注,Wang等[2]利用过氧化氢氧化降解方法制备得到分子量为6 000 Da的低分子量岩藻聚糖硫酸酯,其具有更好的抗氧化和治疗慢性肾衰的活性。常用的多糖降解手段有化学法、酶法和物理方法[3]。传统的化学水解法降解岩藻聚糖反应条件剧烈,工艺条件难以控制,活性物质易被破坏且产物不易控制。酶作为一种有催化活性的蛋白质,具有催化效率高、底物专一性强、反应条件温和、产物不易被破坏等优点而逐步取代化学水解。岩藻聚糖硫酸酯降解酶有2种类型:①内切型岩藻聚糖硫酸酯降解酶,可以断裂岩藻聚糖核心处的糖苷键,导致分子量快速降低;②外切型岩藻聚糖硫酸酯降解酶,可以作用于糖链的端基,依次释放一些单糖和寡糖,从而使分子量缓慢降低[4]。
目前对于岩藻聚糖硫酸酯降解酶来源的研究主要集中在海洋软体动物和海洋细菌中,也有科学家从其他无脊椎动物中制备获得了岩藻聚糖硫酸酯降解酶[5]。岩藻聚糖硫酸酯降解酶对底物有较强的依赖性,不同来源的岩藻聚糖硫酸酯降解酶只能降解一种或几种特点结构的岩藻聚糖。Silchenko等[6]从海洋细菌KMM 3553中分离出一种岩藻聚糖硫酸酯降解酶,他们发现这种岩藻聚糖硫酸酯降解酶可以催化水解来源于Fucus evanescens和Fucus vesiculosus的岩藻聚糖,而不能催化水解来源于Saccharina cichorioides的岩藻聚糖。该酶更容易水解脱乙酰后的F.evanescens多糖岩藻聚糖,而对脱硫的岩藻聚糖水解作用非常弱。分析酶解产物的结构发现,这种海洋细菌合成的是一种α-L-岩藻糖苷酶,它可以通过内切作用特异性地切断由3-和4-交替连接、2位硫酸化的岩藻聚糖链中1-4糖苷键。Kim等[7]利用生物信息学的方法表达和纯化了一种来自细菌Sphingomonas paucimobilis PF-1的岩藻聚糖降解酶(FNase S),它可以将高分子量(MF,1 246 kD)的岩藻糖降解为低分子量(小于4 kD)的半乳岩藻寡糖。进一步研究表明FNase S是一种内切型岩藻聚糖酶,它可以同时攻击岩藻聚糖糖链,迅速制备出低分子量的半乳岩藻寡糖。
目前发现的可以降解岩藻聚糖硫酸酯的菌株大多来源于海洋[6-9]。一方面,受海洋特殊生长环境的影响,这些菌种的产酶性状极不稳定;另一方面,大部分岩藻聚糖降解酶活性都比较低,只能用于实验室小剂量岩藻聚糖的降解,目前还没有商品化的岩藻聚糖降解酶。寻找一种性状稳定、易于培养、产酶效率高、活性高的可以降解岩藻聚糖硫酸酯的菌株成为整个问题的关键,具有重要的理论意义和应用价值。
该研究拟从江水和江泥中筛选可以降解岩藻聚糖硫酸酯的菌株,通过菌株的形态、生理生化特征及16S rDNA种属鉴定和进化树构建,明确菌株的种属,并且对粗酶液的热稳定性、最适反应温度、最适pH和金属离子对酶稳定性影响进行初步研究,以期为以后岩藻聚糖硫酸酯低聚糖的酶法制备奠定基础。
1 材料与方法
1.1 菌株来源 菌株来源于从南通市工农南路滨江公园采集的江水样本3份以及江泥样品6份。
1.2 試剂
岩藻聚糖硫酸酯(中国科学院海洋研究所提供,分子量87.0 kD,岩藻糖24.8%,硫酸基26.5%,糖醛酸6.5%)、磷酸高铁、硝酸铵、硫酸镁、氯化钙、磷酸氢二钠、氯化钠、蛋白胨、硫酸亚铁、磷酸氢二钾、硫酸铵、琼脂、吐温-80、硫胺素、牛肉膏、岩藻糖、酒石酸钾钠、氢氧化钠、3,5-二硝基水杨酸、苯酚、草酸铵结晶紫、卢戈氏碘液、95%乙醇、番红、硫酸铜、过氧化氢溶液(10%)、葡萄糖、肌酸、甲基红试剂、磷酸二氢钠、盐酸溶液、甘氨酸、醋酸钠、 冰醋酸、磷酸二氢钾、硫酸镍、硫酸锰、硫酸锌、丙酮、琼脂糖等试剂均为国产化学纯试剂。
1.3 培养基 A.富集培养基:岩藻聚糖硫酸酯3 g,硫酸镁2 g,硝酸铵1.5 g,磷酸高铁0.1 g,磷酸氢二钠0.5 g,氯化钙50 mg,蒸馏水1 000 mL,pH 7.0,1×105 Pa灭菌20 min。
B.分离培养基:岩藻聚糖硫酸酯7 g,氯化钠25 g,硫酸铵2 g,磷酸氢二钾1 g,蒸馏水1 000 mL,琼脂20 g,pH 7.0,1×105 Pa灭菌20 min。
C.发酵培养基:岩藻聚糖硫酸酯9 g,氯化钠25 g,硫酸铵3 g,硫酸高铁1 g,磷酸氢二钾1 g,吐温-80 1 mL,硫胺6 μmol,蒸馏水1 000 mL,pH 7.5,1×105 Pa灭菌20 min。
D.复筛培养基:岩藻聚糖硫酸酯5 g,氯化钠20 g,蛋白胨4 g,磷酸氢二钾2 g,蒸馏水1 000 mL,pH 7.5,1×105 Pa灭菌20 min。
E.牛肉膏蛋白胨培养基:牛肉膏 3 g,蛋白胨10 g,氯化钠5 g,琼脂20 g,蒸馏水1 000 mL,pH 7.4~7.6,1×105 Pa灭菌20 min。
F.斜面培养基:牛肉膏3 g,蛋白胨10 g,氯化钠5 g,琼脂20 g,蒸馏水1 000 mL,pH 7.4~7.6,1×105 Pa灭菌20 min。
G.液体培养基:葡萄糖5 g,蛋白胨5 g,氯化钠0.5 g,琼脂20 g,蒸馏水1 000 mL,1×105 Pa灭菌20 min。
1.4 菌种分离与纯化 取10 g江泥或10 mL江水放入250 mL的三角瓶中,加入90 mL超纯水稀释振荡混匀。然后取10 mL液体到100 mL富集培养基的三角瓶里,30 ℃、150 r/min,摇床富集培养72 h。然后吸取10 mL培养液到新鲜的富集培养基中继续进行培养,重复同样的步骤2~3次,接着在分离培养基划线分离单菌落,挑选出有明显液化圈的单菌落进行反复划线纯化,最后在斜面培养基中保种。
1.5 酶活测定
1.5.1 发酵产酶。
将淡水来源菌株接种至发酵培养基中,30 ℃、150 r/min,摇床培养72 h。将新鲜海带菌株接种于复筛培养基中,30 ℃、150 r/min,摇床培养72 h。
1.5.2 粗酶液制备。
将菌液倒入双层纱布中进行过滤,滤液5 000 r/min,离心15 min,去除沉淀,再向上清液中加入-20 ℃的丙酮溶液,使丙酮浓度达50%,然后静置一段时间后,溶液于5 000 r/min离心15 min,收集沉淀。再用0.07 mol/L的pH 6.5的KH2PO4-NaH2PO4缓冲液复溶,得到的溶液即为粗酶液。
1.5.3 DNS试剂配制。
将185 g酒石酸钾钠溶于500 mL蒸馏水,加热溶解(温度不宜超过50 ℃),再加入262 mL的2 mol/L的NaOH溶液,然后迅速加入6.3 g的3,5-二硝基水杨酸和5 g苯酚,加水定容至1 000 mL。
1.5.4 酶活測定。吸取0.05 mL粗酶液加入0.05 mL 1.0%岩藻聚糖溶液(pH 6.0的C6H8O7-NaHPO4的缓冲液)中,50 ℃水振荡反应10 min,加入0.3 mL DNS溶液,置于沸水浴中10 min,冷却后,用蒸馏水定容至2.5 mL,充分混匀后,于550 nm处测定吸光值,同时以灭活的酶液作对照。
酶活力单位:在上述条件下,每分钟释放1 μmol相当于岩藻聚糖的还原糖的酶量为一个酶活力单位,公式如下:
E=1.978×D×Y
式中,E表示岩藻聚糖降解酶的活力;1.978为换算系数;D表示酶液的稀释度;Y为550 nm下的吸光值。
1.6 菌种鉴定
1.6.1 生理生化鉴定。
对筛选所确定的菌株进行培养特征、革兰氏染色、荚膜染色、需氧性鉴定试验、过氧化氢酶试验、二乙酰试验、甲基红试验等细菌生理生化试验,按“革兰氏阴性杆菌新编码鉴定”系统、API 细菌鉴定系统结合《伯杰氏细菌鉴定手册》对菌株进行检索[10]。
1.6.2 分子鉴定。提取基因组DNA,采用细菌16S rDNA通用引物27F和1492R进行扩增,产物纯化后送上海生工测序公司进行测序,根据所得序列利用MEGA 7.0 软件构建系统发育进化树。
1.7 酶活性试验
1.7.1 热稳定性试验。取粗酶液0.2 mL,在pH为7.0的条件下,于20、30、40、50、60、70和80 ℃条件下,各反应30 min,快速用冷水冰至室温,然后往试管中加入1 mL的0.05 mol/L岩藻聚糖硫酸酯缓冲液(pH=7.0),在45 ℃的条件下,反应15 min后,迅速加入1 mL的DNS试剂,沸水水浴3 min,然后快速冷却至室温,最后加入蒸馏水定容至10 mL,于540 nm的光波下测量吸光度。
1.7.2 最适温度试验。
取粗酶液0.2 mL,往试管中加入1 mL的0.05 mol/L岩藻聚糖硫酸酯缓冲液(pH=7.0),在pH为7.0的条件下,于25、30、35、40、45和50 ℃的温度下,各反应15 min后,迅速加入1 mL的DNS试剂,沸水水浴3 min,快速冷却至室温,然后加蒸馏水定容至10 mL,于540 nm的光波下测量吸光度。
1.7.3 金属离子对酶活的影响。
取粗酶液0.2 mL,往试管中加入1 mL的1×10-2 mol/L金属离子溶液和1 mL的0.05 mol/L岩藻聚糖硫酸酯缓冲液(pH=7.0),在pH为7.0的条件下,45 ℃反应15 min后,再迅速加入1 mL的DNS试剂,沸水水浴3 min,快速冷却至室温,然后加蒸馏水定容至10 mL,于540 nm的光波下测量吸光度。
1.7.4 pH对酶活的影响。
取粗酶液0.2 mL,分别往试管中加入1 mL的pH不同的缓冲液(pH为2.0~3.0的甘氨酸-盐酸缓冲液,pH为4.0~6.0的醋酸缓冲液,pH为7.0~8.0的磷酸盐缓冲液和pH为9.0~10.0的甘氨酸-氢氧化钠缓冲液),反应60 min后,加入1 mL的0.05 mol/L岩藻聚糖硫酸酯缓冲液(pH=7.0),45 ℃反应15 min,再迅速加入1 mL的DNS试剂,沸水水浴3 min,快速冷却至室温,然后加蒸馏水定容至10 mL,于540 nm的光波下测量吸光度。
2 结果与分析
2.1 菌株筛选及酶活测定
利用富集培养和唯一碳源的方法从江水和江泥样本中分离纯化得到9株可以利用岩藻聚糖硫酸酯的菌株,对其产酶情况进行分析研究,其酶活测定结果见表1。从江水中分离得到的3株菌株和江泥中得到的6株菌株对岩藻聚糖硫酸酯都有一定的降解能力,其中酶活较高的JS3和JN3菌株的酶活达384、410 U。
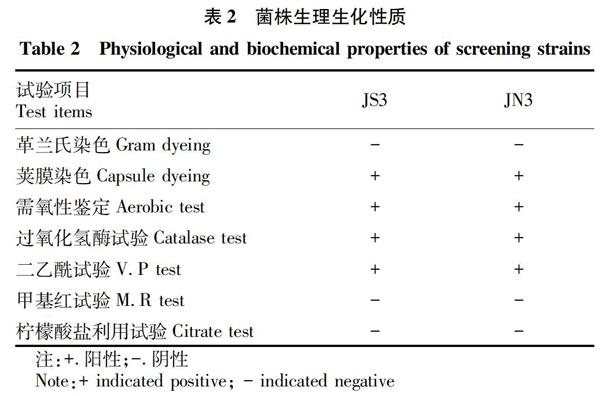
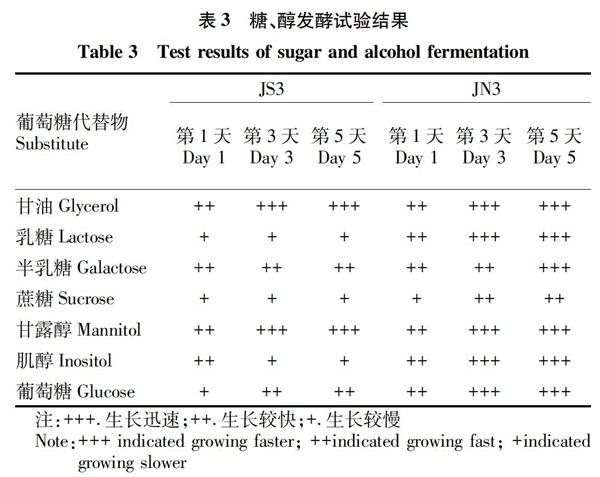
2.2 菌株的基本生长特征与生理生化试验 选取产酶活性较高的2株菌株JS3和JN3进行菌株鉴定和生理生化试验,结果如表2、3所示。这2株菌形态特征为革兰氏阴性短杆菌,具有运动性,在细菌培养基平板上生长形成规则的圆形菌落,呈奶白色,表面光滑湿润,边缘整齐。
2.3 菌株的系统分类地位
通过菌种外部形态观察、各种生理生化试验以及16S rDNA序列分析鉴定为克雷白氏杆菌(Klebsiella sp.),系统发育进化树如图1所示。
2.4 粗酶液性质研究
2.4.1 酶的热稳定性。
粗酶液在pH 7.0的条件下,于20、30、40、50、60、70和80 ℃条件下处理30 min,立即用冰水冷至室温,测定酶保持的活力。以20 ℃下处理后酶液的酶活力为100%。结果如图2,JS3菌株粗酶液酶活在温度升高至40 ℃时下降到80%,但是随着温度继续升高酶活保持稳定,在80 ℃时酶活依然高达80%。JN3菌株粗酶液酶活随温度的上升缓慢下降,当温度高于70 ℃时,酶活迅速下降。2种粗酶液在40~70 ℃都表现出较好的热稳定性。
2.4.2 酶的最适温度。酶与底物在pH为7.0,不同温度(25、30、35、40、45、50 ℃)下反应,测定酶活。结果如图3,JS3菌株产的粗酶液在35~45 ℃内,酶活趋于稳定且较高,45 ℃时达到最大酶活,超过45 ℃时,酶活开始下降,最佳反应温度为45 ℃。JN3菌株产的粗酶液在35~45 ℃内,酶活趋于稳定且较高,40 ℃时达到最大酶活,超过45 ℃时,酶活开始下降,最佳反应温度为40 ℃。
2.4.3 酶的pH稳定性。粗酶液于pH不同的缓冲液中反应,结果如图4,在pH 4.0~7.0内时,酶相对稳定,JS3菌株粗酶液酶活保持在90%以上,JN3菌株粗酶液酶活保持在85%以上。超出此范围,酶活迅速下降。
2.4.4 金属离子对酶活的影响。在酶反应体系中加入不同金属离子,测定其活力。由图5可知,当离子浓度为1×10-2 mol/L时,Zn2+对JS3菌株粗酶液酶活有明显的促进作用,活力提高了20%,Mg2+和Ca2+对酶活也有一定促进作用,但是Cu2+对酶活有显著的抑制作用,酶活下降了50%。Mg2+对JN3菌株粗酶液酶活有明显的促进作用,活力提高了25%,Zn2+和Ca2+对酶活也有一定促进作用,但是Cu2+对酶活有显著的抑制作用,酶活下降了60%。Ni2+对2株菌的粗酶液都有一定抑制作用。
3 讨论
岩藻聚糖硫酸酯降解酶主要来源于海洋微生物[11]、海洋软体动物[12]以及棘皮动物[13],其中微生物是岩藻聚糖硫酸酯降解酶的主要来源。微生物来源主要包括弧菌[14]、交替假单胞菌(Pseudoalteromonas sp.) [15]、交替单胞菌(Alteromonas sp.) [16]等海洋细菌以及真菌[17]。该研究选取南通滨江公园江水、江泥为样本,分别筛选出高活性的菌株JS3、JN3。通过细菌外部形态观察、生理生化试验以及16S rDNA序列分析鉴定JN3、JS3为克雷白氏杆菌属(Klebsiella sp.)。目前,从该属中发现岩藻聚糖硫酸酯降解酶鲜见报道。
菌株粗酶液降解岩藻聚糖硫酸酯的活性是评价菌株是否能有效降解岩藻聚糖硫酸酯的最重要标准。陈惠源等[18]从食鞘氨醇杆菌中制备的岩藻聚糖硫酸酯降解酶粗酶液的活性为130 U,Wu等[19]获得了一株具有岩藻聚糖硫酸酯降解活性的菌株Dendryphiella arenaria TM94,其粗酶液的酶活为379 U。该研究报道的2株菌JS3和JN3的粗酶活达384、410 U,其活性高于食鞘氨醇杆菌的降解活性,和TM94的活性差不多。JS3和JN3分别来自江水和江泥,是淡水菌株,和海水来源的菌株相比,培养条件更加简单,产酶活性高,且酶学性质稳定,是2株有潜力的新型具有岩藻聚糖硫酸酯降解活性的菌株。
JN3和JS3菌株粗酶液的酶活活性的研究表明这2种菌产生的岩藻聚糖硫酸酯降解酶的热稳定比较强,温度上升后,也能保持很高的酶活性,其中JN3的最适反应温度为40 ℃,JS3的最适反应温度为45 ℃。在20~50 ℃的反应区间内,2株菌的粗酶均能保持较高的活性,这说明该酶降解岩藻聚糖硫酸酯时对反应温度要求不高,方便在不同的环境中使用。JN3、JS3的岩藻聚糖硫酸酯降解酶的活力与pH有关,在pH为4.0~7.0时均能保持较好的活性,在pH 5.0时呈现出最大活性。Sakai等[20]分离得到一株降解岩藻聚糖的菌株,属于产黄菌素属(Flavobacteriacea sp.),其酶活最适反应温度为30~35 ℃,pH为6.5~8.0。而该试验筛选出JN3、JS3菌株中降解酶反应温度和对酸碱环境适应范围都比Sakai等分离的菌株更加宽广,在温度为30~50 ℃和pH在4.0~7.0时都能保持很高的活性。
金属离子对于酶活有一定影响,Mg2+、Ca2+、Zn2+对JN3、JS3中酶均有一些激活作用,而Cu2+强烈抑制酶活,Ni2+也在一定程度上抑制酶活性。与冯蕾等[21]的研究结果相同,推测Ca2+、Mg2+、Zn2+等离子可以和酶活性中心作用,使酶活中心结构发生改变,从而使酶的活性增加。而Cu2+和Ni2+占据了酶活中心的活性位点,使酶不能与多糖作用而产生相应的降解活性。
4 结论
该研究从江水、江泥中筛选获得了2株高活性的具有岩藻聚糖硫酸酯降解活性的菌株JS3和JN3,其粗酶活性高達384、410 U。经鉴定,2株菌均属于克雷白氏杆菌(Klebsiella sp.),这是首次从该菌属中发现具有岩藻聚糖硫酸酯降解活性的菌株。通过对粗酶活性研究,发现该酶具有较好的热稳定性和较宽的pH使用范围,但是该酶的降解性质及底物特异性如何是值得深入研究的课题。该研究为进一步开发岩藻聚糖硫酸酯降解酶及利用其来制备岩藻聚糖硫酸酯低聚糖和寡糖等提供了先决条件。
参考文献
[1]DENIAUD-BOUT E,HARDOUIN K,POTIN P,et al.A review about brown algal cell walls and fucose-containing sulfated polysaccharides:Cell wall context,biomedical properties and key research challenges[J].Carbohydrate polymers,2017,175:395-408.
[2] WANG J,ZHANG Q B,JIN W H,et al.Effects and mechanism of low molecular weight fucoidan in mitigating the peroxidative and renal damage induced by adenine[J].Carbohydrate polymers,2011,84(1):417-423.
[3] 陳蕾,吴皓.多糖降解方法的研究进展[J].中华中医药学刊,2008,26(1):133-135.
[4] VICKERS C,LIU F,ABE K,et al.Endo-fucoidan hydrolases from glycoside hydrolase family 107 (GH107) display structural and mechanistic similarities to α-L-fucosidases from GH29[J].Journal of biological chemistry,2018,293(47):18296-18308.
[5] BERTEAU O,MULLOY B.Sulfated fucans,fresh perspectives:Structures,functions,and biological properties of sulfated fucans and an overview of enzymes active toward this class of polysaccharide[J].Glycobiology,2003,13(6):29R-40R.
[6] SILCHENKO A S,KUSAYKIN M I,KURILENKO V V,et al.Hydrolysis of fucoidan by fucoidanase isolated from the marine bacterium,Formosa algae[J].Marine drugs,2013,11(7):2413-2430.
[7] KIM W J,PARK J W,PARK J K,et al.Purification and characterization of a fucoidanase (FNase S) from a marine bacterium Sphingomonas paucimobilis PF-1[J].Marine drugs,2015,13(7):4398-4417.
[8] SILCHENKO A S,IMBS T I,ZVYAGINTSEVA T N,et al.Brown alga metabolites-inhibitors of marine organism fucoidan hydrolases[J].Chemistry of natural compounds,2017,53(2):345-350.
[9] OHSHIRO T,OHMOTO Y,ONO Y,et al.Isolation and characterization of a novel fucoidan-degrading microorganism[J].Bioscience,biotechnology,and biochemistry,2010,74(8):1729-1732.
[10] HOLT J G,KRIEG N R,SNEATH P H A,et al.Bergeys manual of determinative bacteriology[M].9th ed.Baltimor:William & Wilkins,1994:87.
[11] SASAKI K,SAKAI T,KOJIMA K,et al.Partial purification and characterization of an enzyme releasing 2-sulfo-α-L-fucopyranose from 2-sulfo-α-L-fucopyranosyl-(1→2)pyridylaminated fucose from a sea urchin,Strongylocentrotus nudus[J].Bioscience,biotechnology,and biochemistry,1996,60(4):666-668.
[12] DESCAMPS V,COLIN S,LAHAYE M,et al.Isolation and culture of a marine bacterium degrading the sulfated fucans from marine brown algae[J].Marine biotechnology,2006,8(1):27-39.
[13] SILCHENKO A S,KUSAYKIN M I,ZAKHARENKO A M,et al.Endo-1,4-fucoidanase from Vietnamese marine mollusk Lambis sp.which producing sulphated fucooligosaccharides[J].Journal of molecular catalysis B:Enzymatic,2014,102:154-160.
[14] FURUKAWA S I,FUJIKAWA T,KOGA D,et al.Production of fucoidan-degrading enzymes,fucoidanase,and fucoidan sulfatase by Vibrio sp.N-5[J].Nippon suisan gakkaishi,1992,58(8):1499-1503.
[15] IVANOVA E P,BAKUNINA I Y,SAWABE T,et al.Two species of culturable bacteria associated with degradation of brown algae Fucus evanescens[J].Microbial ecology,2002,43(2):242-249.
[16] SAKAI T,KAWAI T,KATO I.Isolation and characterization of a fucoidan-degrading marine bacterial strain and its fucoidanase[J].Marine biotechnology,2004,6(4):335-346.
[17] RODRGUEZ-JASSO R M,MUSSATTO S I,PASTRANA L,et al.Fucoidan-degrading fungal strains:Screening,morphometric evaluation,and influence of medium composition[J].Applied biochemistry and biotechnology,2010,162(8):2177-2188.
[18] 陈惠源,蔡俊鹏,刘江涛.岩藻多糖降解酶产生菌的筛选及鉴定[J].现代食品科技,2005,21(3):42-44.
[19] WU Q Q,ZHANG M,WU K,et al.Purification and characteristics of fucoidanase obtained from Dendryphiella arenaria TM94[J].Journal of applied phycology,2011,23(2):197-203.
[20] SAKAI T,KIMURA H,KATO I.A marine strain of Flavobacteriaceae utilizes brown seaweed fucoidan[J].Marine biotechnology,2002,4(4):399-405.
[21] 馮蕾,唐学玺,王艳玲,等.褐藻酸降解酶特性的初步研究[J].海洋科学,2006,30(2):30-33.
基金项目 海洋科学与技术国家实验室开放课题(0F2015N007)。
作者简介 刘淮德(1981—),男,山东潍坊人,讲师,博士,从事海洋生物学相关研究。*通信作者,副研究员,博士,从事海洋药物学相关研究。
收稿日期 2020-08-13
