海藻酸钠与MOFs复合材料固定化果胶酶的研究
2020-12-28郝红英于正花詹海鹃刘万毅毕淑娴
郝红英 于正花 詹海鹃 刘万毅 毕淑娴


摘要 主要制备海藻酸钠与MOFs复合材料(Alg-HKUST-1)微球进行果胶酶的固定化,将海藻酸钠以注射的方式加入到含有Cu2+的溶液中,通过金属离子诱导自组装,制备了海藻酸钠与MOFs复合材料,其中MOFs颗粒分布均匀,嵌入在复合材料的表面上。复合材料的形状是通过控制相应的水凝胶形状来控制的。通过利用扫描电镜、FT-IR等技术分别对微球的表观及性质进行了分析。果胶酶的固定化试验主要考察了底物浓度、pH、温度、时间等对果胶酶的影响。将游离果胶酶和固定化果胶酶酶学性质进行比较,主要结论是酶的最佳催化条件为自由酶pH=3.0,固定化酶pH=3.5;自由酶的反应温度为40 ℃,固定化酶的反应温度为50 ℃;最佳反应时间为60 min。酶經过载体固定化后,其储存稳定性有所提高。
关键词 海藻酸钠水凝胶; MOFs;果胶酶;固定化
中图分类号 Q 814文献标识码 A
文章编号 0517-6611(2020)23-0006-04
doi:10.3969/j.issn.0517-6611.2020.23.002
Study on the Sodium Alginate and MOFs Composite for Immobilized Pectinase
HAO Hong-ying,YU Zheng-hua,ZHAN Hai-juan et al
(State Key Laboratory of High-efficiency Utilization of Coal and Green Chemical Engineering,National Demonstration Center for Experimental Chemistry Education,College of Chemistry and Chemical Engineering,Ningxia University,Yinchuan,Ningxia 750021)
Abstract To mainly prepare sodium alginate and MOFs composite material (Alg-HKUST-1) microspheres for immobilization of pectinase.Sodium alginate was added to the solution containing Cu2+ by injection, self-assembly was induced by metal ions, the sodium alginate and MOFs composites were prepared, where MOFs particles are evenly distributed and embedded on the surface of the composite material.The macroscopic shape of the composite can be designed by controlling the shape of the corresponding hydrogel.The apparent and properties of microspheres were analyzed by SEM and FT-IR techniques.The immobilization experiments of pectinase mainly investigated the effects of substrate concentration,pH,temperature and time on pectinase.And the enzymatic properties of free pectinase and immobilized pectinase were compared. The optimal catalytic conditions for the enzyme are free enzyme pH=3.0 and immobilized enzyme pH=3.5.The reaction temperature of the free enzyme is 40 ℃ and the reaction temperature of the immobilized enzyme is 50 ℃.The best response time is 60 min. After the enzyme has been immobilized by the carrier,its storage stability has been improved.
Key words Alginate hydrogel;MOFs;Pectinase;Immobilization
果胶酶是指催化植物细胞壁中果胶聚合物水解的多种酶的总称[1],广泛存在于高等植物和微生物中,在某些原生动物和昆虫中也有发现。果胶酶是果蔬汁加工业中最重要的一类酶,它可以有效地提高果蔬出汁率,改善过滤效果,增强澄清作用[2]。大多数酶的化学本质是蛋白质,酶催化反应通常是在溶液中进行,会有回收困难以及产品生化分离提纯操作上的困难,增加生产工艺步骤,提高生产成本。而使用游离酶,酶反应只能分批进行,难以连续化、自动化操作。这严重地阻碍了酶工程的发展应用。将游离酶固定化是克服上述缺点的方法之一[3-6]。
海藻酸钠是存在于褐藻类中的天然高分子,是从褐藻或细菌中提取出的天然多糖,海藻酸钠分子链的G块易与二价金属离子Ca2+、Ba2+等作用交联成三维网状结构的凝胶,形成“蛋盒”模型,将酶固定在凝胶网络中[7-8]。这种线性高分子化合物含有自由的羧基和羟基,作为固定化酶载体,具有良好的生物相容性、生物降解性,传质性能好,成本低以及操作简单等优点[9-10]。由于海藻酸钠本身性质很不稳定,无法长期保存,故采取复合改性措施。
MOFs是由无机金属中心与桥连的有机配体通过自组装相互连接,形成的一类具有周期性网络结构的晶态多孔材料。MOFs是一种有机-无机杂化材料,也称配位聚合物,兼有无机材料的刚性和有机材料的柔性特征。它具有高孔隙率、低密度、大比表面积、孔道规则、孔径可调以及拓扑结构多样性和可裁剪性等优点[11-12]。
该研究以海藻酸钠与MOFs复合材料作为酶的固定化载体,固定果胶酶并研究其催化性能。
1 材料与方法
1.1 材料与试剂
海藻酸钠、99%三水合硝酸铜、99% 1,3,5-三苯甲酸、N,N-二甲基甲酰胺:阿拉丁试剂;戊二醛:上海中秦化学试剂有限公司;无水乙醇:烟台市双双化工有限公司;果胶、果胶酶:上海瑞永生物科技有限公司;柠檬酸:徐州天鸿化工有限公司;柠檬酸钠:上海广诺化学科技有限公司;酒石酸钠、3,5-二硝基水杨酸:上海中秦化学试剂有限公司;氢氧化钠:天津市风船化学试剂科技有限公司;苯酚:烟台市双双化工有限公司;无水亚硫酸钠:上海广诺化学科技有限公司。
1.2 仪器
85-2恒温磁力搅拌器:金坛市城东新瑞仪器厂;JD200-4电子分析天平:沈阳龙腾电子有限公司;D2F-6050真空干燥箱:上海慧泰仪器制造有限公司;KA-1.0离心机:上海安亭科学仪器厂;PSHJ-5酸度计:西安精密仪器仪表有限公司;SHA-C数显恒温振荡器:金坛市杰瑞尔电器有限公司;UV-1800PC紫外可见分光光度计:上海美谱达仪器有限公司;ETS-D5 S25数显型磁力加热搅拌器:上海普赫光电科技有限公司。
1.3 固定化酶的制备及其性能研究
1.3.1 固定化酶载体制备。先将3 mL海藻酸钠溶液用注射器以液滴的形式,注射到15 mL三水合硝酸铜溶液中,搅拌18 h,攪拌之后用蒸馏水和乙醇各洗2次,以除去多余的Cu2+。制得的Cu2+凝胶转入15 mL 30 mg/mL 1,3,5-三苯甲酸溶液中,在85 ℃下让MOFs生长反应18 h。所得的MOFs复合物用乙醇和热乙醇各洗涤2次,80 ℃干燥。再称取0.5 g海藻酸钠与MOFs复合材料,加入4%的戊二醛溶液10 mL,磁力搅拌10 h,搅拌之后用蒸馏水洗3次,除去多余的戊二醛。过滤并晾干,即得交联的海藻酸钠与MOFs复合材料载体[13]。
1.3.2 固定化酶的制备。
1.3.2.1 DNS试剂的配制。称取3,5-二硝基水杨酸10 g溶于蒸馏水中,加入20 g氢氧化钠、200 g酒石酸钾钠和500 mL水加热溶解。之后加入5 g苯酚、5 g无水亚硫酸钠,待全部溶解后定容至1 000 mL,储存于棕色瓶中,放置7 d后使用。
1.3.2.2 pH为3.5的柠檬酸-柠檬酸钠缓冲溶液的配制。称取柠檬酸21.01 g溶解后定容至1 000 mL容量瓶中。称取29.41 g柠檬酸钠溶解后定容至1 000 mL容量瓶中。取一定量的柠檬酸、柠檬酸钠混合,用pH计测定pH为3.5。
1.3.2.3 1%果胶溶液的配制。用分析天平称取果胶1 g,用pH为3.5的缓冲溶液溶解,定容至100 mL容量瓶中。
1.3.2.4 1%胶酶溶液的配制。同果胶溶液的配制方法相同。
将一定的海藻酸钠微球加入一定比例稀释后的戊二醛溶液中,并置于磁力搅拌器上搅拌10 h,交联之后用去离子水洗至中性。将上述载体加入1%的果胶酶溶液。在37 ℃恒温振荡器上反应4 h,4 h之后取出,倒出上清液置于冰箱中保存,备测载酶量。沉淀先用蒸馏水洗涤,再用pH=3.5缓冲溶液洗涤,除去多余的戊二醛和游离酶,抽滤即得固定化酶。
1.3.3 固定化果胶酶酶活力及载酶量的测定。
1.3.3.1 固定化果胶酶活力测定。取2支25 mL比色管,将其进行1、2编号,向1号比色管中加入海藻酸钠与MOFs复合材料固定化果胶酶0.05 g,在40 ℃水浴中反应5 min,加入1%的果胶溶液1 mL、pH=3.5的缓冲溶液2 mL,向2号试管加入pH=3.5的缓冲溶液4 mL,2支比色管在40 ℃反应30 min,取出,分别加入1 mol/L NaOH溶液5 mL、DNS试剂1.5 mL,沸水中煮沸5 min,立即冷却,定容至25 mL,摇匀,以2号比色管为空白调零。在540 nm下测其吸光度。
1.3.3.2 载体载酶量的测定。取2 mL未固定上的果胶酶,加入1 mL果胶溶液,40 ℃水浴反应30 min,反应完之后加入1.5 mL DNS溶液,并在沸水中煮沸5 min,立即冷却,定容至25 mL。以测标准曲线时的参比溶液为参比,测其吸光度。
经测定,固定化果胶酶的载酶量为225.38 mg/g,比酶活为239.04 U/mg。
2 结果与分析
2.1 载体的表征
图1为海藻酸钠与MOFs复合材料交联前后的扫描电镜图,通过扫描电镜研究海藻酸钠与MOFs复合材料的形态。通过在80 ℃下直接干燥得到的样品,由于干燥后发生收缩,在干燥的Cu2+交联水凝胶的表面上看到褶皱。海藻酸钠与MOFs水凝胶的表面和内部出现类似于水凝胶的多孔结构。交联之前,载体的表面结构比较紧密,表面凹凸不平,可有效增大比表面积,是固定化酶的优良载体。从图中可以看到海藻酸钠与MOFs复合微球呈规则的球形,单分散性较好。交联之后,复合微球的表面结构变得疏松,由交联前的图1b到交联后的图1g可知,复合微球的内部结构被打开。这说明交联后的载体能更好地和酶结合。
从FT-IR谱图可以看出复合材料的官能团特征峰明显,1 613 cm-1处为海藻酸钠的—COOH伸缩振动吸收峰,在1 035 cm-1处是海藻酸钠的—OH吸收峰。1 022 cm-1和1 091 cm-1处为海藻酸钠的—CO键的伸缩振动峰,1 711 cm-1处为1,3,5-三苯甲酸中羧酸CO双键伸缩振动峰。3 400~2 500 cm-1处为海藻酸钠的O—H键的伸缩振动吸收峰。1 240 cm-1和1 361 cm-1处为有机配体1,3,5-三苯甲酸中苯环的骨架振动吸收峰。在1 565 cm-1处出现了新的特征吸收峰,并且吸收峰明显加强,这是因为发生了Schiff反应形成了Schiff碱键(CN)的吸收峰,这表明海藻酸钠与MOFs复合微球成功与戊二醛发生了交联反应。FT-IR谱图如图2。
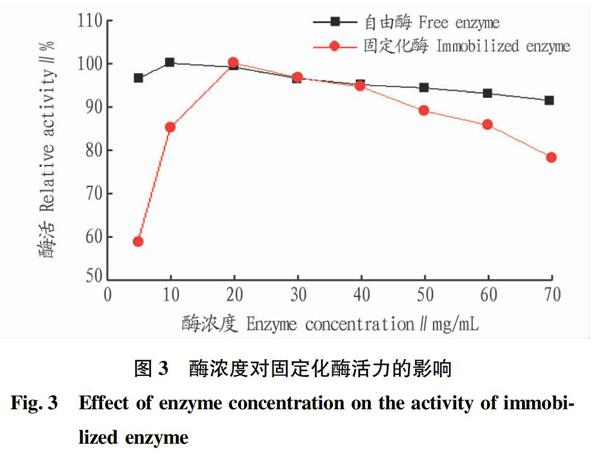
2.2 不同酶浓度对酶活的影响 试验分2组,一组分别依次加入10、20、30、40、50、60、70 mg/mL的自由酶1 mL;另一组依次加入固定不同酶浓度后的固定化酶0.03 g。继续向2组比色管中分别加入pH=3.5缓冲液2 mL、1%果胶溶液1 mL;在40 ℃水浴中加热30 min,加热之后向2组比色管分别加入1 mol/L NaOH溶液5 mL、DNS试剂1.5 mL,在沸水中加热5 min灭活。
由图3可知,自由酶的最佳酶浓度为10 mg/mL,而固定化酶的最佳酶浓度为20 mg/mL,酶是一种活性蛋白,当酶的浓度较小,底物浓度大于酶时,酶浓度与反应速度成正比;当底物浓度一定时,酶浓度继续增加到一定值以后,其反应速度并不加快[14]。由于上述关系,过大地增加用酶量不能收到预期效果。若在载体上加过多的酶量,则酶在载体的结合点趋于饱和,会堵在载体的表面或网孔里,造成底物扩散困难,难与活性中心接近,故酶活降低。
2.3 不同温度对固定化酶活力的影响
分别在25、30、35、40、45、50、60 ℃时测定固定化酶和自由酶的酶活,结果如图4所示。
由图4可以看出,游离果胶酶的最适温度为40 ℃,固定化果胶酶的最适温度提高到50 ℃,表明固定化后其耐热性有所提高。酶对温度很敏感,升高温度可改变酶促反应速度。在最适温度时,酶活最高,而偏离此温度时,酶活变小,且温度过高会使酶变性失活。
2.4 不同pH对酶活力的影响
分别在pH为2.6、3.0、3.5、40、4.5、5.0、5.5时测定自由酶和固定化酶的活力,结果如图5。
pH可改變底物的带电状态,从而影响底物分子与酶的结合。由图5可以看出,游离果胶酶pH在2.5~3.0时,游离酶活力随着pH的增加而增大;而最适pH为3.0,pH大于30时,酶活随pH增加而下降。pH在2.6~3.5时,固定化果胶酶活力随着pH的增大而增加,但在pH大于35时呈下降趋势,故固定化果胶酶的最适pH为3.5。可以看出pH是果胶酶固定化的一个重要影响因素。
2.5 不同反应时间对酶活力的影响
分别在反应时间为15、30、45、60、90、120、150 min时测定其对酶活力的影响(图6)。
由图6可知,游离果胶酶和固定果胶酶的最佳反应时间为60 min,反应时间是对酶很重要的影响因素。固定化时间超过60 min时,酶活力呈下降趋势。这是因为如果反应时间过长酶会失去活性,结果是多余的酶会吸附在载体表面上,导致凝胶网孔堵塞,酶蛋白分子相互屏蔽,酶与底物难契合,故而酶活力下降。
2.6 不同果胶浓度对酶活力的影响
配制0.2、0.5、0.8、10、1.2、1.5、2.0 mg/mL的果胶,测定固定化酶和自由酶的酶活,结果如图7。
由图7可知,对于自由酶,当果胶浓度为1.5 mg/mL时,酶活最高;当大于1.5 mg/mL时,酶活趋于稳定。对于固定化酶,当果胶浓度为1.0 mg/mL时,酶活最高;当果胶浓度大于1.0 mg/mL时,酶活急剧下降。
2.7 固定化果胶酶的储存稳定性 将固定化酶和游离酶在4 ℃保存,经1、5、10、15、20、25、30 d,测其酶活力(图8)。
以第1天测得的酶活力为标准100%,由图8可知,自由酶和固定化酶的酶活都随天数的增加有所下降,固定化酶在
4 ℃保存30 d后,酶活力为85.16%,而自由酶活力为7602%,说明果胶酶经过载体固定后,储存稳定性提高。
3 结论
以pH、温度、时间、酶浓度和果胶浓度为因素进行单因素试验,探讨了固定化酶的最佳催化条件。自由酶的最佳pH为3.0,而固定化酶相对于自由酶范围变大,为3.5。这是因为酶是由酶蛋白组成的,其催化能力对外部环境尤其pH很敏感。酶固定化后,对底物作用的最适pH曲线会发生偏移。曲线偏移是因为微环境表面电荷性质的影响。一般来说,若固酶载体带负电荷,则最适pH对于游离酶来说会偏高。而海藻酸钠是带负电荷,故最适pH发生偏移。自由酶的最佳反应温度为40 ℃,而固定化酶相对于自由酶反应温度提高到50 ℃,说明其耐热性提高。最佳反应时间为60 min。对于酶促反应动力学,固定化酶的Km小于游离酶的Km,说明果胶酶经海藻酸钠与MOFs复合材料固定化后对底物的亲和力增大。果胶酶经过载体固定化后,其储存稳定性有所提高。
参考文献
[1]高振红,岳田利,袁亚宏,等.果胶酶在果品加工中的应用及其固定化研究[J].农产品加工(学刊),2007(3):31-33,43.
[2] 杨军,赵学慧.果胶酶对果蔬制汁作用的研究[J].食品科技,1998,23(3):27-29.
[3] WAHAB R A,ELIAS N,ABDULLAH F,et al.On the taught new tricks of enzymes immobilization:An all-inclusive overview[J].Reactive and functional polymers,2020,152:104613-104639.
[4] LIU D M,DONG C.Recent advances in nano-carrier immobilized enzymes and their applications[J].Process biochemistry,2020,92:464-475.
[5] 陈建龙,祁建城,曹仪植,等.固定化酶研究进展[J].化学与生物工程,2006,23(2):7-9.
[6] 宋寅.酰化和酶水解对菜籽蛋白功能性质和抗氧化活性的影响[D].南京:南京财经大学,2011.
[7] LI S J,HU J,LIU B L.Use of chemically modified PMMA microspheres for enzyme immobilization[J].BioSystems,2004,77(1/2/3):25-32.
[8] 陈峰,谭炯,杨学军.壳聚糖及其衍生物的应用[J].西南民族学院学报(自然科学版),2002,28(1):40-44.
[9] 刘铮,林原斌,吕慧丹.交联海藻酸钠磁性微球的制备及固定化胰蛋白酶研究[J].材料导报,2006,20(12):137-140,147.
[10] 林建城,陈越丽.果胶酶在磁性复合载体上的固定化及其酶学性质[J].食品工业科技,2015,36(14):220-224,228.
[11] 李玉玲,李靖靖,王宇飞,等.含N和羧酸混合配体构筑的金属有机框架化合物应用研究进展[J].化学研究与应用,2019,31(12):2031-2036.
[12] 杨斌,文震.气体传感器技术研究与应用[J].科技中国,2020(6):12-17.
[13] ZHU H,ZHANG Q,ZHU S. Alginate hydrogel:A shapeable and versatile platform for in situ preparation of metal-organic frameworkpolymer composites[J]. Acs Appl Mater Interfaces,2016:17395.
[14] 倪文霞,王尚玉,王宏勋,等.纤维素酶法制备高品质红薯渣膳食纤维条件的研究[J].食品工业科技,2011,33(8):204-206,218.
基金项目 国家自然科学基金项目(21467022);宁夏自然科学基金项目(NZ17048);宁夏“化学工程与技术”国内一流学科建设项目(NXYLXK2017A04);宁夏大学西部一流大学建设项目(ZKZD2017003)。
作者简介 郝红英(1997—),女,内蒙古呼和浩特人,碩士研究生,研究方向:利用复合材料固定酶。*通信作者,副教授,从事利用复合材料固定酶研究。
收稿日期 2020-09-07
