触液核组蛋白去乙酰化酶6 参与调控大鼠神经病理性疼痛 *
2020-12-26张红星张励才
李 清 张红星 张励才 周 芳
(1 徐州医科大学护理学院,徐州 221004;2 江苏省麻醉学重点实验室,徐州 221004)
国际疼痛学会将神经病理性疼痛定义为由躯体感觉神经系统损伤或疾病引起的慢性疼痛,常表现为自发性疼痛、痛觉过敏等临床症状[1]。研究报道神经病理性疼痛在人群中的患病率约为7%~10%,其发病机制复杂,目前的治疗手段包括药物及神经阻滞等治疗效果有限,为病人及社会带来较大的负担[2],因此探索新的、更有效的分子及药物治疗靶点具有临床意义。
组蛋白去乙酰化酶 (histone deacetylases, HDACs)是一类蛋白酶,基于序列同源性被分为4 类,其中组蛋白去乙酰化酶6 (histone deacetylase 6, HDAC6) 是II 类中的一员。与HDACs 中其他成员不同,HDAC6主要存在于细胞质中,在结构和功能上均具有独特性,其具有两个催化脱乙酰酶结构域,以及一个锌指泛素结合结构域[3],且在细胞质中与多种非组蛋白底物结合,如α-微管蛋白、泛素、热休克蛋白90 (HSP90)等,从而对其进行调控[4]。HDAC6 的结构特点决定了其能参与调节许多重要的生物学过程,包括细胞生长、代谢、迁移、氧化缓冲能力,错误折叠蛋白质的降解以及免疫突触形成等[5]。所以HDAC6 成为神经保护和神经变性之间维持平衡的关键调节因子,后又发现HDAC6 参与神经病理性疼痛的调控[6,7]。这为本研究神经病理性疼痛提供了分子基础。触液核 (cerebrospinal fluid-contacting nucleus, CSF-contacting nucleus) 是张励才等[8]以霍乱毒素亚单位B 结合辣根过氧化酶复合物 (horseradish peroxidase-conjugated toxin subunit B, CB-HRP) 作为示踪剂,通过侧脑室引入,在国际上首次发现并命名的脑内特殊神经核团。既往研究表明触液核有多种神经活性物质表达,且参与神经病理性疼痛等生命活动的调控[9~12]。但HDAC6 是否在触液核这一新的核团中表达,以及是否参与触液核介导的神经病理性疼痛还未见研究报道。因此,本研究将采用免疫荧光技术结合行为药理学方法探讨HDAC6 在触液核中的表达以及触液核HDAC6 在大鼠神经病理性疼痛中的作用。
方 法
1. 实验动物及分组
SPF 级雄性SD 大鼠48 只,体重240~290 g,由山东济南朋悦实验动物繁育有限公司提供,许可证号:SCXK(鲁)20140007。将大鼠置于12 h/12 h光照/黑暗交替、22~24℃的安静环境中饲养,自由进食和饮水。
分组:①为了观察正常及神经病理性疼痛大鼠触液核中HDAC6 的表达情况,将大鼠分为:Normal组、Sham 组和CCI组(n = 6);②关于Tubastatin A拮抗HDAC6 对大鼠痛阈影响的研究,将大鼠分为:Vehicle 组和Tubastatin A 组(n = 6);③为了观察触液核HDAC6过表达对大鼠神经病理性疼痛的影响,将大鼠分为:Sham + CMV-MCS 组、CCI + CMVMCS 组以及CCI + CMV-HDAC6 组(n = 6)。
2. 实验试剂
CB-HRP(Sigma, 美国);羊抗CB 一抗(Abcam, 英国);HDAC6 小鼠多克隆抗体一抗(Thermo, 美国);驴抗羊AlexaFluor546 二抗(Life Technologies, 美国);驴抗小鼠AlexaFluor488 二抗(Life Technologies, 美国);Tubastatin A(Selleck, 中国);对照病毒pAAV-CMV-MCS-3FLAG-CW3SL(和元生物,中国);HDAC6 过表达病毒pAAV-CMVHDAC6-3FLAG-CW3SL(和元生物,中国)。
3. 实验方法
(1)慢性坐骨神经结扎 (chronic constriction injury, CCI) 模型建立:参考Bennett 等[13]的方法,雄性SD大鼠称重,腹腔内注射10%水合氯醛 (300 mg/kg),选取大鼠左后肢,于后外侧行切口,在股骨后游离坐骨神经主干,用4-0 丝线做4 道环形结扎,各丝线间相距约1 mm,结扎强度以大腿肌肉或足趾产生轻微收缩为宜,随后消毒,缝合伤口。假手术组仅对大鼠进行坐骨神经分离,不进行结扎,其余步骤均相同。
(2)侧脑室给药:SD 大鼠称重,腹腔注射10%水合氯醛(300 mg/kg)进行麻醉。待麻醉后将大鼠固定于脑立体定位仪上,头顶部备皮、消毒,于头顶部皮肤做正中切口,暴露前囟点,参照Paxinos 脑图谱[14]确定侧脑室位置:Bregma:1.2±0.4 mm, Right to median sagittal plane: 1.4±0.2 mm, Depth: 3.2±0.4 mm。用微量注射器抽取药液进行缓慢注射,注射完毕留针5 min,随后消毒,缝合伤口,放回笼中待清醒。HDAC6 拮抗剂Tubastatin A 的注射,按1 mg/ml 的标准称取相应剂量的Tubastatin A 粉末,先用4%的DMSO对其进行溶解,然后加入30%的PEG 300,最后加入67%的双蒸水,混匀。在注射Tubastatin A 的前1 天按上述方法在侧脑室位置钻一小孔,伤口不予缝合,并用红霉素软膏覆盖伤口,第2 天注射时用七氟烷维持大鼠麻醉,进行药物注射。待1 h后进行行为学测量。
(3)组织制备及免疫荧光:大鼠于侧脑室注射30%CB-HRP 后48 h,进行腹腔注射10%水合氯醛进行麻醉,经升主动脉灌注行组织固定。首先使用300 ml 生理盐水进行快速灌注,以快速冲净动物体内血液。接着灌注4%多聚甲醛300 ml 进行组织的前固定,前100 ml 快速灌注,后200 ml 慢滴。灌注结束后取触液核所在节段脑组织,于4%多聚甲醛4℃冰箱内后固定4~6 h,后换入30%蔗糖溶液脱水。待组织沉底,取组织进行冰冻切片,片厚30 μm,组织切片用0.01 M PBS 溶液漂洗3 遍,每遍5 min。加入10%驴血清室温封闭3.5 h,接着混合加入小鼠源HDAC6 一抗(1:400)和羊源CB 一抗(1:600),4℃环境孵育过夜。第2 天用0.01 M PBS 溶液将组织切片漂洗3 遍后,加入驴抗小鼠Alexa Fluor 488 (1:800)和驴抗羊Alexa Fluor 546 二抗(1:500),避光室温下敷育1.5 h。然后0.01 M PBS溶液充分漂洗,贴片,封片。用激光共聚焦显微镜观察并拍片。
(4)机械缩足反射阈值(mechanical withdrawal threshold, MWT)测定:参照Up-down 法[15]进行测量。将大鼠放置于金属测试架上,并用透明隔板将大鼠隔开。测试前大鼠需适应环境30 min,待大鼠探查等其他活动基本消失后,开始测量。采用von Frey细丝刺激大鼠足底,逐渐加压使细丝弯曲呈90 度,维持刺激时间5 s,若大鼠出现抬足或舔舐足底行为,则记为阳性反应。连续刺激时,测量间隔为5 min。
(5)热缩足反射潜伏期 (thermal withdrawal latency, TWL)测定:按Hargreaves 等[16]的方法进行测量。将待测大鼠放置于测试架上,使其适应环境30 min,待充分适应环境后开始测量。将已开启的热辐射刺激仪对准大鼠左后足,当大鼠突然抬足或舔舐足底时,计时停止。每只大鼠的左后足均进行5 次测量,两次测量间隔为10 min,将测量的数值进行平均值计算。设置热辐射刺激仪测定TWL 的上限时间为25 s,防止烫伤大鼠足底。
4. 统计学分析
采用Graph Pad Prism 7.0 作图并进行统计学分析。所有数据均采用均数±标准差(±SD)表示。行为数据的比较采用双因素方差分析 (two-way repeated measures ANOVA),神经元双标率的比较采用单因素方差分析。以P < 0.05 为差异有统计学意义。
结 果
1. 正常及神经病理性疼痛大鼠触液核HDAC6的表达情况
如图1 所示,红色为CB-HRP 标记的触液核、绿色荧光标记的为HDAC6 阳性神经元、黄色为CB-HRP/HDAC6 双标神经元。与正常组和Sham 组相比,CCI 组大鼠触液核CB-HRP/HDAC6 双标神经元数量明显减少,差异有统计学意义(P < 0.05)。
2. Tubastatin A 拮抗HDAC6 对正常大鼠痛阈的影响
侧脑室注射Tubastatin A 的大鼠,在1 h 后对其进行痛阈的测量,发现与Vehicle 组相比,注射Tubastatin A 的大鼠MWT 和TWL 值明显降低,差异具有统计学意义(P < 0.05);与同组大鼠基础痛阈 (baseline, BL)相比,差异也具有统计学意义(P < 0.05)。24 h 后再次对大鼠进行痛阈测量,发现降低的痛阈基本恢复至正常水平(见图2)。
3. 触液核HDAC6 过表达对大鼠神经病理性疼痛的影响
将大鼠随机分为Sham + CMV-MCS 组、CCI + CMV-MCS 组以及CCI + CMV-HDAC6 组。3 组大鼠分别对应于侧脑室注射HDAC6 过表达病毒及对照病毒。并在病毒表达2 周后对CCI + CMV-MCS组和CCI + CMV-HDAC6 组大鼠进行CCI 造模,于病毒表达3 周,即CCI 术后1 周痛阈最低时,对大鼠进行痛阈测量。结果发现与Sham + CMV-MCS组大鼠相比,CCI + CMV-MCS 组大鼠痛阈明显降低(P < 0.05),而触液核HDAC6 过表达的神经病理性疼痛大鼠疼痛状况得到明显改善(见图3)。
讨 论
本研究利用CCI 模型模拟神经病理性疼痛,通过免疫荧光技术观察到正常大鼠即有HDAC6 的表达,且在神经病理性疼痛状态下,触液核HDAC6表达明显减少。与此一致的是,拮抗触液核HDAC6,CCI 大鼠的痛阈明显降低。以往关于触液核参与神经病理性疼痛的研究中,CCI 模型引起的神经病理性疼痛在术后1 周痛阈达到最低[9,10,12],因此在触液核过表达HADC6 的情况下,选择CCI 术后1 周对大鼠进行行为学检测,结果发现触液核过表达HDAC6 能够改善神经病理性疼痛。
既往关于HDAC6 的研究多集中于其在肿瘤发生发展中的作用,只有少量HDAC6 与神经病理性疼痛相关的研究。Krukowski 和Van 等[6,7]发现通过拮抗HDAC6 能够改善化疗药物诱导的神经病理性疼痛。在Krukowski 和Van 等的实验中,肿瘤化疗药物会破坏神经元的轴突运输和微管动力学,从而导致化疗药物的神经毒性,出现神经病理性疼痛。而α-微管蛋白的乙酰化修饰是调节神经元轴突运输和微管动力学的关键机制之一。与其他HDACs 相比,HDAC6 对包括α-微管蛋白在内的非组蛋白具有特异性,是调节α-微管蛋白乙酰化水平的重要酶[17]。因此通过抑制HDAC6,能够增加外周神经中的α-微管蛋白乙酰化水平[18],从而增加神经元轴突的运输能力,提高微管稳定性,改善化疗药物诱导的神经病理性疼痛。而这与Zerong 等的实验结果相矛盾,Zerong 等[19]发现在HDAC6 表达明显减少、α-微管蛋白高度乙酰化、微管稳定性得到提高的情况下,神经病理性疼痛大鼠疼痛阈值明显降低。这可能是由于两者所涉及的神经病理性疼痛模型不同,不同的动物模型其疼痛特点及所涉及的机制侧重点有所不同[20],Krukowski 和Van 等研究的是化疗药物诱发的神经病理性疼痛,而Zerong 等使用的是坐骨神经分支选择性损伤模型。
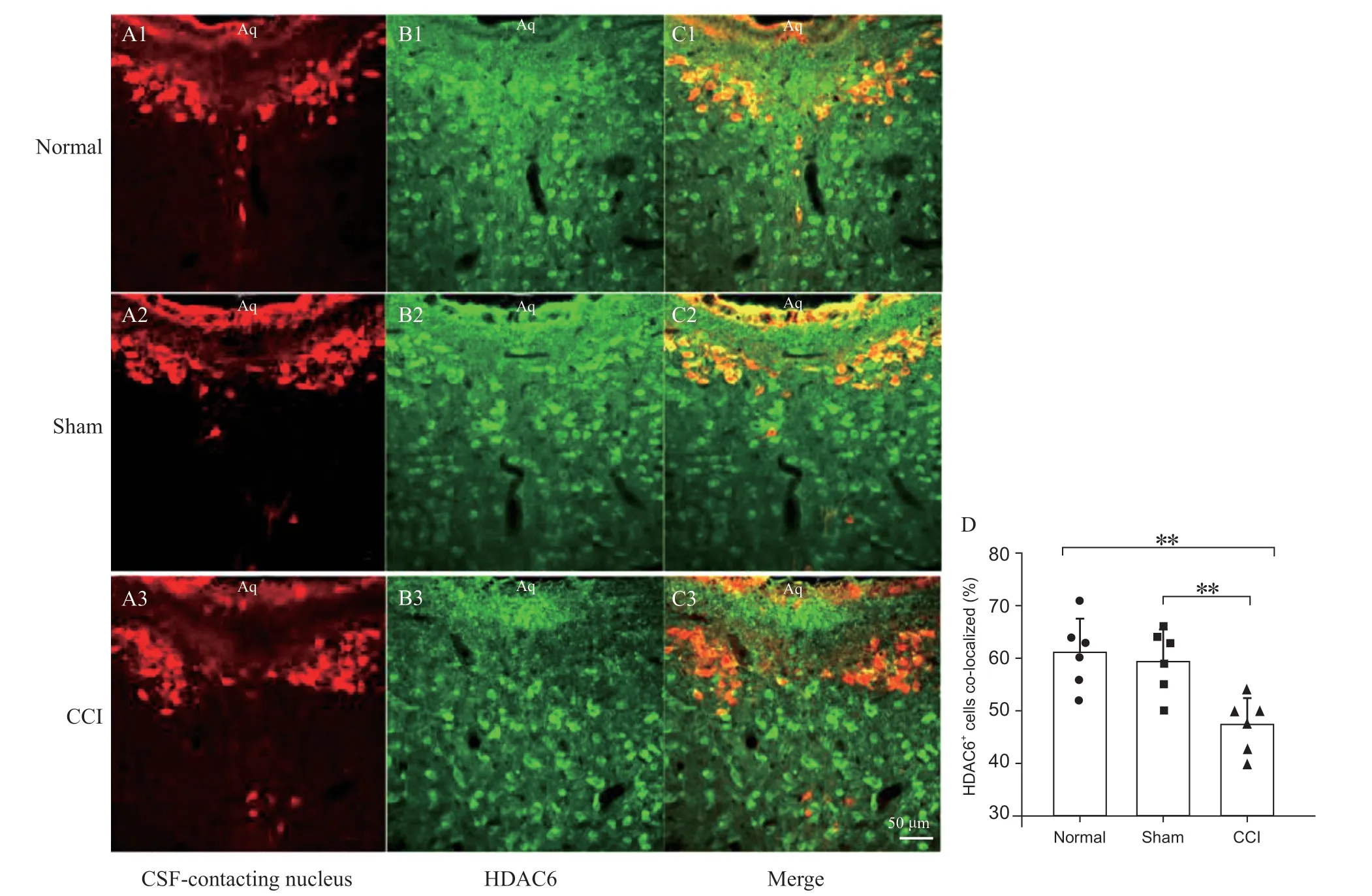
图1 正常大鼠及神经病理性疼痛大鼠触液核HDAC6 的表达(n = 6, ±SD)(A1, A2, A3) CB-HRP 标记的触液核(红色);(B1, B2, B3) HDAC6 阳性神经元(绿色);(C1, C2, C3)两者双标神经元(黄色) 标尺 = 50 μm;(D) 三组大鼠触液核HDAC6 双标阳性率比较**P < 0.01,与CCI 组相比Fig. 1 The expression of HDAC6 in the CSF-contacting nucleus of normal and neuropathic pain rats (n = 6, ±SD)(A1, A2, A3) The CSF-contacting nucleus (red); (B1, B2, B3) HDAC6+cells (green); (C1, C2, C3) double-labeling (yellow). Scale bar = 50 μm; (D) Comparison on the rates of co-staining positive neurons in the CSF-contacting nucleus of three groups of rats.**P < 0.01, compared with the group CCI.
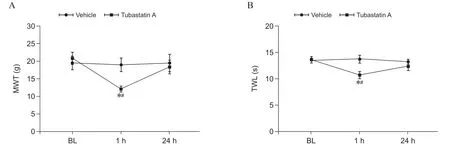
图2 HDAC6 拮抗剂Tubastatin A 对正常大鼠痛阈的影响(n = 6, ±SD)(A) Tubastatin A 对大鼠MWT 的影响;(B) Tubastatin A 对大鼠TWL 的影响*P < 0.05, 与Vehicle 组相比;#P < 0.05, 与Tubastatin A 组BL 时间点相比Fig. 2 Effects of HDAC6 antagonist Tubasatin A on pain threshold in rats (n = 6, ±SD)(A) Effect of Tubastatin A on MWT in rats; (B) Effect of Tubastatin A on TWL in rats. *P < 0.05, compared to the group Vehicle; #P < 0.05, compared to the BL time point of Tubastatin group A.

图3 触液核HDAC6 过表达对大鼠神经病理性疼痛的影响 (n = 6, ±SD)(A1, A2, A3) CB-HRP 标记的触液核(红色);(B1, B2, B3) HDAC6 阳性神经元(绿色);(C1, C2, C3)两者双标神经元(黄色) 标尺 = 100 μm;(D)各组大鼠术前及CCI 术后1 周MWT 比较;(E)各组大鼠术前及CCI 术后1周TWL 比较***P < 0.001, 与Sham + CMV-MCS 组相比;#P < 0.05,##P < 0.01,与CCI + CMV-MCS 组相比Fig. 3 The effect of HDAC6 overexpression in the CSF-contacting nucleus on the neuropathic pain rats (n = 6, ±SD)(A1, A2, A3) The CSF-contacting nucleus (red); (B1, B2, B3) HDAC6+ cells (green); (C1, C2, C3) double-labeling (yellow). Scale bar = 100 μm; (D) Comparison of the MWT of rats in each group before surgery and one week after CCI; (E) Comparison of the TWL of rats in each group before surgery and one week after CCI.***P < 0.001, compared with the group Sham + CMV-MCS;#P < 0.05, ##P < 0.01, compared with the group CCI + CMVMCS.
触液核是一类胞体位于脑实质,而突起跨过室管膜屏障伸向脑脊液中的特殊核团。它不仅与脑脊液有联系,而且与其他非触液神经元、胶质细胞、血管等之间也存在联系。因此,触液核可能在神经、体液两大调节功能中发挥重要作用。通过CBHRP 逆行示踪结合免疫荧光技术,目前已经发现多种神经活性物质在触液核均有表达,且部分参与神经病理性疼痛的调控[9~12,21~23]。本研究通过侧脑室注射CB-HRP 并采用免疫荧光技术观察大鼠触液核中HDAC6 的表达情况,结果发现正常大鼠触液核即有HDAC6 的表达,且在神经病理性疼痛状态下,大鼠触液核中HDAC6 的表达明显减少。这提示触液核HDAC6 可能在神经病理性疼痛中发挥作用,为研究神经病理性疼痛提供了新的分子基础。
综上所述,触液核表达HDAC6,且参与神经病理性疼痛的调控。这为研究神经病理性疼痛机制提供了新的分子基础,为临床治疗神经病理性疼痛提供了新的药物靶点。但考虑到神经病理性疼痛机制的复杂性以及触液核的结构特殊性,因此还需要更进一步的研究。
