CYP2C19*3位点不同基因型重症侵袭性真菌感染患者接受伏立康唑治疗时的血药浓度及疗效对比观察
2020-12-17刘雨高杏薛婷邱小松吕冬梅
刘雨,高杏,薛婷,邱小松,吕冬梅,
1 徐州医科大学,江苏徐州221004;2 徐州医科大学附属医院
伏立康唑在临床上广泛应用于侵袭性真菌感染(Invasive fungal infection,IFI)的治疗,但使用过程中往往伴随诸多不良反应[1-3],且目前关于该药在ICU科室安全使用的临床研究相对较少。目前临床已有许多研究通过检测IFI患者的CYP2C19基因型,分析其对伏立康唑的药代动力学影响,但是他们往往都是将该基因的多个位点进行联合检测分析,在应用到临床实践时提高了检测费用且加重患者经济负担。目前通过检测CYP2C19*3单个位点基因型分析伏立康唑在治疗重症IFI患者中的研究较少。本研究观察了CYP2C19*3位点不同基因型重症IFI患者接受常规剂量伏立康唑治疗时的血药浓度,并进行疗效对比,现报告如下。
1 资料与方法
1.1 临床资料 选择2019年1月~2020年1月在徐州医科大学附属医院ICU接受伏立康唑抗真菌治疗的重症IFI患者70例,男48例、女22例,年龄21~90(64.00±16.21)岁,住院天数8~95(28.20±18.72)d,呼吸系统疾病52例、其他18例。纳入标准:①临床诊断为IFI的ICU患者[4];②入选的患者都按照疗程使用伏立康唑;③年龄>18岁。排除标准:①中重度肾功能损害;②重度肝功能异常;③禁忌使用该药者;④其他对使用该药造成影响的药物。研究获得医院伦理委员会批准,伦理审查批件号:XYFY2019-KL044-01。
1.2 伏立康唑给予方法及血样采集 伏立康唑治疗方案:成人负荷剂量定为400 mg,q12 h;维持剂量为200 mg,q12 h。鼻饲给药53例、静脉滴注12例、口服给药5例,同时使用其他药物24例。患者用药第3天清晨用药前采集肘静脉血,存放在乙二胺四乙酸抗凝管中。
1.3 CYP2C19*3位点基因型检测及分组 取200 μL抗凝全血,根据DNA提取试剂盒操作步骤提取DNA,按照PCR扩增试剂盒操作步骤进行扩增。扩增引物由上海生工公司设计,CYP2C19*3正向引物为5′-GTCTCTCACGCCAGCTTTGG-3′,反向引物为5′-CCCAAGGCAGGTTGCTAGGA-3′。PCR扩增条件为:94 ℃预变性5 min,59 ℃退火30 s,72 ℃延伸30 s,30个循环,最后72 ℃延伸5 min。扩增引物经电泳试验验证有目标片段生成后,送上海生工公司进行Sanger基因测序。依据测序结果,将患者分为GG组、GA组、AA组。
1.4 伏立康唑血药浓度检测 取5 μL抗凝全血,使用药学实验室超高效液相色谱仪及Xevo TQS三重四级杆串联质谱仪检测患者伏立康唑血药浓度,具体操作步骤参考相关文献[5,6]。结合以往临床研究结果,本研究中伏立康唑有效治疗浓度定为1.5~5.5 mg/L[7]。
1.5 伏立康唑治疗有效率、不良反应发生率测算 70例患者均在常规剂量下使用伏立康唑治疗1周及以上,然后评估治疗效果和不良反应[8-10],计算治疗有效率、不良反应发生率。治疗有效率=症状显著改善病例数/总病例数×100%,不良反应发生率=肝功能异常、皮疹、幻视及神经障碍等不良反应病例数/总病例数×100%。
2 结果
2.1 CYP2C19*3位点基因型检测结果 70例患者中,CYP2C19*3位点GG型60例、GA型10例,未检测到AA基因型,见图1。

注:A为1例GG型患者的检测结果,B为1例GA型患者的检测结果。
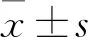
2.2 CYP2C19*3位点不同基因型患者伏立康唑血药浓度比较 70例患者的伏立康唑血药浓度为0.13~12.32 mg/L,平均值为(3.89±2.85)mg/L。其中GG组患者伏立康唑血药浓度为(3.58±2.84)mg/L,GA组患者伏立康唑血药浓度为(5.80±2.16)mg/L,两组相比,P<0.05,表明患者伏立康唑血药浓度受基因型影响。
2.3 CYP2C19*3位点不同基因型患者伏立康唑治疗效果和不良反应比较 70例患者中治疗后症状显著改善者42例,出现肝功能异常等不良反应者20例,其中GG组患者伏立康唑治疗有效率为55.00%(33/60),不良反应发生率为26.67%(16/60);GA组患者伏立康唑治疗有效率为90.00%(9/10),不良反应发生率为40.00%(4/10);两组伏立康唑治疗有效率相比,P<0.05;两组不良反应发生率相比,P>0.05。
3 讨论
将临床疗效最大化和将药物不良反应发生率降到最小化一直是临床药物治疗过程中医生和药师最为关注的重点,对于在ICU病情凶险危急的患者来说更为重要。伏立康唑作为一种三唑类抗真菌药物,如果在临床使用不合理会导致耐药菌产生,将给后续治疗增加难度,同时也加重了患者的心理负担和经济压力。
传统的伏立康唑药物治疗模式即经验治疗:医生对患者病情做出诊断后,按照先前大量临床实践的结果,给予固定剂量伏立康唑,但是由于患者个体之间的差异性,并不能完全保证药物疗效和安全性,往往会出现治疗没效果及一系列不良反应。近年来得到快速发展的个体化用药模式,刚好可以弥补上述不足,患者病情得到诊断后,对患者进行遗传分析,综合之前临床经验和患者相关基因的基因型,制定给药方案,而个体化用药的核心手段就是检测基因多态性。
基因多态性影响了药物在体内代谢所需要的代谢酶、转运体和靶点等的正常功能,从而使患者对药物产生了个体差异。CYP2C19基因是近年来被广泛研究的一个药物代谢酶相关基因,以往临床研究分析中,通过对该基因多个位点的基因多态性进行联合分析发现,CYP2C19基因的多态性与伏立康唑血药浓度及疗效和安全性之间存在相关性。本研究重点关注了CYP2C19基因的一个位点CYP2C19*3,研究结果显示,单个位点的基因多态性与伏立康唑血药浓度之间也具有明显的相关性。对于ICU患者来说,病情危重,情况紧急,检测一个基因位点节省了基因检测的时间,提高临床治疗效率,还可以减轻患者经济负担,使基因检测得以普及使用。
分析本次研究结果中单基因位点的基因型与伏立康唑血药浓度的关系,可以发现GG基因型与GA基因型患者伏立康唑血药浓度的差异是有统计学意义的。而在许多同时分析CYP2C19多个位点基因型对伏立康唑血药浓度影响的研究[11]中,在包括CYP2C19*3GA基因型的中间代谢组合和包括CYP2C19*3GG基因型的快代谢型两组患者之间的血药浓度差异也有统计学意义,检测多位点意义和单位点接近,故选择单位点检测更加合适。
由于本次研究对象均来自ICU,且年龄多为65岁以上的中老年患者,属于一类特殊群体。与其他临床科室中同样有IFI且使用伏立康唑治疗的患者比较,可以发现本研究中的患者总体治疗有效率(60.0%)低于普通科室IFI患者的有效治愈率(75%)[12-17],而肝功能异常等不良反应发生率(28.6%)却明显高于普通科室该类患者患者的不良反应发生率(18.7%)[18-22],这表明伏立康唑血药浓度除受基因多态性的影响,还受其他非遗传因素的影响。我们分析认为,首先,ICU患者病情危重,并发症多,免疫功能低下且多数意识不清晰,临床往往需要多种治疗手段和药物的介入,药物之间相互作用一定程度上影响了伏立康唑治疗效果;其次,患者自身由于疾病原因,肝肾功能退化或者患者营养不良吸收障碍,血浆白蛋白降低,伏立康唑游离型浓度升高,那么当高于5.5 mg/L时,则会可能会出现不良反应[23-26]。故对于ICU患者,在治疗IFI的时候,在确定患者CYP2C19*3位点基因型的基础上,还需要结合患者具体情况调节初步的伏立康唑给药剂量。对于年轻且仅因为车祸或者其他人为事故等外伤所致入院的IFI患者来说,若基因型为GG型,则可以按照以往经验用药,若为GA型则可适量调低剂量同时进行血药浓度检测;对于年老多病患者则不论是GG型还是GA型均建议将伏立康唑的初始剂量调低,确保用药的安全性和有效性。
由于本研究纳入病例数有限且属于回顾性研究分析,数据统计得出结论可能会有误差,后期需要扩大样本量针对单个位点基因进行研究,或者通过多中心和前瞻性研究,以使结论更具参考性。
综上所述,通过分析患者CYP2C19*3基因型结合血药浓度监测,表明CYP2C19*3基因多态性对伏立康唑血药浓度及治疗效果有明确影响,CYP2C19*3位点GA基因型重症IFI患者的伏立康唑血药浓度、治疗有效率均高于GG型重症IFI患者。治疗IFI患者时,医生可以在患者自身病理生理状态基础上参考CYP2C19*3基因型初步确定伏立康唑给药剂量,同时定期监测血药浓度,实现伏立康唑抗真菌感染治疗的精准化和个体化。
