苦菜愈伤组织诱导的初步研究
2020-12-15李闯楚海娇刘磊谭化王洋王凤张海王忠伟
李闯 楚海娇 刘磊 谭化 王洋 王凤 张海 王忠伟


摘 要:以苦菜幼嫩叶片和叶柄作为外植体,采用3种诱导培养基、添加不同2,4-D浓度及碳源进行苦菜愈伤组织诱导。结果表明:3种培养基的诱导效果为MS>N6>B5;以幼嫩叶片为外植体、蔗糖作为碳源、2.0mg·L-16-BA加0.2mg·L-12,4-D的激素配比最有利于苦菜愈伤组织的诱導。
关键词:愈伤组织;诱导条件;外植体
中图分类号:S-3
文献标识码:A
DOI:10.19754/j.nyyjs.20201115001
收稿日期:2020-10-15
基金项目:吉林省科学技术厅项目(项目编号:20200702017NC)
作者简介:李闯(1984-),男,助理研究员。研究方向:马铃薯的育种和栽培;通讯作者王忠伟,男,研究员。研究方向:马铃薯的育种和栽培。
苦菜[Ixeris Chinensis(Thunb.) Nakai]又称苦苣菜,是一种药食同源的无毒野生植物[1]。苦菜幼苗富含蛋白质、糖类、维生素、氨基酸等多种营养成分,具有很高的食用价值[2]。同时其药用价值也不容忽视,很多古典文献上都出现了以苦菜为中药成分的记载。研究表明,苦菜不仅具有杀菌消炎、防止贫血、清热解毒等作用[3],同时对葡萄球菌、大肠杆菌等多种细菌有抑制作用[4]。为了使得苦菜的药用价值不断提升,有关苦菜生物活性物质的研究报道越来越多,而对苦菜的组织培养研究报道较少。组织培养属于无性生殖的范畴,该技术对于培育新品种、快速繁殖、遗传转化、种质资源保护和相关药品开发等方面具有非常重要的意义[5]。愈伤组织的诱导是组织培养的起始阶段,能否得到生长旺盛和易于分化的愈伤组织是试验成功的关键[6]。培养基在细胞生长过程中起决定性作用,其会影响苦菜愈伤组织诱导、分化及生根等一系列过程。本试验分别采用苦菜叶片和叶柄作为外植体,在3种诱导培养基中诱导愈伤组织,同时探讨不同2,4-D浓度和碳源的影响,以期获得苦菜愈伤组织的最佳诱导条件,旨在为苦菜的快速繁殖提供有效途径,同时为苦菜遗传转化和细胞工程研究创造有利条件[7]。
1 材料与方法
1.1 试验材料
野生苦菜,采于吉林农业科技学院校园。
1.2 诱导培养基
MS培养基、N6培养基、B5培养基。
1.3 试验方法
1.3.1 材料灭菌
选取叶片和叶柄分别放入500mL烧杯中,用自来水洗涤4次,每次约1min。分别用0.1%的HgCl2和70%的酒精浸泡消毒,无菌水冲洗[8,9]。
1.3.2 愈伤组织诱导条件的筛选
1.3.2.1 培养基的筛选
配制MS、N6和B5 3种诱导培养基进行试验。在此过程中,不定芽较易萌发,影响愈伤组织的生长,用镊子将芽夹去,可以提高愈伤诱导率。
1.3.2.2 外植体的筛选
将消毒后的嫩叶切成1cm2大小的方块,叶柄为1cm左右的小段,接种到诱导培养基上,观察愈伤组织诱导情况。
1.3.2.3 2,4-D浓度的筛选
配制2,4-D浓度分别为0.00mg·L-1、0.05mg·L-1、0.10mg·L-1、0.20mg·L-1、0.50mg·L-1的MS培养基进行试验。
1.3.2.4 碳源的筛选
配制不含碳源和含有相同浓度蔗糖、葡萄糖及麦芽糖的MS诱导培养基进行试验,观察愈伤组织诱导情况。
1.3.3 诱导率的计算
诱导率=愈伤组织数/接种外植体总数×100%
2 结果与讨论
2.1 培养基的筛选
诱导培养基中包含大量元素、微量元素、有机元素、生长激素及碳源等[10],其植物生长提供所需的各种营养成分。本试验中MS、N6、B5 3种培养基对苦菜愈伤组织的诱导产生了不同效果。接种14d左右时发现,在MS培养基中的叶片卷曲,切口处有突起,开始出现初始愈伤。继续培养28d左右发现,N6和B5培养基中的叶片表面也开始有初始愈伤出现;而此时以叶柄为外植体的3种培养基中也均诱导出初始愈伤。继续培养直至所有愈伤组织状态稳定后,统计结果见表1。
由表1可以看出,在MS培养基中,叶片和叶柄的愈伤组织诱导率均最高,其原因可能为MS培养基中氮、钾等无机盐浓度较高,能促进愈伤组织的快速形成[11];叶片在N6培养基中的诱导率也较高,但形成愈伤组织所需的时间较长;而在B5培养基中的出愈率仅为12%,且长时间诱导叶片绝大部分褐化。以叶柄为外植体,在N6和B5培养基中的出愈率均较低。因此认为,3种培养基的诱导效果为MS>N6>B5。在进行植物组织培养时,经常出现褐化现象,有试验表明酚类物质的含量增加时,褐化率也随之增大,成活率随之减小[12]。本试验中由于外植体切块太小、所用培养基不适宜而造成了部分褐化现象。
2.2 外植体的筛选
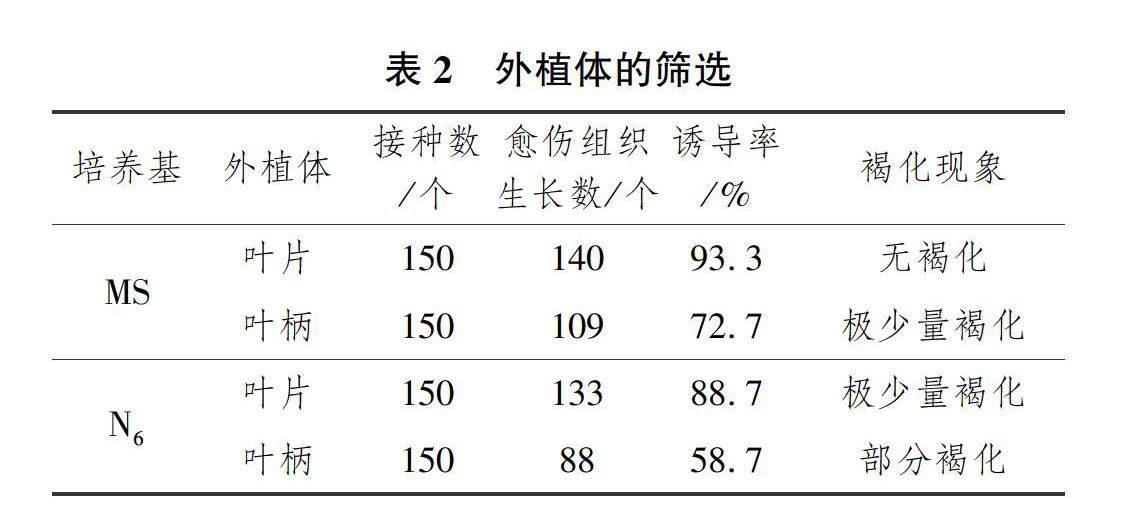
试验分别选取苦菜叶片和叶柄作为外植体。接种14d左右时发现,在MS培养基中的叶片卷曲,切口处有突起,开始出现初始愈伤。继续培养28d左右发现,以叶柄为外植体的3种培养基中也均诱导出初始愈伤。继续培养直至所有愈伤组织状态稳定后,此时可进行结果统计(见表2)。
由表2可以看出,MS培养基中的叶片诱导率高于叶柄,但二者相比较,叶柄生长速度较慢,往往需要较长时间才能形成可见的初始愈伤,同时褐化现象也较严重;在N6培养基中,叶片的诱导率也较高,因此认为叶片更适合作为苦菜愈伤组织诱导的外植体。进行植物愈伤组织诱导时,应尽量选择易于增殖和再生,具有良好遗传稳定性的外植体。
2.3 2,4-D浓度的筛选
2,4-D浓度是影响植物愈伤组织诱导率的一个重要激素[13]。6-BA和2,4-D在愈伤组织形成的不同时期具有明显促进作用,6-BA与植株再生有关,2,4-D与愈伤组织的生长状态有关,是愈伤组织生长的关键[14]。本试验在愈伤组织诱导阶段采用6-BA和2,4-D 2种激素,固定6-BA的浓度为2.0mg·L-1,选取5种浓度的2,4-D进行愈伤组织诱导,统计结果见表3。
由表3可以看出,2,4-D浓度为0.2mg·L-1时,苦菜愈伤组织的诱导率最高,且愈伤组织状态良好,大部分呈黄绿色,结构松软;当2,4-D浓度>0.2mg·L-1时,诱导率随2,4-D浓度的增大而减小,诱导形成的愈伤组织大部分为浅绿色,结构较为致密,生长速度较慢,并且出现严重褐化,表明高浓度的2,4-D不利于愈伤组织的诱导和生长,同时加快外植体的褐化;当2,4-D浓度<0.2mg·L-1时,诱导率随2,4-D浓度的减小而减小;当2,4-D浓度=0时,愈伤组织全部死亡。
2.4 碳源的筛选
细胞的生长不仅需要能量,还需要调节生长环境中的渗透压,糖作为碳源能够满足这些需求,因此培养基中的碳源是培养过程中的关键因素[15]。本试验分别在培养基中加入浓度为30g·L-1 3种碳源进行苦菜愈伤诱导研究,结果表明,培养14d后,含有蔗糖的培养基中的苦菜叶片表面形成初始愈伤,其它培养基中的叶片无明显变化;培养21d左右,添加葡萄糖的培养基中的叶片表面也开始形成愈伤,统计结果见表4。
结果显示,不加碳源的培养基中无愈伤组织形成,说明碳源是苦菜叶片愈伤组织形成的必要元素。分别添加不同碳源的3种培养基中均有愈伤组织形成,但诱导率和诱导效果存在很大差别。添加蔗糖的培养基中的出愈率高达到96%,且愈伤组织呈黄绿色,结构松软,生长状态良好;添加葡萄糖的培养基中的出愈率不足50%,且呈现浅绿色,结构较为致密,生长情况较差;麦芽糖的诱导效果最差,几乎没有完整的愈伤组织形成,只有少量叶片的切口处出现点状突起。由此可见,蔗糖为苦菜愈伤组织诱导的最适碳源。
2.5 愈伤组织的继代培养
固定2,4-D浓度为0.1mg·L-1,分别配制MS、N6和B53种培养基进行继代试验。结果发现,在N6和B5培养基上,随着培养时间的增加苦菜叶片愈伤组织的存活数减少,直到最后全部褐化死亡,其中B5褐化的速度最快,因此这2种培养基不适合继代培养;而接种到MS培养基上的大部分生长良好,能保持良好的生长状态,并成功分化出苗。
3 结论
本试验采用不同培养基、外植体、2,4-D浓度和碳源种类对苦菜愈伤组织进行初步诱导研究。得出以下结论:以苦菜叶片和叶柄做外植体,3种诱导培养基的诱导效果均为MS>N6>B5;同时苦菜的2种外植体均能诱导形成愈伤组织,但叶片的诱導率要高于叶柄,且愈伤组织生长状态较好,诱导时间较短,所以苦菜叶片较适合作为苦菜愈伤诱导的外植体。试验表明,2,4-D浓度为0.2mg·L-1时适合苦菜叶片愈伤组织的诱导;3种碳源的诱导效果比较发现,蔗糖>葡萄糖>麦芽糖,因此蔗糖可作为理想碳源;继代培养时,愈伤组织在MS培养基中的生长状况良好且培养后愈伤组织活性很高,能够继续进行分化培养,同时在继代培养时应适当降低2,4-D浓度。
本试验仅对影响苦菜愈伤组织诱导的条件进行优化,为建立完善的苦菜组织培养体系,其继代、分化及生根培养的影响因素,还有待于进一步研究。
参考文献
[1] 王储炎,代君君,吴伟.苦菜的药理作用及产品开发[J].农业工程技术(农产品加工业),2008(02):36-38.
[2]田芳.苦菜的功能成分及产品开发[J].中国食物与营养,2009(03):30-31.
[3]刘畅,严铭铭,邵帅,等.山苦菜化学成分及药理作用的研究进展[J].中国试验方剂学杂志,2015(20):231-234.
[4]傅聿成,王妮娅.苦菜的开发与利用[J].食品研究与开发,2003(06):90-92.
[5]张淑红.植物组织培养及其发展方向[J].垦殖与稻作,2003(06):43-45.
[6]张红艳,李冠,李仁敬.彩色棉再生体系影响因子及抗病基因NP-1转化的研究[J].新疆大学学报,2004(02):94-98.
[7]刘勇,王良群.组织培养在高粱中的应用研究进展[J].安徽农业科学,2015(10):31-33.
[8]张卓.山苦菜无性系建立的研究[J].河南大学学报(自然科学版),2012(02):187-191.
[9]于颖,何漫,吴冰冰.苦苣菜再生体系建立研究[J].中国园艺文摘,2009(11):20-22.
[10]陈静.酚酸类物质与牡丹试管苗生根关系的研究[D].郑州:河南农业大学,2012.
[11]黄晖.细叶野牡丹再生与快繁体系建立研究[D].福州:福建农林大学,2012.
[12]张朝军,李付广,王玉芬.降低棉花胚性愈伤褐化研究[J].棉花学报,2005(05):285-288.
[13]安惠惠,马晖玲,白生军,等.2,4-D对匍匐翦股颖不同品种愈伤组织诱导和分化的影响[J].草原与草坪,2012(02):15-19.
[14]关淑艳,赵丽娜,王丕武,等.玉米自交系GS01愈伤组织的诱导及植株再生[J].玉米科学,2011(02):29-33.
[15]丁世萍,严菊强.糖类在植物组织培养中的效应[J].植物学通报,1998(06):43-47.
(责任编辑 李媛媛)
