下调miRNA-221对肝癌生物学行为的影响*
2020-12-12韩双喜王介营王玉虎王海南李传光成良栋
韩双喜 王 丽 王介营 王玉虎 王海南 李传光 徐 萌 成良栋
山东省滨州市中心医院肝胆外科,山东省惠民县 251700
miRNA是一类短序列、非编码、具有调控功能的单链RNA,长度20~23个核苷酸[1]。与正常组织来源细胞中的miRNA相比,大多数肿瘤组织中miRNA存在明显的表达差异,包括表达的上调和下调,因此,miRNA在肿瘤发生发展过程中起重要的调节作用[2]。有研究发现, miRNA-221在原发性肝癌中呈高表达[3],但其对肝癌调控作用尚不明确。本研究通过下调miRNA-221的表达,研究其对肝癌HepG2细胞增殖、凋亡、侵袭的影响。
1 材料与方法
1.1 材料 肝癌细胞株HepG2受赠于滨州医学院;干扰序列、pHelper 1.0、pHelper2.0、引物和pGCSIL-GFP等由上海吉凯基因化学技术公司合成;限制性内切酶(NEB公司);Lipofectamine 2000(Invitrogen公司)。
1.2 方法
1.2.1 构建慢病毒载体:首先依据能有效干扰人miRNA-221基因表达的靶序列制成双链DNA。然后其与pGCsil-GFP载体连接并转化。再通过PCR法筛选出阳性克隆,提取出质粒,然后再进行酶切并测序。再将pHelper1.0、pHelper2.0和重组慢病毒质粒共转染293T细胞,获得仅携带绿色荧光蛋白基因的重组慢病毒NC-GFP-LV,以及携带下调miRNA-221基因表达的重组慢病毒miRNA-221-RNAi-LV。采用逐孔稀释法测定病毒的滴度。
1.2.2 测定病毒感染效率及HepG2细胞分组、转染:采用0~20不同感染梯度的病毒感染HepG2细胞,病毒在无血清培养基中感染HepG2细胞2h后,加入10%牛血清的培养基,培养3d后,流式细胞仪检测GFP的阳性表达率,确定感染效率。将HepG2细胞分为3组:(1)实验组(miRNA-221-siRNA,SI组),即转染携带下调miRNA-221基因表达的重组慢病毒。(2)阴性对照组(negative control,NC组),即进行转染但未携带慢病毒。(3)正常组(normal,N组)。
1.2.3 RT-PCR检测:转染72h后开始收集HepG2细胞, miRNA-221的目的基因PTEN的表达情况通过RT-PCR检测,通过PTEN的表达情况来判断干扰效果;同时检测促凋亡基因Caspase 3的表达情况。β-actin上游引物:5-CCCAGCACAATGAAGATCAAGATCAT-3,下游引物5-ATCTGCTGGAAGGTGGACAGCGA-3,扩增条带为101bp;PTEN的上游引物为:5-CGGCAGCATCAAATGTTTCAG-3,PTEN的下游引物为:5-AACTGGCAG GTAGAAGGCAACTC-3,扩增条带为235bp;Caspase 3的上游引物:5-GTGGTACAGAACTGGACTGTGGC-3,下游引物:5-GTTGCCACCTTTCGGTTAACCCG-3,扩增条带为244bp。PTEN/β-actin和Caspase 3/β-actin吸光度比值分别表示PTEN mRNA和Caspase 3 mRNA的相对表达水平。
1.2.4 MTT比色法测定吸光度:将细胞每孔3×103个接种于96孔板中,每组接种10孔,置于37℃、5%CO2培养箱中进行细胞培养,细胞贴壁后进行慢病毒的转染,分别于24h、48h、72h、96h向每孔加入MTT 20μl(0.5mg/ml),37℃孵育4h,然后丢弃MTT液,再加入150μl的DMSO,然后混合均匀,应用酶联免疫检测仪测定各孔490nm光吸收值,重复检测3次。比较各组HepG2细胞的生长情况。
1.2.5 transwell体外迁移实验:选用孔径为8μm的24孔Borden小室,上室加入1×105个细胞,总体积200μl,下室加入300μl含血清培养基,每组各设3个复孔。48h后取出小室,甲醇固定并Giemsa染色10min,去除上层小室侧的未迁移细胞,观察到达迁移杯底下面的细胞。显微镜下随机选取5个视野进行拍摄(×100倍),计算每个视野的平均细胞数量。
1.2.6 Hochest33258荧光染色法检测细胞凋亡:首先将培养的细胞制成单细胞片, 然后应用4%多聚甲醛在室温下固定10min,再用PBS液洗涤2次,加入Hoechst33258均匀覆盖单细胞片,染色15min,再用PBS液清洗单细胞片3次,封片后在荧光显微镜下观察。正常细胞核呈弥散均匀荧光,凋亡细胞的细胞核则表现为浓染致密或断裂的颗粒块状荧光。随机于100倍荧光显微镜下照相。
1.2.7 荷瘤裸鼠动物模型的建立:将裸鼠随机分为实验组(SI组)、阴性对照组(NC组),每组5只,HepG2细胞悬液200μl于每只裸鼠背部皮下注射。采用瘤体内多点注射的方法,定时分组分别注射miRNA-221-RNAi-LV和空病毒NC-GFP-LV。每隔3d注射1次,每次病毒量为2×107个/只,共注射6次。之后每天观察肿瘤生长情况,每隔3d测量肿瘤的长、短径,计算肿瘤的体积。肿瘤体积=1/2×长径×短径2。绘制移植瘤生长曲线。于最后1次注射药物后3d颈椎脱臼法处死裸鼠,切取肿瘤组织标本。

2 结果
2.1 miRNA-221-RNAi-LV的构建及病毒滴度测定 miRNA-221基因干扰的重组细菌PCR扩增产物为270bp,鉴定结果与预期一致,测序结果表明,合成的miRNA-221的siRNA核苷酸序列插入正确,没有碱基缺失或替换。病毒滴度:miRNA-221-siRNA-LV和NC-GFP-LV均为2×109TU/ml。
2.2 病毒感染效率及干扰情况 采用(MOI=0~20)不同梯度的病毒感染HepG2细胞,并进行流式细胞仪分析。结果显示,MOI=0~20的不同感染梯度对HepG2细胞感染效率分别为0.38%(MOI=0)、22.37%(MOI=5)、73.06%(MOI=15)及95.10% (MOI=20),MOI=20的感染滴度对HepG2细胞感染效率较高(95.10%),见图1。转染72h后,PTEN的mRNA表达水平N组(0.034±0.001)、NC组(0.037±0.003)与SI组(0.123±0.005)相比较,SI组miRNA-221的靶基因PTEN表达增强,差异具有统计学意义(P<0.05),见图2。

图1 流式细胞检测GFP的表达率
2.3 MTT比色法测定miRNA-221-RNAi-LV对HepG2细胞增殖的影响 转染后24h,检测SI组的吸光度值开始下降,表明SI组的HepG2细胞增殖减弱,在之后的各个时间点,均表现为吸光度值降低。

图2 PTEN mRNA表达的灰度值
在96h NC组(1.070±0.020)和N组细胞(1.070±0.015)与SI组(1.030±0.023)相比,差异具有统计学意义(P<0.05)。这个结果表明下调miRNA-221的表达可以抑制HepG2细胞的增殖能力。
2.4 transwell体外迁移实验 经transwell小室培养模型培养后,对三组的穿膜细胞分别进行计数,NC组的迁移细胞数(43±4)、N组的迁移细胞数(45±4.1)和SI组的迁移细胞数(31±5.5)比较,差异有统计学意义(P<0.05),而NC和N组比较,差异无统计学意义(P>0.05),见表1。
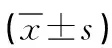
表1 miRNA-221-RNAi-LV对HepG2细胞增殖的影响
2.5 下调miRNA-221的表达对HepG2细胞凋亡的影响 荧光染色后,于荧光显微镜下观察细胞形态变化,凋亡的HepG2细胞发生核固缩,表现为浓染致密的颗粒块状荧光。SI组HepG2细胞增殖减弱,凋亡增加,荧光显微镜下观察可见较多的颗粒状荧光,这表明下调miRNA-221可以促进HepG2细胞的凋亡。
2.6 RT-PCR检测促凋亡基因Caspase 3变化 实验结果显示促凋亡基因Caspase 3的mRNA表达水平分别为N组(0.027±0.004)、NC组(0.029±0.003)和SI组(0.072±0.001),三组相比较,SI组的Caspase 3表达增强,差异具有统计学意义(P<0.05),见图3。
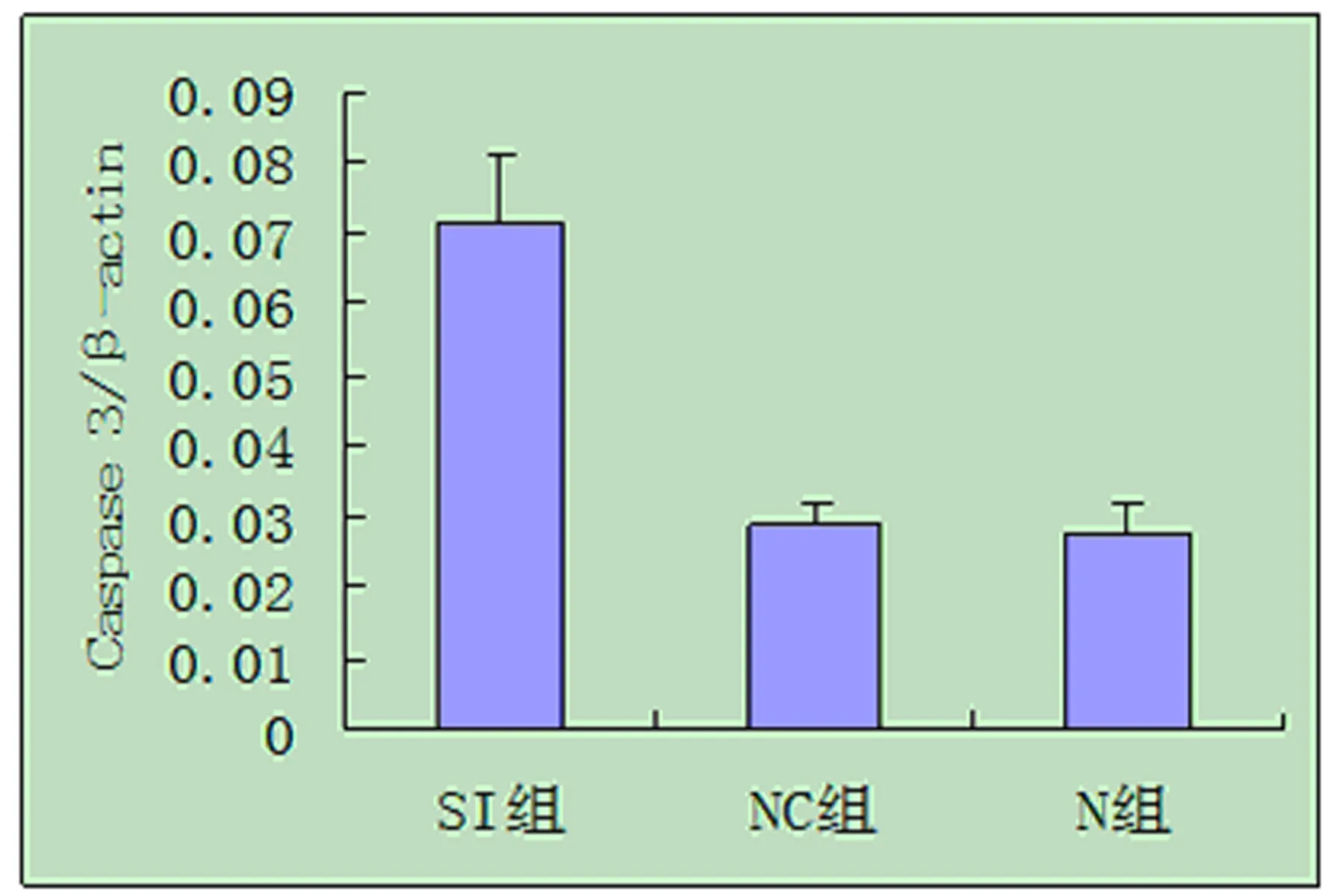
图3 Caspase 3 mRNA表达的灰度值
2.7 miRNA-221-RNAi-LV对裸鼠移植瘤的抑制作用 通过肿瘤长短径计算移植瘤体积,移植瘤的生长曲线如图4所示,在注射HepG2细胞悬液3d后,SI组的移植瘤开始出现生长抑制表现,与NC组相比生长速度变慢,差异具有统计学意义(P=0.032 0,P<0.05)。

图4 裸鼠移植瘤的生长曲线
3 讨论
miRNAs通过与靶基因3’UTR结合,调控靶基因表达[4],这是最近研究的热点问题。目前在人类已发现700 多种miRNAs,这些miRNAs可以影响正常细胞或肿瘤细胞的生长、增殖、分化、凋亡等一系列病理生理过程[5-6]。但大多数miRNAs 在肿瘤发生发展过程中的作用机制尚未完全阐明。在肿瘤中过表达的miRNAs被认为是癌基因,但是目前的研究也发现部分miRNAs在肿瘤中表达是下调的,如果其功能缺失或减弱就有导致正常的细胞发生恶变之可能,这类miRNAs被认为是抑癌基因。在某些肿瘤中,某些miRNAs的表达出现异常,多项研究发现,miRNA-221在肿瘤组织中异常表达,其中在甲状腺乳头状癌[7]、胃癌[8]、乳腺癌[9-12]、肝细胞癌[13-14]、神经胶质瘤、胰腺癌、结直肠癌[15-16]等多种肿瘤中存在过表达,而在前列腺癌和胃肠道间质瘤[17]等多种肿瘤组织中存在低表达。此外, miRNA-221在乳头状甲状腺癌、结直肠癌、肝癌、肾细胞癌等肿瘤患者的血清或血浆中过表达。本实验结果显示,将miRNA-221-RNAi-LV转染HepG2细胞而导致PTEN基因表达上调,说明miRNA-221-RNAi-LV发挥下调miRNA-221作用显著。下调HepG2细胞的miRNA-221后,通过调节PTEN等信号通路而使HepG2细胞生长受到抑制、迁移能力减弱。miRNA-221的表达下调后肝癌HepG2细胞的凋亡增加,同时检测到Caspase 3的表达上调,这表明miRNA-221表达下调后促进Caspase 3的过表达是miRNA-221促进肝癌细胞凋亡的可能机制。这也提示miRNA-221在肝癌的发生发展过程中可能起癌基因的作用。
不同的研究对肝癌细胞的凋亡与miRNA-22l之间潜在关系有不同的研究结果。Dai等[18]的研究发现由内质网应激导致的细胞凋亡过程中,miRNA-22l模拟物促进肝癌细胞的凋亡,而miRNA-221阻遏物的作用恰恰相反。但Gramantieri等[19]则发现敲低miRNA-22l后,可以促进肝癌细胞SNU449的凋亡,同时该研究也发现与凋亡相关的Bmf也是miRNA-22l的分子靶标,这也表明通过影响蛋白的表达而抑制细胞的凋亡,这可能是miRNA-22l作用机制之一。
Pineau等的研究将MSCV-miRNA-221转染入小鼠肝祖细胞中,建立肝癌小鼠模型。其研究结果显示,与对照组相比,肿瘤发生发展的速度明显增快,这个研究结果也表明miRNA-221可促进肿瘤的发生、发展[20]。本文研究结果表明,miRNA-221表达下调后HepG2细胞的凋亡增加。有研究证实,miRNA-221可以活化AKT,其机制是miRNA-221与 PTEN基因的3’UTR区结合,进而调节PTEN的表达,使其表达下调,从而有效激活AKT[21],其有效激活后可以促进肿瘤细胞的生长、增殖、侵袭转移等。AKT与PTEN作为体内多个信号通路的关键因子, miRNA-221促进肝癌细胞增殖、侵袭转移的可能机制就是激活PTEN/AKT信号通路。
有研究发现miRNA-221的过表达可以影响肿瘤细胞对替莫唑胺、顺铂等化疗药物的敏感性,从而影响化疗效果。本研究中裸鼠移植瘤治疗组与对照组的生长情况存在统计学差异,但在临床实践中,因为体内复杂的肿瘤微环境,单一的基因治疗不一定能取得良好疗效,所以下调miRNA-221的表达并联合化疗药物或靶向药物治疗肝细胞肝癌,可能会取得更为有效的临床效果。
综上所述,miRNA-221-siRNA通过抑制miRNA-221的表达抑制肝癌HepG2细胞的增殖,促进其凋亡,降低其迁移能力。由于miRNA-22l在肝细胞癌中的过表达及与细胞增殖和凋亡密切关系,miRNA-221可以作为肝细胞癌基因治疗的新靶点,下调miRNA-221的表达并联合化疗药物或靶向药物治疗肝细胞癌,可能会取得更为有效的临床效果。
