铜与浓硫酸反应实验异常现象的探究及装置的新设计
2020-12-07王春
王春
摘要: 针对铜与浓硫酸反应过程中产生灰黑色沉淀及溶液呈现墨绿色等异常现象,结合实验方案的设计与探究分析产生该异常现象的原因是反应体系中含有Cu2O、 CuS、 Cu2S、单质S以及CuCl2-4等物质。对人教版新版教材中关于铜与浓硫酸反应的实验装置的优点和不足进行分析,从增强实验的演示效果、严谨性、综合性及可操作性等方面进行改进设计,取得良好的教学效果。
关键词: 铜与浓硫酸; 异常现象; 实验探究; 实验改进
文章编号: 1005-6629(2020)11-0076-04
中图分类号: G633.8
文献标识码: B
1 问题的提出
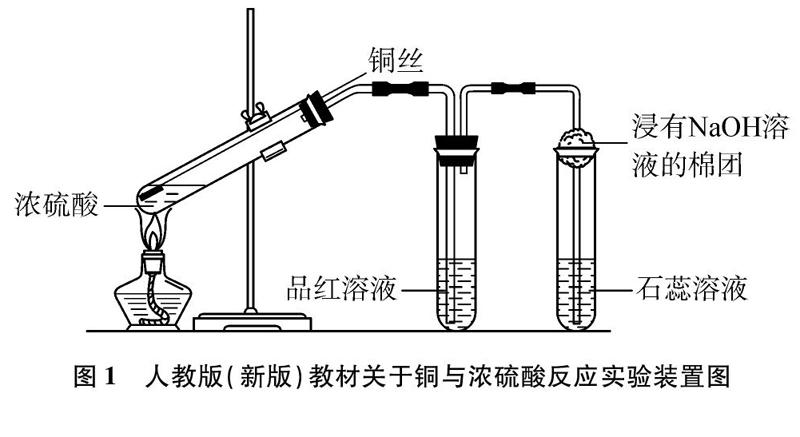
在研究浓H2SO4的化学性质时,Cu与浓H2SO4的反应是用来说明浓H2SO4具有强氧化性的一个典型反应,为使学生能全面理解并掌握这一重要化学反应,同时了解SO2的相关化学性质,人民教育出版社最新出版的普通高中教科书(2019版)《化学(必修)第二册》第5页设计了如下实验: 在带导管的橡胶塞侧面挖一个凹槽,并嵌入下端卷成螺旋状的铜丝。在试管中加入2mL浓硫酸,塞好橡胶塞,使铜丝与浓硫酸接触。加热,将产生的气体先后通入品红溶液和石蕊溶液中,观察实验现象。向外拉铜丝,终止反应。冷却后,将试管里的物质慢慢倒入盛有少量水的另一支试管里,观察溶液的颜色[1]。实验装置如图1所示。
按照教材所示实验装置,铜与浓硫酸反应的现象一般描述为: 反应过程中溶液逐渐变为蓝色,试管中有气体产生,该气体能使品红溶液褪色,使紫色石蕊溶液变红。笔者按照教材所给实验装置通过反复实验及仔细观察,发现有如下现象产生: (1)加热初期,铜丝表面逐渐变黑;(2)继续加热,有大量刺激性气体产生,溶液逐渐变为墨绿色浊液,试管底部开始有灰白色沉淀生成;(3)再加热,试管中出现“白雾”,浊液逐渐变为澄清,溶液颜色慢慢变为浅蓝色,试管底部灰白色沉淀增多;(4)冷却,静置,将试管中液体倒入另一支盛水试管中,管壁发烫,溶液略带蓝色,将灰白色固体倒入水中,形成蓝色溶液[2]。上述实验现象与教材中预期的实验现象存在较大的差异,笔者带着疑问查阅了相关资料,并进行相关的实验探究和实验改进。
2 对实验异常现象的解释探究
相关文献资料对铜和浓硫酸的反应随着温度的变化对应的反应进行了如下解释[3]:
(1) 当反应温度在100℃左右,发生的主要反应为: 5Cu+4H2SO4(浓)△Cu2S+3CuSO4+4H2O。
(2) 温度高于100℃,随反应温度逐渐升高,发生的反应有:
Cu+H2SO4(浓)△CuO+SO2↑+H2O; 2Cu+H2SO4(浓)△Cu2O+SO2↑+H2O;
Cu+2H2SO4(浓)△CuSO4+SO2↑+2H2O;
Cu2S+2H2SO4(浓)△CuSO4+CuS+SO2↑+2H2O;
CuS+2H2SO4(浓)△CuSO4+SO2↑+S+2H2O。
因此,根据上述反应的发生,铜和浓硫酸反应过程中除了生成主要产物CuSO4和SO2外,还应有很多副产物生成。反应最终生成的沉淀成分有哪些?反应体系溶液和沉淀的颜色变化如何解释?笔者结合相关文献资料并通过实验探究作如下分析。
2.1 沉淀物的成分分析
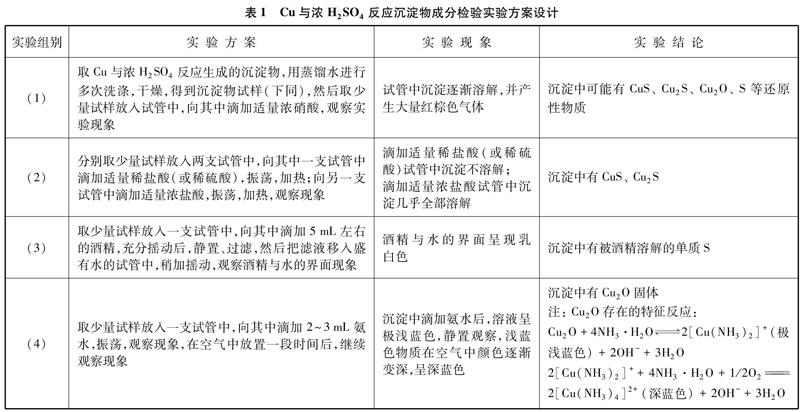
为了检验Cu与浓H2SO4反应生成沉淀物的成分,本实验设计了如下探究性实验方案(如表1所示)。
实验组别实验方案实验现象实验结论(1)取Cu与浓H2SO4反应生成的沉淀物,用蒸馏水进行多次洗涤,干燥,得到沉淀物试样(下同),然后取少量试样放入试管中,向其中滴加适量浓硝酸,观察实验现象试管中沉淀逐渐溶解,并产生大量红棕色气体沉淀中可能有CuS、 Cu2S、 Cu2O、 S等还原性物质
(2)分别取少量试样放入两支试管中,向其中一支试管中滴加适量稀盐酸(或稀硫酸),振荡,加热;向另一支试管中滴加适量浓盐酸,振荡,加热,观察现象滴加适量稀盐酸(或稀硫酸)试管中沉淀不溶解;
滴加适量浓盐酸试管中沉淀几乎全部溶解沉淀中有CuS、 Cu2S
(3)取少量试样放入一支试管中,向其中滴加5mL左右的酒精,充分摇动后,静置、过滤,然后把滤液移入盛有水的试管中,稍加摇动,观察酒精与水的界面现象酒精与水的界面呈现乳白色沉淀中有被酒精溶解的单质S
(4)取少量试样放入一支试管中,向其中滴加2~3mL氨水,振荡,观察现象,在空气中放置一段时间后,继续观察现象沉淀中滴加氨水后,溶液呈极浅蓝色,静置观察,浅蓝色物质在空气中颜色逐渐变深,呈深蓝色沉淀中有Cu2O固体
注: Cu2O存在的特征反应:
Cu2O+4NH3·H2O2[Cu(NH3)2]+(极浅蓝色)+2OH-+3H2O
2[Cu(NH3)2]++4NH3·H2O+1/2O22[Cu(NH3)4]2+(深蓝色)+2OH-+3H2O
通过上述实验现象可知,Cu与浓H2SO4反应生成沉淀的主要成分有Cu2O、 CuS、 Cu2S和单质S,沉淀中理论上可能存在的CuO会在反应过程中与浓硫酸及浓度逐渐变稀的稀硫酸反应生成CuSO4。
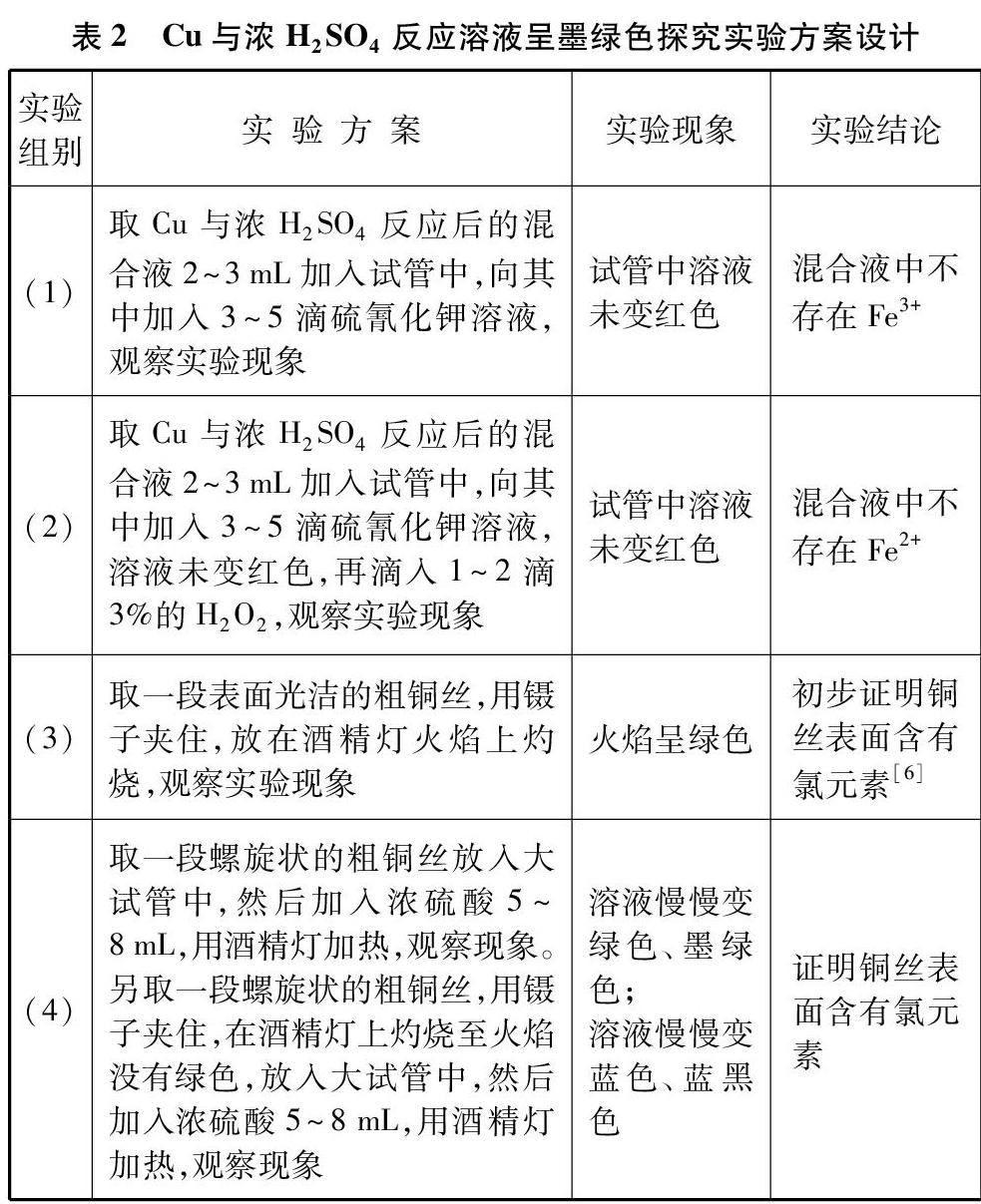
2.2 反应体系溶液及沉淀颜色分析
在加热初期,温度低于100℃时,浓硫酸氧化性不够强,部分Cu失去1个电子变为Cu+,因为Cu+电子构型为3d10,在干燥环境(浓H2SO4)中较为稳定;Cu2S溶度积又特别小[Ksp(Cu2S)=2.0×10-47