温胆汤抑制氧化低密度脂蛋白诱导的巨噬细胞泡沫化*
2020-12-03陈玄晶钟碧莹吴焕林徐丹苹
陈玄晶, 钟碧莹, 吴焕林, 徐丹苹
温胆汤抑制氧化低密度脂蛋白诱导的巨噬细胞泡沫化*
陈玄晶1, 钟碧莹1, 吴焕林3△, 徐丹苹2△
(1广州中医药大学第二临床医学院,2广东省中医院,广东 广州 510020;3北京中医药大学,北京 100700)
从巨噬细胞泡沫化角度探讨温胆汤抗动脉粥样硬化的作用机制。采用MTT法确定温胆汤的无毒性干预浓度;药物干预后,采用油红O染色法检测泡沫细胞的形成;采用酶法检测细胞内胆固醇水平及细胞胆固醇流出;采用Western blot检测巨噬细胞膜蛋白CD36、A类清道夫受体(SR-A)及ATP结合盒转运体A1(ABCA1)和B类I型清道夫受体(SR-BI)的蛋白表达水平。温胆汤冻干粉溶液对氧化型低密度脂蛋白(ox-LDL)刺激的THP-1细胞源性巨噬细胞的无毒性干预浓度为0~6 g/L,于是设置温胆汤干预浓度梯度为1.5、3和6 g/L进行后续实验。各浓度温胆汤干预可抑制ox-LDL诱导的泡沫细胞形成,半定量分析显示温胆汤浓度依赖性降低细胞内脂质沉积(<0.05或<0.01)。温胆汤浓度依赖性降低细胞内总胆固醇、胆固醇酯和胆固醇酯化率(<0.05或<0.01),促进细胞胆固醇流出(<0.01),减少CD36表达(<0.01)。6 g/L温胆汤显著减少SR-A的表达(<0.05); 3和6 g/L温胆汤显著促进ABCA1和SR-BI的表达(<0.05或<0.01)。温胆汤显著抑制巨噬细胞泡沫化,相关机制可能是通过抑制巨噬细胞膜蛋白CD36和SR-A表达而减少巨噬细胞对胆固醇的内化吞噬,同时上调巨噬细胞膜蛋白ABCA1和SR-BI表达,从而促进巨噬细胞内胆固醇流出。
温胆汤;动脉粥样硬化;巨噬细胞;清道夫受体;ATP结合盒转运体A1
巨噬细胞密切参与了动脉粥样硬化从脂质条纹到最终斑块破裂和血栓形成等各个阶段,介导病变处的脂质胆固醇代谢、炎症反应以及纤维降解等,对动脉粥样硬化性斑块的形成、进展以及斑块的稳定性有主导作用[1-2],对周围环境中脂质的吞噬清除也是巨噬细胞主要功能之一[3]。在动脉粥样硬化病程中,循环血流低密度脂蛋白胆固醇增加,渗透进入血管内皮下层,并被氧化形成氧化低密度脂蛋白(oxidized low-density lipoprotein, ox-LDL)。巨噬细胞膜表面富含分化簇36 (cluster of differentiation 36, CD36)和A类清道夫受体(scavenger receptor class A, SR-A)等,可以脂筏的形式内化吞噬ox-LDL,形成泡沫细胞[4]。随着巨噬细胞内胆固醇大量沉积,产生细胞毒性,导致细胞活性逐渐减弱甚至死亡。为了维持细胞活性,并抑制胆固醇的过度累积,巨噬细胞能够启动具有保护作用的胆固醇外流机制,通过液相扩散或ATP结合盒转运体A1 (ATP-binding cassette transporter A1, ABCA1)介导和B类I型清道夫受体(scavenger receptor class B type I, SR-BI)等转运膜蛋白介导的形式,将细胞内过量胆固醇转运至外周血HDL[5-6]。研究表明,靶向作用于胆固醇摄取、外流过程对于动脉粥样硬化的治疗具有重要价值[7]。
胆固醇代谢异常是动脉粥样硬化病变早期巨噬细胞泡沫化的关键因素。现代中医证候本质研究明确血脂代谢异常是中医痰证的物质基础之一[8-10]。温胆汤始载于唐初《千金要方》,是化痰的经典代表方。近年,温胆汤治疗动脉粥样硬化性病变研究陆续开展,显示出良好疗效[11-12],但对温胆汤抗动脉粥样硬化的作用机制鲜有涉及。本研究团队前期对温胆汤及其类方的系列研究表明,温胆汤能够有效降低血甘油三酯(triglyceride, TG)、总胆固醇(total cholesterol, TC)和低密度脂蛋白胆固醇(low-density lipoprotein cholesterol, LDL-C)水平,改善动脉粥样硬化性心脏病患者临床症状及预后[13-15]。本研究基于ox-LDL诱导的巨噬细胞泡沫化疾病模型,探讨温胆汤抗动脉粥样硬化的作用机制,以期为温胆汤的临床运用提供更加全面的科学依据,并进一步为靶点明确、物质基础清晰的中药新制剂研发奠定基础。
材料和方法
1 细胞
人THP-1单核细胞购于中国科学院细胞库。常规方法复苏后冻存于液氮,以含有10%胎牛血清的RPMI-1640培养基置于37℃、5% CO2细胞培养箱内培养,每日观察细胞生长状态,取对数生长期,生长至80%以上融合的THP-1细胞进行后续实验。
2 药物制备
根据唐代孙思邈《千金要方》中所载温胆汤,按原经方比例配伍。每克生药加入6 mL超纯水,浸泡30 min,加热煮沸后文火继续煎煮30 min,过滤至滤液自然滴尽,收集药液;每克药渣加入4 mL超纯水,再次煎煮,方法同前,合并2次收集的滤液;使用旋转蒸发仪,将滤液浓缩成浸膏;预冷冷冻干燥机,放入浸膏,制成冻干粉。
3 主要试剂
油红O、ProteoPrep®Membrane Extraction Kit、佛波酯(phorbol myristate acetate, PMA)、二甲基亚砜(dimethyl sulfoxide, DMSO)和脱脂奶粉购自Sigma-Aldrich; RPMI-1640培养基购自Gibco; Cholesterol Efflux Assay试剂盒、anti-ABCA1 antibody、anti-scavenging receptor SR-BI antibody和anti-CD36 antibody购自Abcam; GAPDH rabbit mAb、anti-rabbit IgG及HRP-linked antibody、anti-rat IgG及HRP-linked antibody购自Cell Signaling Technology; anti-SRA antibody购自Santa Cruz;苏木素染液和MTT购自碧云天生物技术有限公司;胎牛血清(fetal bovine serum, FBS)购自HyClone; ECL发光液(Immobilon ECL Ultra Western HRP Substrate)购自Millipore; BCA蛋白浓度检测试剂盒购自Thermo Fisher Scientific;总胆固醇酶法检测试剂盒和游离胆固醇酶法检测试剂盒购自北京普利莱基因技术有限公司; ox-LDL购自广州奕源公司。
4 主要仪器
TE2000-S荧光倒置显微镜(NIKON);自动细胞计数仪(Costar); Multiskan FC自动酶标仪(Thermo Fisher Scientific); Milli-Q Integral 3型超纯水系统(Millipore);垂直电泳仪、蛋白转膜系统、ChemiDoc XRS凝胶成像系统(Bio-Rad); MB-102振荡恒温金属浴(杭州博日科技有限公司)。
5 方法
5.1巨噬细胞泡沫化模型的建立[16-17]取对数生长期的THP-1细胞,计数,移入离心管, 800 r/min,离心5 min;吸弃上清液,加入含160 nmol/L PMA和10% FBS的RPMI-1640培养基,调整细胞密度后接种于细胞板,置于37℃、5% CO2细胞培养箱中培养24 h;次日镜下观察细胞形态, THP-1细胞由悬浮生长转为贴壁生长,体积增大,形态由圆形转变为不规则形态,伸出伪足,提示THP-1单核细胞已分化为巨噬细胞。
诱导分化为THP-1细胞源性巨噬细胞后,加入含50 mg/L ox-LDL和3% FBS的RMPI-1640培养基,置于37℃、5% CO2细胞培养箱继续培养24 h;次日镜下观察细胞形态,镜下观察细胞体积进一步增大,胞浆内脂质增多,部分聚集呈透亮状脂滴;油红O染色后,细胞内出现大量亮红色圆形脂滴,呈戒环样,提示THP-1细胞源性巨噬细胞转变为泡沫细胞。
5.2药物毒性实验取对数增长期、生长状态良好的THP-1细胞,调整细胞密度为每孔1×104个,接种于96孔板,每个浓度组设置2个复孔; PMA诱导分化为巨噬细胞后,使用含3% FBS的RPMI-1640培养基配制浓度梯度为0.375、0.75、1.5、3、6、12和24 g/L温胆汤冻干粉溶液,协同50 mg/L ox-LDL共同干预;无施加药物和ox-LDL干预的THP-1细胞源性巨噬细胞为对照组;培养24 h后,加入MTT溶液,置于细胞培养箱中避光培养4 h;加入DMSO,置于水平低速摇床振荡10 min;使用酶标仪测量490 nm波长处的吸光度(490),计算细胞相对活力。细胞相对活力(%)=实验组490/对照组490×100%。
5.3药物干预使用含3% FBS的RPMI-1640培养基溶解温胆汤冻干粉,微孔滤膜过滤后, -20℃存储备用。取对数生长期、状态良好的THP-1细胞,接种于细胞板,按前述操作诱导为THP-1细胞源性巨噬细胞。根据药物毒性实验检测结果,分别稀释调整温胆汤冻干粉浓度为1.5、3和6 g/L,并加入终浓度为50 mg/L ox-LDL共同培养。单纯使用50 mg/L ox-LDL刺激,不施加药物干预的THP-1细胞源性巨噬细胞为对照(control)组。培养24 h后进行后续实验。
5.4油红O染色检测泡沫细胞形成取对数增长期、生长状态良好的THP-1细胞,以每孔2×105个接种于24孔细胞板中,每组设置2个复孔;按前述方法诱导分化为巨噬细胞后进行药物干预,并将无添加ox-LDL刺激和药物干预的THP-1细胞源性巨噬细胞设为空白对照组;使用加入4%多聚甲醛固定10 min;加入60%异丙醇10 min;加入油红O工作液,室温染色30 min;吸弃油红O工作液,加入超纯水,倒置显微镜下观察、拍照留存;加入60%异丙醇2 min;加入异丙醇水平摇床振荡30 min;取上清液于96孔板,异丙醇为调零孔,酶标仪测量每孔的492值以进行半定量分析。
5.5酶法检测细胞内胆固醇含量取对数增长期、生长状态良好的THP-1细胞,以每孔2×106个接种于6孔细胞板,每组设置1个复孔;按前述方法诱导分化为巨噬细胞后进行药物干预;按照胆固醇酶法检测试剂盒说明书操作,并使取适量细胞上清液用于BCA蛋白浓度测定;使用酶标仪测量各孔的550值;将各个标准品和待测样品的550值减去空白标准品的550值即为校正后的550值;使用校正后的标准品550值与其对应的浓度绘制标准曲线,并计算各待测样品的胆固醇浓度;使用每mg蛋白浓度校正胆固醇含量,计算胆固醇浓度。(1)胆固醇酯(cholesterol ester, CE)=总胆固醇含量-游离胆固醇含量;(2)胆固醇酯化率(cholesterol esterification rate, CER)=CE含量/总胆固醇含量×100%。
5.6胆固醇流出实验取对数增长、状态良好的THP-1细胞,以每孔4×104个接种于96孔白色细胞板,每组设置2个复孔;按前述使用PMA诱导THP-1细胞源性巨噬细胞后,加入标记胆固醇试剂,于细胞培养箱中培养16 h;分别加入含1.5、3和6 g/L温胆汤冻干粉及10% FBS的RPMI-1640培养基,无施加药物干预含10% FBS的RPMI-1640培养基为对照组,与细胞培养箱中继续培养6 h;转移细胞上清液至新的96孔白色细胞板,使用荧光分光光度计测量培养基荧光值(激发波长482 nm,发射波长515 nm);在含有细胞的96孔板中加入细胞裂解液,室温水平摇床振荡30 min;测量细胞裂解液荧光值(激发波长和发射波长同前)。胆固醇流出率(%)=培养基荧光值/(培养基荧光值+细胞裂解液荧光值)×100%。
5.7Western blot检测巨噬细胞膜蛋白CD36、SR-A、ABCA1和SR-BI的表达水平取对数增长、状态良好THP-1细胞,以每孔2×106个接种于6孔细胞板;按前述方法诱导分化为巨噬细胞后进行药物干预;收集各组细胞,加入细胞裂解液, 4℃、12 000 r/min离心15 min;根据BCA蛋白浓度测量结果调整各组样品浓度,100℃恒温金属浴变性;每组取30~50 μg蛋白,于10% SDS-PAGE分离蛋白;转膜后, 5%脱脂奶粉封闭2 h,加入一定稀释比例I抗, 4℃孵育过夜;TBST洗膜3次,加入对应II抗溶液,室温孵育2 h;ECL化学发光试剂显影曝光;以GAPDH为内参照,使用Image Lab 5.1.0软件进行蛋白条带灰度分析。
6 统计学处理
运用SPSS 19.0软件进行统计分析。每个实验均独立重复3次以上,计量资料服从正态分布采用均数±标准差(Mean±SD)表示。多组间比较采用单因素方差分析,组间多重比较采用Bonferroni校正检验或Tamhane's T2检验。以<0.05为差异有统计学意义。
结果
1 温胆汤协同ox-LDL干预对THP-1细胞源性巨噬细胞活力的影响
当温胆汤浓度升至12 g/L时的细胞相对活力降至(16.52±4.76)%,与对照组比较有显著差异(<0.01),说明温胆汤浓度≥12 g/L时,协同50 mg/L ox-LDL干预会对THP-1细胞源性泡沫细胞产生明显毒性作用,温胆汤安全干预浓度为0~6 g/L,见图1。
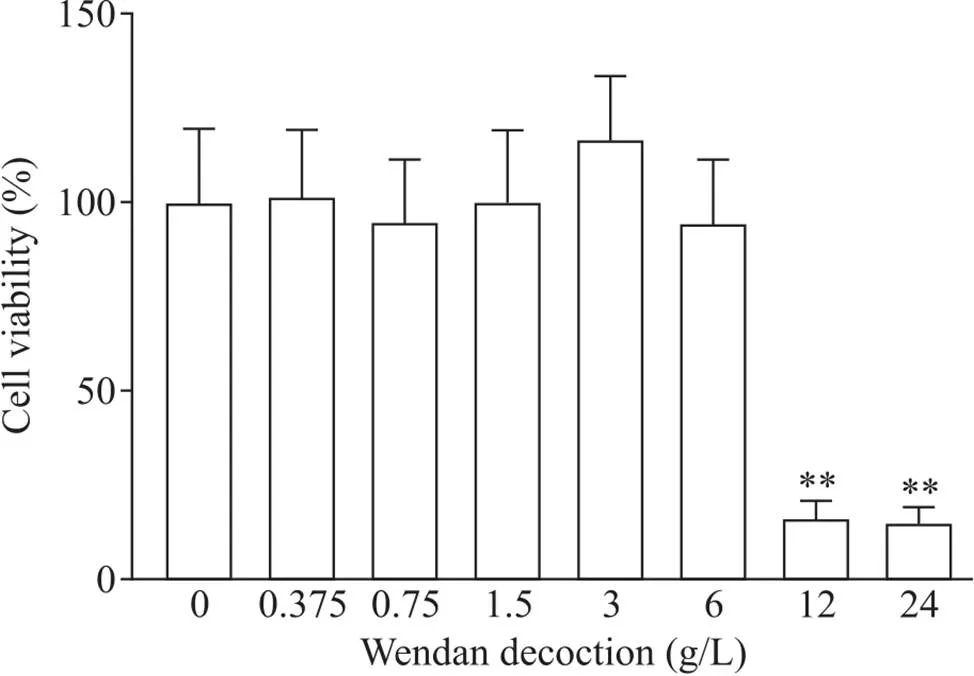
Figure 1. The viability of THP-1 cell-derived macrophages treated with ox-LDL at 50 mg/L and Wendan decoction at different concentrations was measured by MTT assay. Mean±SD. n=6. **P<0.01 vs 0 g/L group.
2 温胆汤对巨噬细胞泡沫化的影响
油红O染色结果显示,空白对照组细胞胞浆内仅有少量细小红色颗粒;对照组细胞经ox-LDL刺激后体积增大,胞浆内有明显亮红色脂滴,呈典型戒环样泡沫细胞形态;与对照组比较,1.5、3和6 g/L温胆汤组细胞胞浆内红色脂滴均明显减少、变小,半定量分析结果显示,温胆汤剂量依赖性降低细胞内脂质沉积,与对照组比较差异均有统计学意义(<0.05或<0.01),见图2。
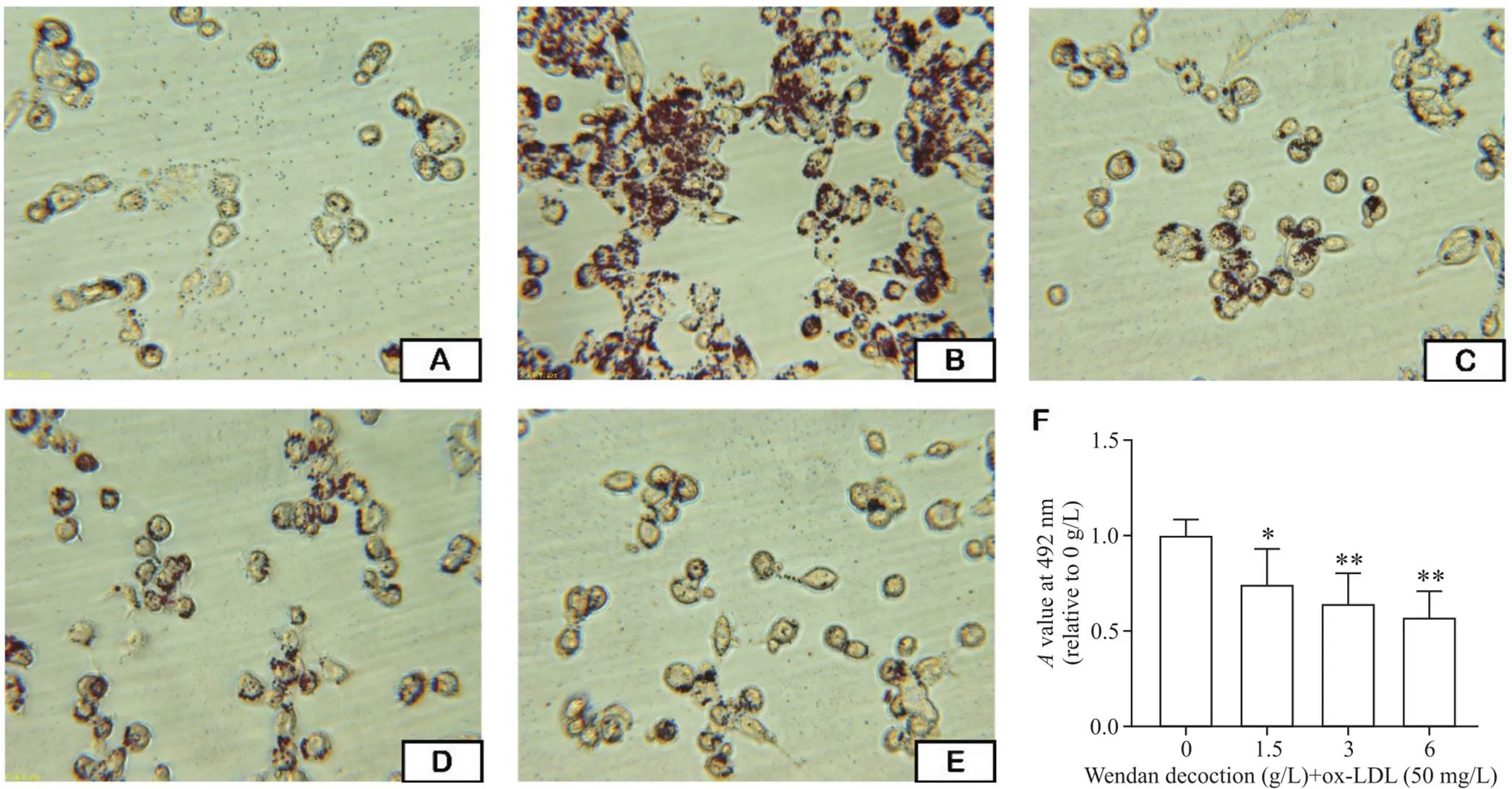
Figure 2. The formation of foam cells induced by ox-LDL was examined by oil red O staining (×200). A: negative control group; B: 0 g/L Wendan decoction+50 mg/L ox-LDL group; C: 1.5 g/L Wendan decoction+50 mg/L ox-LDL group; D: 3 g/L Wendan decoction+50 mg/L ox-LDL group; E: 6 g/L Wendan decoction+50 mg/L ox-LDL group; F: semi-quantitative analysis of intracellular lipid. Mean±SD. n=5. *P<0.05, **P<0.01 vs 0 g/L group.
3 温胆汤对细胞内胆固醇水平的影响
1.5、3和6 g/L温胆汤干预后细胞内TC、CE和CER均显著降低,与对照组比较差异有统计学显著性(0.05或<0.01),而各浓度温胆汤组FC水平与对照组比较差异无统计学显著性(>0.05); 6 g/L温胆汤降低CE的效果优于1.5 g/L温胆汤(<0.05), 6 g/L温胆汤降低CER的效果优于1.5和3 g/L温胆汤(<0.05),见表1。
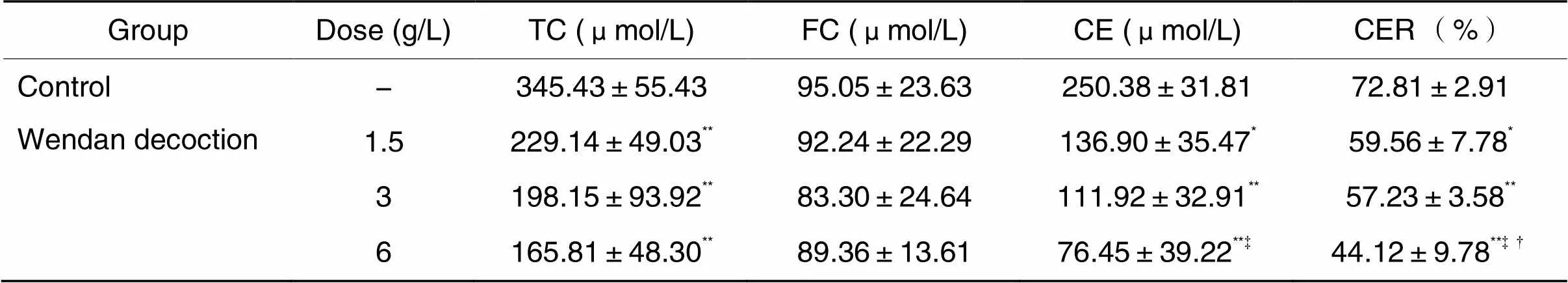
表1 细胞内胆固醇水平
TC: total cholesterol; FC: free cholesterol; CE: cholesterol ester; CER: cholesterol esterification rate.*<0.05**<0.01control group;‡<0.051.5 g/L Wendan decoction group;†<0.053 g/L Wendan decoction group.
4 温胆汤对细胞胆固醇流出率的影响
对照组细胞胆固醇流出率为(7.70±0.93)%;1.5、3和6 g/L温胆汤干预后,细胞胆固醇流出率分别为(10.23±0.94)%、(12.12±1.19)%和(13.42±0.81)%,与对照组比较显著升高(<0.01);温胆汤各浓度组间比较结果显示, 3 g/L和6 g/L温胆汤促进细胞胆固醇流出率药效优于1.5 g/L温胆汤(<0.05或<0.01),见图3。
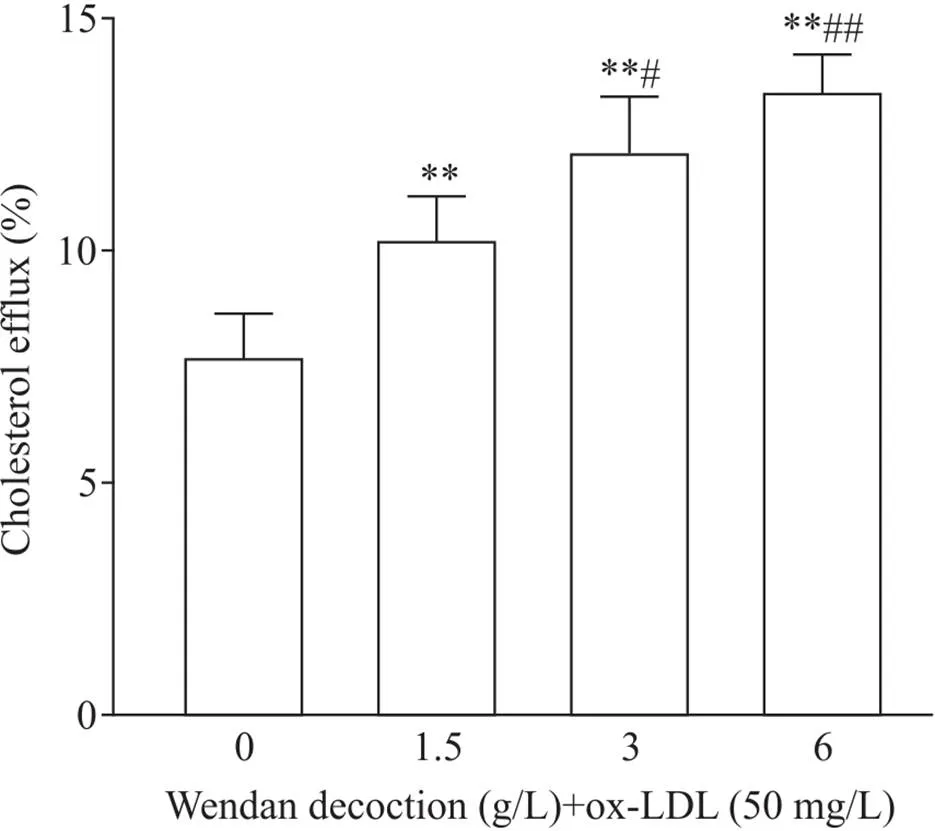
Figure 3. Cholesterol efflux in THP-1 cell-derived macrophages. Mean±SD. n=5. **P<0.01 vs 0 g/L group;#P<0.05, ##P<0.01 vs 1.5 g/L group.
5 温胆汤对巨噬细胞清道夫受体CD36和SR-A蛋白表达水平的影响
Western blot结果显示,与对照组比较,各浓度温胆汤干预均抑制CD36蛋白表达水平(<0.05或<0.01),温胆汤各浓度组间比较, 1.5、3和6 g/L温胆汤干预后CD36表达量依次降低,但差异无统计学显著性(>0.05); 1.5和3 g/L温胆汤干预后SR-A表达水平虽有降低,但与对照组比较差异无统计学显著性(>0.05),而6 g/L温胆汤干预显著抑制SR-A表达(<0.05),温胆汤各浓度组间比较,温胆汤抑制SR-A蛋白表达水平呈一定浓度依赖性,但组间差异无统计学显著性(>0.05),见图4。
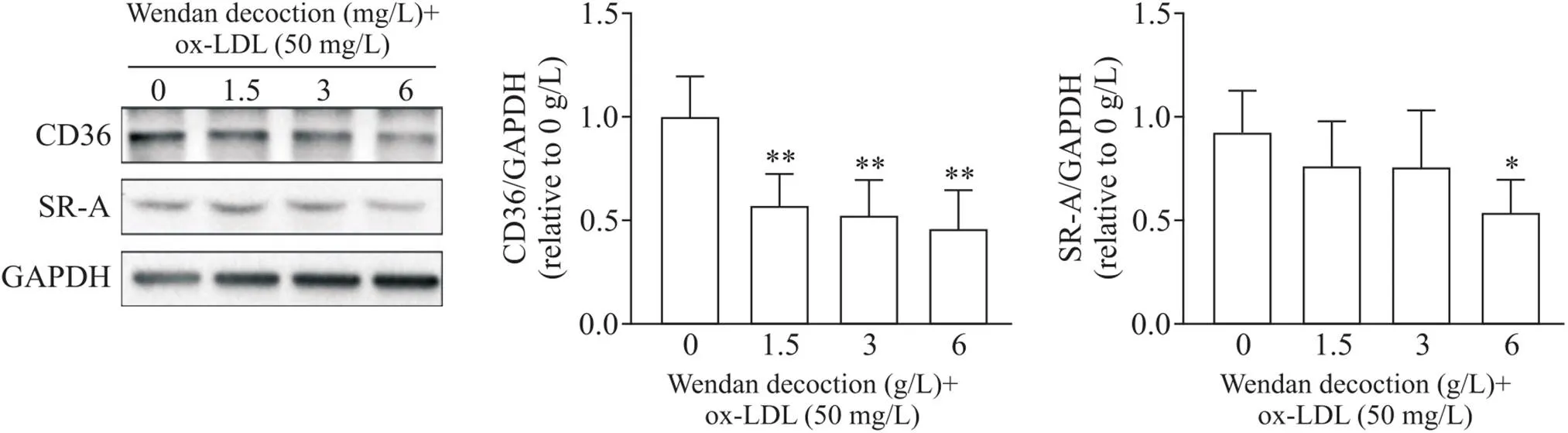
Figure 4. The protein levels of CD36 and SR-A in THP-1 cell-derived macrophages. Mean±SD. n=5. *P<0.05, **P<0.01 vs 0 g/L group.
6 温胆汤对巨噬细胞胆固醇逆转运相关膜蛋白ABCA1和SR-BI表达水平的影响
Western blot结果显示, 1.5 g/L温胆汤干预后ABCA1蛋白表达水平略有升高,但与对照组比较差异无统计显著性(>0.05),而3 g/L和6 g/L温胆汤组ABCA1蛋白表达水平与对照组比较显著升高(<0.05或<0.01),温胆汤各浓度组间比较, ABCA1蛋白表达水平随着温胆汤浓度升高依次提高,但各浓度组间差异无统计学显著性(>0.05); SR-BI蛋白水平检测结果显示,与对照组比较, 1.5 g/L温胆汤组SR-BI蛋白表达水平略微升高,但与对照组比较差异无统计学显著性(>0.05),而3 g/L和6 g/L温胆汤组细胞膜SR-BI蛋白表达水平与对照组比较(<0.01),温胆汤各浓度组间比较, SR-BI蛋白水平的差异无统计学显著性(>0.05),见图5。
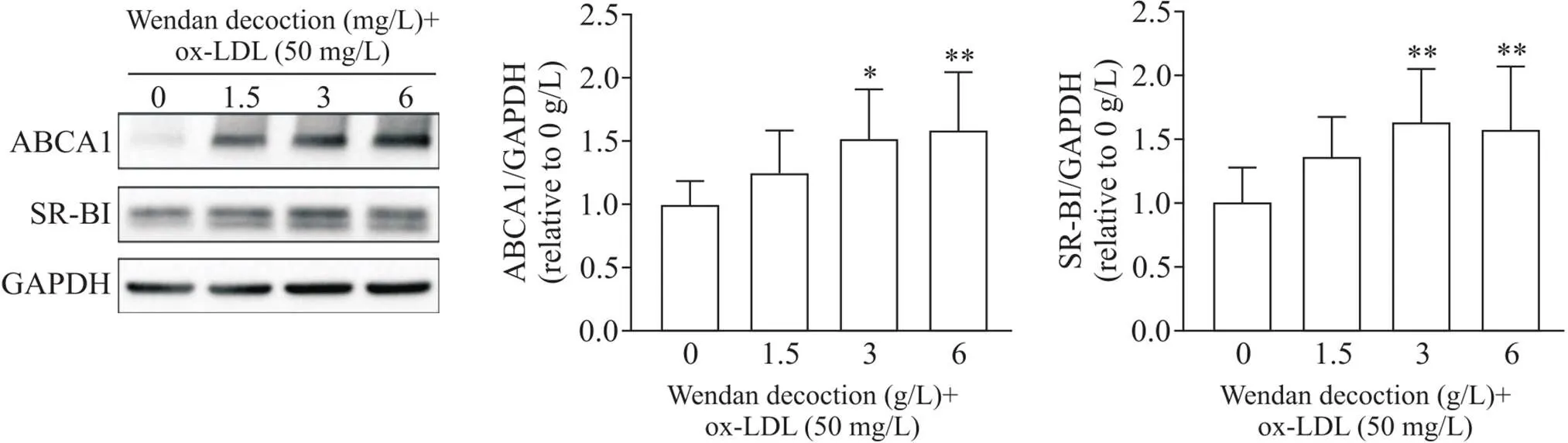
Figure 5. The protein levels of ABCA1 and SR-BI in THP-1 cell-derived macrophages. Mean±SD. n=5. *P<0.05, **P<0.01 vs 0 g/L group.
讨论
本研究发现,温胆汤浓度依赖性抑制ox-LDL诱导的THP-1细胞源性巨噬细胞泡沫化,降低细胞内胆固醇水平以及胆固醇酯化率,并促进细胞胆固醇流出率;同时温胆汤干预有效降低THP-1细胞源性巨噬细胞清道夫受体CD36和SR-A蛋白表达水平,并提高胆固醇逆转运相关膜蛋白ABCA1和SR-BI表达。
胆固醇在动脉壁上沉积以及泡沫细胞形成是早期动脉粥样硬化的典型病理改变[18]。调节巨噬细胞内胆固醇代谢和转运的平衡,从而抑制泡沫细胞的形成,已成为防治动脉粥样硬化的重要靶点[7]。ox-LDL是巨噬细胞泡沫化过程中胆固醇的主要来源,并且能够抑制巨噬细胞胆固醇外流,加剧胆固醇在巨噬细胞内沉积,从而促进动脉粥样硬化病变进展[19]。本研究使用ox-LDL刺激巨噬细胞,诱导泡沫细胞形成,从而模拟动脉粥样硬化病变过程中胆固醇沉积和泡沫细胞形成。不同浓度温胆汤干预后,采用油红O染色及半定量分析检测干预后的泡沫细胞内的脂质沉积以及泡沫细胞的形成情况,镜下观察表明温胆汤能够有效减少泡沫细胞的形成,并且减少细胞内脂滴的数量、大小,半定量分析显示温胆汤浓度依赖性抑制细胞内脂质沉积。
温胆汤可显著抑制细胞内脂质沉积和泡沫细胞形成,故推测温胆汤也可能减少细胞内胆固醇含量。使用酶法胆固醇试剂盒,进一步检测温胆汤对细胞内胆固醇水平的影响。结果显示,温胆汤干预可降低细胞内胆固醇含量,呈一定剂量依赖性,以6 g/L温胆汤干预药效最显著。与对照组比较,6 g/L温胆汤组细胞TC、CE和CER分别降低了约52%、70%和40%,其中以降低CE效果最为显著。CE是泡沫细胞内脂质沉积的主要成分, ox-LDL被巨噬细胞吞噬后,经细胞内酸性脂肪酶和中性胆固醇水解酶作用降解为具有细胞毒性的FC,再经由酰基辅酶A的酯化作用形成CE沉积在细胞内,当CE在细胞内累计超过TC的60%时可认为形成泡沫细胞[20]。减少CE在细胞内沉积可抑制泡沫细胞形成,从而延缓动脉粥样硬化斑块的进展[21]。我们研究发现温胆汤及其药效成分单体不但降低细胞内TC,更能有效减少细胞内CE水平,降低CER。
细胞内胆固醇的过量累积可产生细胞毒性,巨噬细胞内胆固醇逆向转运至外周是为维持自身活性而启动的保护性过程[6]。通过对THP-1细胞源性巨噬细胞中标记胆固醇的流出率进行测量,我们发现温胆汤能够显著促进巨噬泡沫细胞内胆固醇的外流,提高细胞胆固醇流出率,呈一定剂量依赖性。因此,我们认为温胆汤能够抑制细胞内胆固醇和CE的沉积,同时提高细胞内胆固醇流出率,从而有效抑制泡沫细胞的形成。
CD36和SR-A均为清道夫受体家族成员,介导了绝大部分巨噬细胞对氧化或乙酰化修饰LDL的摄取代谢,可达到75%~90%,其中乙酰化LDL主要由SR-A调节, ox-LDL则优先由CD36调节[4],并且CD36和SR-A所介导的巨噬细胞胆固醇吞噬不受机体胆固醇负反馈调节控制,使细胞内正常胆固醇转运平衡被破坏。大量动物和细胞实验显示, CD36和SR-A是调节巨噬细胞内胆固醇代谢的有效靶点[22-23]。本研究结果显示,温胆汤能够显著降低细胞CD36和SR-A蛋白表达水平,呈一定剂量依赖性。其中6 g/L温胆汤干预降低CD36和SR-A表达水平效果最佳,与对照组比较分别降低了54%和47%。温胆汤各浓度组均能显著降低细胞CD36蛋白表达水平,而仅6 g/L温胆汤表现出显著降低SR-A的作用,说明温胆汤可能主要通过抑制CD36蛋白表达而抑制巨噬细胞对胆固醇的吞噬。有研究显示,在对修饰性LDL的代谢中,乙酰化LDL主要由SR-A调节,而ox-LDL则优先由CD36调节[24]。鉴于此,我们认为与抑制SR-A的作用相比,温胆汤对CD36的显著抑制能力将更加有助于抑制巨噬细胞内的胆固醇沉积。
巨噬细胞内胆固醇的外流主要通过4种方式,包括液相扩散、ABCA1介导、ABCG1介导和SR-BI介导,分别占35%、35%、21%和9%[25]。研究显示,在胆固醇代谢正常的小鼠巨噬细胞中,胆固醇外流主要通过液相扩散,而在过量负载胆固醇的巨噬细胞中,胆固醇外流主要通过转运蛋白介导。此外,在胆固醇过载的人巨噬细胞中,胆固醇外流主要由ABCA1介导,其次为SR-BI,而ABCG1对人巨噬细胞的胆固醇外流几乎没有贡献[5-6]。前期研究发现温胆汤能够显著促进细胞内胆固醇外流,于是我们进一步对THP-1细胞源性巨噬细胞胆固醇外流相关的膜转运蛋白进行Western blot检测,以挖掘温胆汤调节巨噬细胞胆固醇逆转运的机制。本研究结果显示,温胆汤干预后巨噬细胞ABCA1和SR-BI蛋白表达水平均显著增加,温胆汤最佳药效组与对照组比较分别增加了约59%和63%,提示温胆汤可能通过影响ABCA1和SR-BI蛋白表达而促进巨噬细胞的胆固醇外流。
综上所述,我们认为温胆汤能够有效抑制ox-LDL诱导的巨噬细胞泡沫化。相关机制可能是通过抑制巨噬细胞清道夫受体CD36和SR-A的表达,从而减少巨噬细胞对胆固醇的内化吞噬,降低细胞内胆固醇蓄积和胆固醇酯化;同时上调巨噬细胞胆固醇逆转运相关膜蛋白ABCA1和SR-BI表达,从而促进巨噬细胞内胆固醇流出。本研究结果从巨噬细胞泡沫化角度明确了温胆汤抗动脉粥样硬化的作用机制,为温胆汤防治动脉粥样硬化性疾病的临床运用提供了有力证据。
[1] Linton MF, Fazio S. Macrophages, inflammation, and atherosclerosis[J]. Int J Obesity, 2003, 27:35-40.
[2] Shibata N, Glass CK.Macrophages, oxysterols and atherosclerosis[J]. Circ J, 2010, 74(10):2045-2051.
[3] Liu X, Ntambi JM.Atherosclerosis: Keep your macrophages in shape[J]. Nat Med, 2009, 15(12):1357-1358.
[4] Parthasarathy S, Fong LG, Otero D, et al. Recognition of solubilized apoproteins from delipidated, oxidized low density lipoprotein (LDL) by the acetyl-LDL receptor[J]. Proc Natl Acad Sci U S A, 1987, 84(2):537-540.
[5] Ohashi R, Mu H, Wang X, et al. Reverse cholesterol transport and cholesterol efflux in atherosclerosis[J]. QJM, 2005, 98(12):845-856.
[6] Pennings M, Meurs I, Ye D, et al.Regulation of cholesterol homeostasis in macrophages and consequences for atherosclerotic lesion development[J]. FEBS Lett, 2006, 580(23):5588-5596.
[7] Wilson HM, Barker RN, Erwig LP. Macrophages: promising targets for the treatment of atherosclerosis[J]. Curr Vasc Pharmacol, 2009, 7(2):234-243.
[8]陈玄晶,徐丹苹,陈小光,等. 冠心病中医痰证与客观化指标关系研究概述[J]. 中华中医药杂志, 2017, 32(7):3089-3092.
Chen XJ, Xu DP, Chen XG, et al. Overview of the relationship between phlegm syndrome and objective indexes in coronary heart disease[J]. Chin J Tradit Chin Med Pharm, 2017, 32(7):3089-3092.
[9]吴焕林,吕渭辉,潘桂娟,等. 中医痰证诊断标准[J]. 中国中西医结合杂志, 2016, 31(7):776-780.
Wu HL, Lv WH, Pan GJ, et al. Diagnosis standards for phlegm syndrome of Chinese medicine[J]. Chin J Integr Tradit West Med, 2016, 31(7):776-780.
[10] 徐济民,蔡沛源,李龙官,等. 痰浊型冠心病与血脂水平关系的探讨[J]. 中西医结合杂志, 1984, 4(5):265-267.
Xu JM, Cai PY, Li LG, et al. The relationship between coronary heart disease of turbid-phlegm type and blood lipid levels[J]. Chin J Integr Tradit West Med, 1984, 4(5):265-267.
[11] Xu JH, Huang YM, Ling W, et al. Wen Dan decoction for hemorrhagic stroke and ischemic stroke[J]. Complement Ther Med, 2015, 23(2):298-308.
[12]何皓颋. 加味温胆汤对气虚痰瘀型冠状动脉粥样硬化性心脏病多支病变不完全血运重建患者心绞痛的影响[J]. 中医临床研究, 2019, 11(10):73-75.
He HT. Effects of the Wendan decoction on angina of incomplete revascularization patients with coronary heart disease of the QixuTanyu type[J]. Clin J Chin Med, 2019, 11(10):73-75.
[13] 陈玄晶,陈小光,徐丹苹,等. 温胆汤调节血脂异常系统评价[J]. 中国中医药信息杂志, 2017, 24(8):93-98.
Chen XJ, Chen XG, Xu DP, et al. Systematic assessment on effects of Wendan decoction on dyslipidemia[J]. Chin J Inf Traditi Chin Med, 2017, 24(8): 93-98.
[14] 吴焕林,徐丹苹,罗文杰. 邓铁涛调脾护心法治疗冠心病心绞痛方案抗心肌缺血作用的临床队列研究[J]. 辽宁中医药杂志, 2012, 39(3):385-387.
Wu HL, Xu DP, Luo WJ. Clinical cohort study of anti-myocardial ischemia effect of DENG Tie-taotreating angina pectoris with spleen-regulating-and-heart-nourishing theory[J]. Liaoling J Tradit Chin Med, 2012, 39(3): 385-387.
[15] 徐丹苹,王侠,盛小刚,等. 参术冠心方治疗冠心病稳定型心绞痛临床研究[J]. 广州中医药大学学报, 2014, 31(2):173-177.
Xu DP, Wang X, Sheng XG, et al. Double-blind, randomized, controlled clinical trial of ShenzhuGuanxin Prescription for treatment of stable angina due to coronary heart disease[J]. J Guangzhou Univ Tradit Chin Med, 2014, 31(2):173-177.
[16] 陈亮,孙毅凡,陈涛,等. 佛波酯诱导THP-1细胞分化条件的优化及自噬模型的建立[J].中国防痨杂志, 2013, 35(12):997-1001.
Chen L, Sun YF, Chen T, et al. Optimization of culture for THP-1 derived macrophages induced by PMA and establishment of autophagy model[J].Chin J Antitubercul, 2013, 35(12):997-1001.
[17] Hundal RS, Gómez-Muñoz A, Kong JY, et al. Oxidized low density lipoprotein inhibits macrophage apoptosis by blocking ceramide generation, thereby maintaining protein kinase B activation and Bcl-XL levels[J]. J Biol Chem, 2013, 278(27):24399-24408.
[18] Liu X, Ntambi JM. Atherosclerosis: keep your macrophages in shape[J]. Nat Med, 2009, 15(129):1357-1358.
[19] Yuan Y, Li P, Ye J. Lipid homeostasis and the formation of macrophage-derived foam cells in atherosclerosis[J]. Protein Cell, 2012, 3(3):173-181.
[20] Ghosh S. Early steps in reverse cholesterol transport[J]. Curr Opin Endocrinol Diabetes Obes, 2012, 19(2):136-141.
[21] Zhao B, Song J, Chow WN, et al. Macrophage-specific transgenic expression of cholesteryl ester hydrolase significantly reduces atherosclerosis and lesion necrosis in Ldlr mice[J]. J Clin Invest, 2007, 117(10):2983-2992.
[22] Makinen PI, Lappalainen JP, Heinonen SE, et al. Silencing of either SR-A or CD36 reduces atherosclerosis in hyperlipidaemic mice and reveals reciprocal upregulation of these receptors[J]. Cardiovasc Res, 2010, 88(3):530-538.
[23] 肖铭甲,陈卫红,吴炜,等. 虎杖苷抑制ox-LDL诱导的脂质过氧化并下调巨噬细胞清道夫受体CD36表达[J]. 中国病理生理杂志, 2010, 26(7):1280-1284.
Xiao MJ, Chen WH, Wu W, et al. Polydatin inhibits lipid peroxidation induced by ox-LDL and down-regulates CD36 expression in macrophages[J]. Chin J Pathophysiol, 2010, 26(7):1280-1284.
[24] Kunjathoor VV, Febbraio M, Podrez EA, et al. Scavenger receptors class A-I/II and CD36 are the principal receptors responsible for the uptake of modified low density lipoprotein leading to lipid loading in macrophages[J]. J Biol Chem, 2002, 277(51):49982-49988.
[25] Yancey PG, Bortnick AE,Kellner WG, et al. Importance of different pathways of cellular cholesterol efflux[J]. Arterioscler Thromb Vasc Biol, 2003, 23(5):712-719.
Inhibitory effect of Wendan decoction on formation of foam cells induced by ox-LDL
CHEN Xuan-jing1, ZHONG Bi-ying1, WU Huan-lin3, XU Dan-ping2
(1,2,510020,;3,100700,)
To explore the anti-atherosclerotic mechanism of Wendan decoction based on formation of foam cells.The optimal concentrations of Wendan decoction without cytotoxity to cells were selected by MTT assay. After Wendan decoction treatment, the formation of foam cells was examined by oil red O staining. The cholesterol efflux, cholesterol level, free cholesterol level and cholesterol esterification rate were analyzed using cholesterol efflux assay, total cholesterol assay and free cholesterol assay. The expression levels of macrophage membrane proteins, including CD36, scavenger receptor class A (SR-A), ATP-binding cassette transporter A1 (ABCA1) and scavenger receptor class B type I (SR-BI), were quantified by Western blot.The optimal concentrations of Wendan decoction without cytotoxity to the cells were 0~6 g/L. Wendan decoction at the concentrations of 1.5, 3 and 6 g/L were selected for the experiments. Wendan decoction at these concentrations inhibited the formation of foam cells induced by oxidized low-density lipoprotein (ox-LDL), and reduced the accumulation of intracellular lipids in a concentration-dependent manner (<0.05 or<0.01). Wendan decoction also reduced intracellular total cholesterol level, cholesterol ester level and cholesterol esterification rate (<0.05 or<0.01), promoted efflux of intracellular cholesterol (<0.01), and decreased the protein level of CD36 in THP-1 cell-derived macrophages (<0.01) in a concentration-dependent manner. Wendan decoction at the concentration of 6 g/L significantly reduced the protein level of SR-A in THP-1 cell-derived macrophages (<0.05). At the concentrations of 3 and 6 g/L, Wendan decoction significantly increased the protein levels of ABCA1 and SR-BI in THP-1 cell-derived macrophages (<0.05 or<0.01).Wendan decoction significantly inhibits ox-LDL-induced formation of foam cells by reducing cholesterol deposition and promoting cholesterol efflux, and its mechanism may be related to the down-regulation of CD36 and SR-A and the up-regulation of ABCA1 and SR-BI.
Wendan decoction; Atherosclerosis; Macrophages; Scavenger receptor; ATP-binding cassette transporter A1
R543.5; R363.2
A
10.3969/j.issn.1000-4718.2020.11.005
1000-4718(2020)11-1952-08
2020-04-12
2020-05-20
国家自然科学基金资助项目(No.81774219);中医药科学技术研究专项(No.YN2019MJ13)
Tel: 020-81887233; E-mail: heart-center2@gzucm.edu.cn(徐丹苹); wuhuanlinboshi@aliyun.com(吴焕林)
(责任编辑:宋延君,罗森)
