rAAV9介导的siRNA敲减p65对压力超负荷大鼠心肌纤维化和凋亡的影响*
2020-12-03王栩越包雅丽张甜凌灿王一平吴振宏孙湛
王栩越, 包雅丽, 张甜, 凌灿, 王一平, 吴振宏, 孙湛
rAAV9介导的siRNA敲减对压力超负荷大鼠心肌纤维化和凋亡的影响*
王栩越, 包雅丽, 张甜, 凌灿, 王一平, 吴振宏, 孙湛△
(新疆医科大学基础医学院,新疆 乌鲁木齐 830011)
探讨重组腺相关病毒血清型9 (rAAV9)介导的敲减基因表达对压力超负荷大鼠心功能的作用及可能机制。通过腹主动脉缩窄手术(AAC)构造大鼠左心室肥厚模型。将造模的SD大鼠随机分为假手术组、AAC组、AAC+rAAV9-eGFP组和AAC+rAAV9-eGFP-P65-siRNA组。假手术组大鼠开腹后直接关闭腹腔;其余3组大鼠开腹结扎腹主动脉后关闭腹腔,术后3 d对AAC大鼠分别尾静脉注射生理盐水、rAAV9-eGFP和rAAV9-eGFP-P65-siRNA。4周后,测定血流动力学相关指标;计算心脏质量参数; Masson染色检测心肌纤维化程度; TUNEL染色观察细胞凋亡水平; Western blot检测心肌P65的表达水平; ELISA检测各组大鼠血清肿瘤坏死因子α (TNF-α)和白细胞介素6 (IL-6)的含量。AAC组和AAC+rAAV9-eGFP组中P65表达量较假手术组上升(<0.05);AAC+rAAV9-eGFP-P65-siRNA组中P65表达量较AAC组明显降低(<0.05)。AAC组和AAC+rAAV9-eGFP组大鼠收缩压、舒张压、左室重量/体重、心肌细胞凋亡率及TNF-α和IL-6水平均较假手术组增高(<0.05);与AAC组相比,AAC+rAAV9-eGFP-P65-siRNA组大鼠上述指标均下降(<0.05)。Masson染色结果显示,与假手术组相比,AAC组和AAC+rAAV9-eGFP组大鼠心肌组织中胶原蛋白的沉积增多,而rAAV9-eGFP-P65-siRNA可以缓解高血压诱导的AAC大鼠心肌纤维化发生。敲减基因表达可减轻压力超负荷大鼠左心室纤维化和细胞凋亡程度,其机制与调节NF-κB通路,减少炎症反应有关。
重组腺相关病毒血清型9;P65蛋白;高血压;心肌纤维化;细胞凋亡
心肌肥厚是多种心血管疾病,如高血压和心肌梗死等发生发展过程共有的病理特征,其主要的病理生理变化包括心肌细胞体积增大、心肌成纤维细胞活化并导致细胞外基质合成增加等。心肌肥厚是一种代偿性变化,但随着心肌肥厚逐渐发展,最终会出现失代偿而导致心力衰竭的发生[1]。随着高血压患者日益增加,压力超负荷性心功能不全也引起人们的关注。越来越多的研究表明,NF-κB信号通路在心力衰竭、冠心病和高血压等多种心血管疾病中发挥着重要作用[2],下调NF-κB信号通路可缓解心血管疾病病理表现[3-4]。P65作为NF-κB的重要组成部分,被证明可促进心力衰竭的不良重塑和凋亡[5-6],有可能是涉及心肌异常的心血管炎性疾病的共同发生发展环节。本课题组前期在细胞实验中证实了P65与心肌细胞重塑的相关性,因此,本研究通过腹主动脉缩窄术(abdominal aortic coarctation, AAC)构建压力超负荷诱导的心肌肥厚大鼠模型,采用重组腺相关病毒血清型9 (recombinant adeno-associated virus serotype 9, rAAV9)介导RNA干扰技术下调基因的表达,观察其对压力超负荷大鼠左心纤维化和凋亡的影响,为临床压力超负荷所致心功能不全治疗策略提供新思路。
材料和方法
1 实验动物、试剂和仪器
选取6周龄、体重20~24 g SPF级雄性SD大鼠,饲养环境温度恒定(22±2)℃、湿度恒定(55±5)%由新疆医科大学实验动物中心[生产许可证号为SCXK(新)2018-0001]提供。所有操作程序经过动物伦理委员会批准。
rAAV9-eGFP-P65-siRNA病毒的构建包装纯化由Virovek完成; Masson三色染色试剂盒购自Solarbio;细胞质蛋白/核蛋白抽提试剂盒、BCA蛋白定量分析试剂盒和ELISA试剂盒购自Sigma;抗体购自Cell Signaling Technology; TUNEL试剂盒购自Roche。高速低温离心机购自Eppendorf; CKX41倒置显微镜购自Olympus。
2 实验方法
2.1动物模型的建立与分组将实验动物分为4组:假手术(sham)组、AAC、AAC+rAAV9-eGFP组和AAC+rAAV9-eGFP-P65-siRNA组。SPF级雄性SD大鼠适应性喂养1周后,给予10%水合氯醛麻醉,待大鼠麻醉后仰面固定于操作台。消毒备皮,正中线逐层打开腹腔,分离腹主动脉,仔细分离腹主动脉,用21G针头(直径0.7 mm)平行放置于腹主动脉上,将4号手术线从腹主动脉背侧穿出,共同结扎针头和腹主动脉后迅速移去针头,形成腹主动脉50%~70%缩窄,逐层关闭腹腔。sham组不结扎手术线。术后3 d对AAC大鼠分别通过尾静脉注射生理盐水、rAAV9-eGFP和rAAV9-eGFP-P65-siRNA。饲养4周后进行相关指标的测定。
2.2大鼠血流动力学检测将动物固定在实验台上,分离出一侧的颈总动脉约1cm。插管前将导管和压力换能器内充满0.3%肝素生理盐水注射液,排走气泡,并且准备好记录仪器。然后先将颈总动脉远心端结扎,近心端用动脉夹夹住,在远心端结扎处的动脉壁上用眼科剪刀以45°角度剪口,将准备好的颈总动脉插管向近心端插入约1cm,用近心端的穿线结扎动脉血管和导管,松开动脉夹将导管再送入,记录各项指标。用BL-420F生物信号采集处理系统,记录收缩压(systolic blood pressure, SBP),舒张压(diastolic blood pressure, DBP),左室内压最大上升和下降速率(±d/dmax)。
2.3心脏组织HE染色及心肌Masson染色大鼠称重后立即处死并取出心脏,在冰生理盐水中洗净血液,滤纸吸干,沿房室交界处去除左右心房,再剪去右心室游离壁,保留左心室称出左心室质量(left ventricular weight, LVW)。称重后将心脏标本置于4%多聚甲醛固定24 h,石蜡包埋切片,脱蜡,常规HE染色,封片,显微镜下观察病理改变。心肌组织Masson染色:组织切片脱蜡至水,依据Masson染色试剂盒说明书添加染液,分化、脱水、透明、封片。显微镜下观察胶原沉积,使用Image-Pro Plus软件,计算胶原容积分数(collagen valume fraction, CVF),判断心肌纤维化程度。
2.4TUNEL法分析心肌细胞凋亡率取小鼠左心室组织制作石蜡切片(4 μm),行TUNEL染色,明场下400倍随机拍照,人工计数TUNEL阳性细胞的比例,以评估心肌细胞凋亡率。
2.5Western blot检测心肌细胞 P65和cleaved caspase-3的蛋白水平取40 μg各组左室心肌匀浆蛋白样品,用SDS-PAGE分离,然后转至PVDF膜上,于5%牛血清白蛋白中室温封闭1 h;再用抗P65抗体、抗cleaved caspase-3抗体和抗GAPDH抗体(1∶1 000)孵育,于4℃过夜;洗膜后再用Ⅱ抗孵育(37℃,1 h),再次洗膜后发光并使用Image Lab软件分析结果。目的蛋白相对表达量=目的蛋白灰度值/内参照蛋白灰度值。
2.6ELISA检测TNF-α和IL-6的含量4周后,取大鼠腹主静脉血5 mL,离心后分离血清,严格按照ELISA试剂盒说明书操作,取出实验板条,加入标准品及待测血清样品,37℃孵育2 h,PBS洗板,加入检测A溶液100 μL至各孔,37℃孵育1 h;弃去孔内液体,加入检测B溶液100 μL至各孔,37℃孵育30 min,弃去孔内液体,洗板,加入底物TMB,覆膜避光37℃孵育20 min,每孔加入50 μL终止液,混匀后在酶标仪450 nm波长处测量各孔的吸光度()值。
3 统计学处理
采用SPSS 19.0统计软件进行统计分析。参数以均数±标准差(mean±SD)表示。所有数据进行正态性和方差齐性检验,组间均数比较采用单因素方差分析,多重比较用LSD检验。以<0.05为差异有统计学意义。
结果
1 rAAV9-eGFP-P65-siRNA转染效率的鉴定
对术后大鼠分别静脉注射生理盐水、rAAV9-eGFP和rAAV9-eGFP-P65-siRNA,4周后分别取4组大鼠心肌组织,Western blot检测P65蛋白在心肌中的表达,AAC组大鼠心肌组织中P65表达水平明显高于假手术组(<0.05);静脉注射rAAV9-EGFP- P65-siRNA后,大鼠心肌组织P65的表达,发现P65表达水平较AAC组和AAC+rAAV9-eGFP组显著降低(<0.05),见图1。
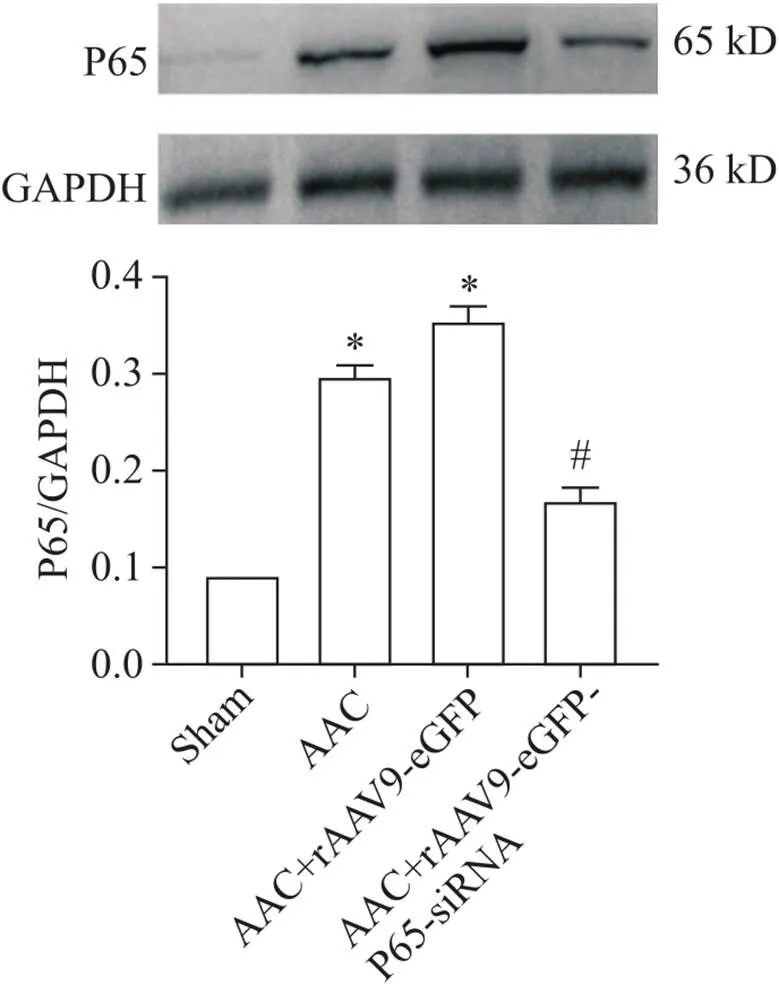
Figure 1. The results of Western blot for determining the protein levels of P65. Mean±SD. n=3. *P<0.05 vs sham group; #P<0.05 vs AAC group.
2 各组大鼠血流动力学比较
术后4周测定大鼠动脉血压。与假手术组相比, AAC组的SBP和DBP上升(<0.05),左室压力最大上升速率及左室压力最大下降速率均有明显下降(<0.05);与AAC组相比, AAC+rAAV9-eGFP-P65-siRNA组的+d/dmax和-d/dmax明显上升(<0.05),见表1。
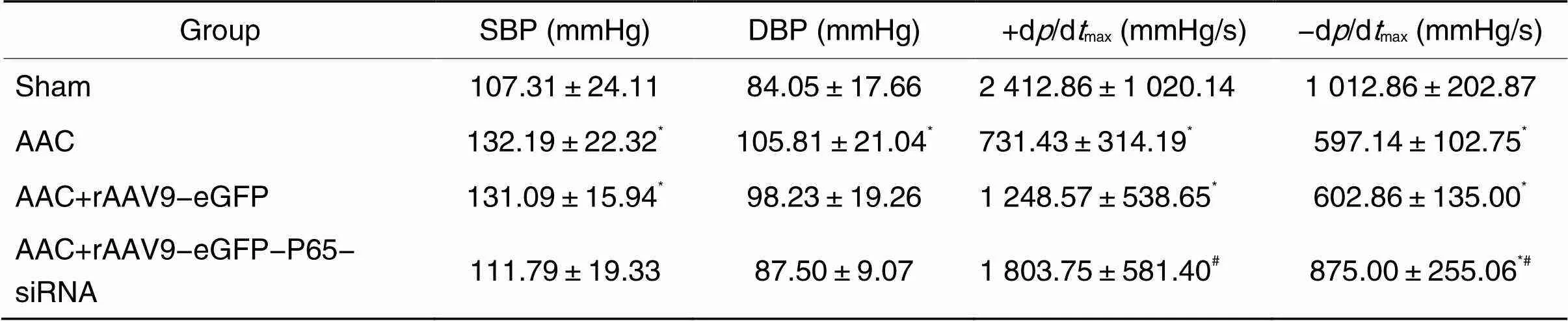
表1 血流动力学结果
*<0.05sham group;#<0.05AAC group.
3 各组大鼠左心室质量指数比较
术后4周测定体重(body weight, BW)和左心室重。与假手术组相比,AAC组、AAC+rAAV9-eGFP-P65-siRNA组及AAC+rAAV9-eGFP组大鼠的体重差异无统计学意义(>0.05)。与假手术组比, AAC组和AAC+rAAV9-eGFP组的左心室质量指数升高(<0.05);与AAC组比,AAC+rAAV9-eGFP-P65-siRNA组的左心室质量指数降低(<0.05),见表2。
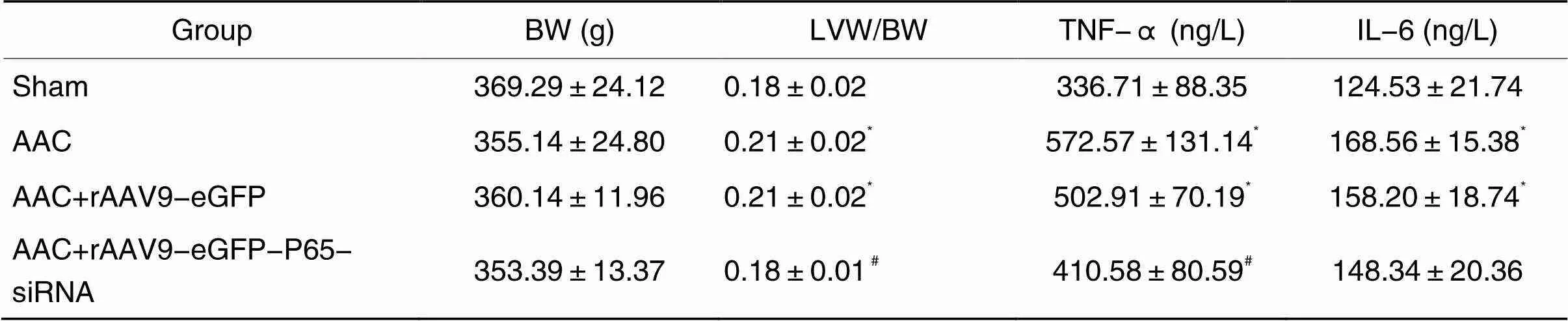
表2 体重、左心室指数及血清TNF-α与IL-6的检测结果
*<0.05sham group;#<0.05AAC group.
4 各组大鼠左心HE染色和心室壁厚度比较
术后4周取心室测量心室壁厚度后取部分左心包埋切片后行HE染色。与假手术组比,AAC组和AAC+rAAV9-eGFP组左心室壁明显增厚,HE染色显示心肌横截面积明显增大,而AAC+rAAV9-eGFP-P65-siRNA组与假手术组则无明显差异;与ACC组比,AAC+rAAV9-eGFP-P65-siRNA组的心室壁厚度明显降低,HE染色显示心肌横截面积降低,而AAC+rAAV9-eGFP组心肌横截面积则无明显变化,见图2。
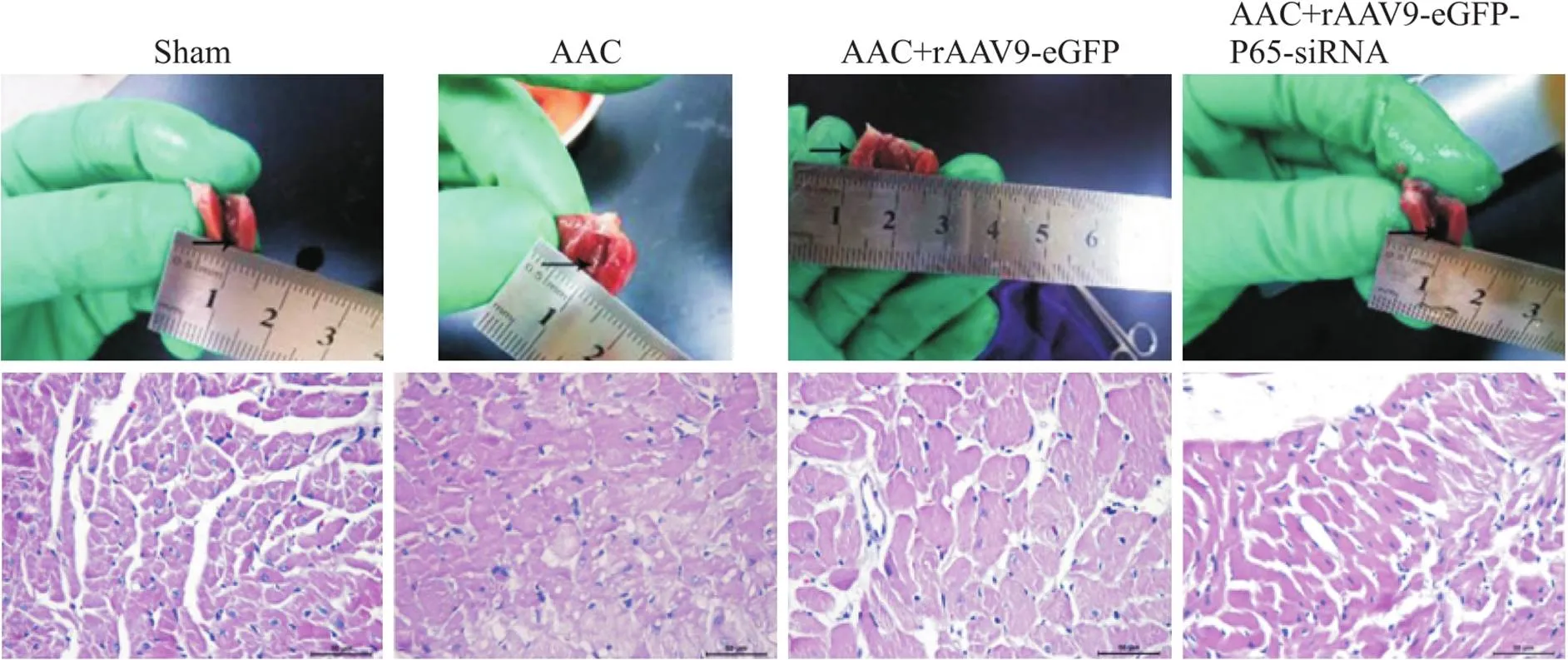
Figure 2. The results of HE staining. Scale bar=50 μm.
5 各组大鼠左心Masson染色的比较
术后4周取部分左心包埋切片后行Masson染色。使用Image-ProPlus软件,计算胶原容积分数。显微镜下,心肌组织为红色,胶原纤维为蓝色。CVF=胶原纤维染色面积/切片总面积×100%。与假手术组相比,AAC组和AAC+rAAV9-eGFP组大鼠心肌细胞可见大量蓝色胶原纤维沉积,出现明显的心肌纤维化,CVF 明显升高(<0.05);与AAC组相比,AAC+rAAV9-eGFP-P65-siRNA组大鼠心肌细胞胶原沉积明显减少,心肌纤维化程度降低,CVF明显降低(<0.05),而AAC+rAAV9-eGFP组CVF则无明显变化,差异无统计学意义(>0.05),见图3。
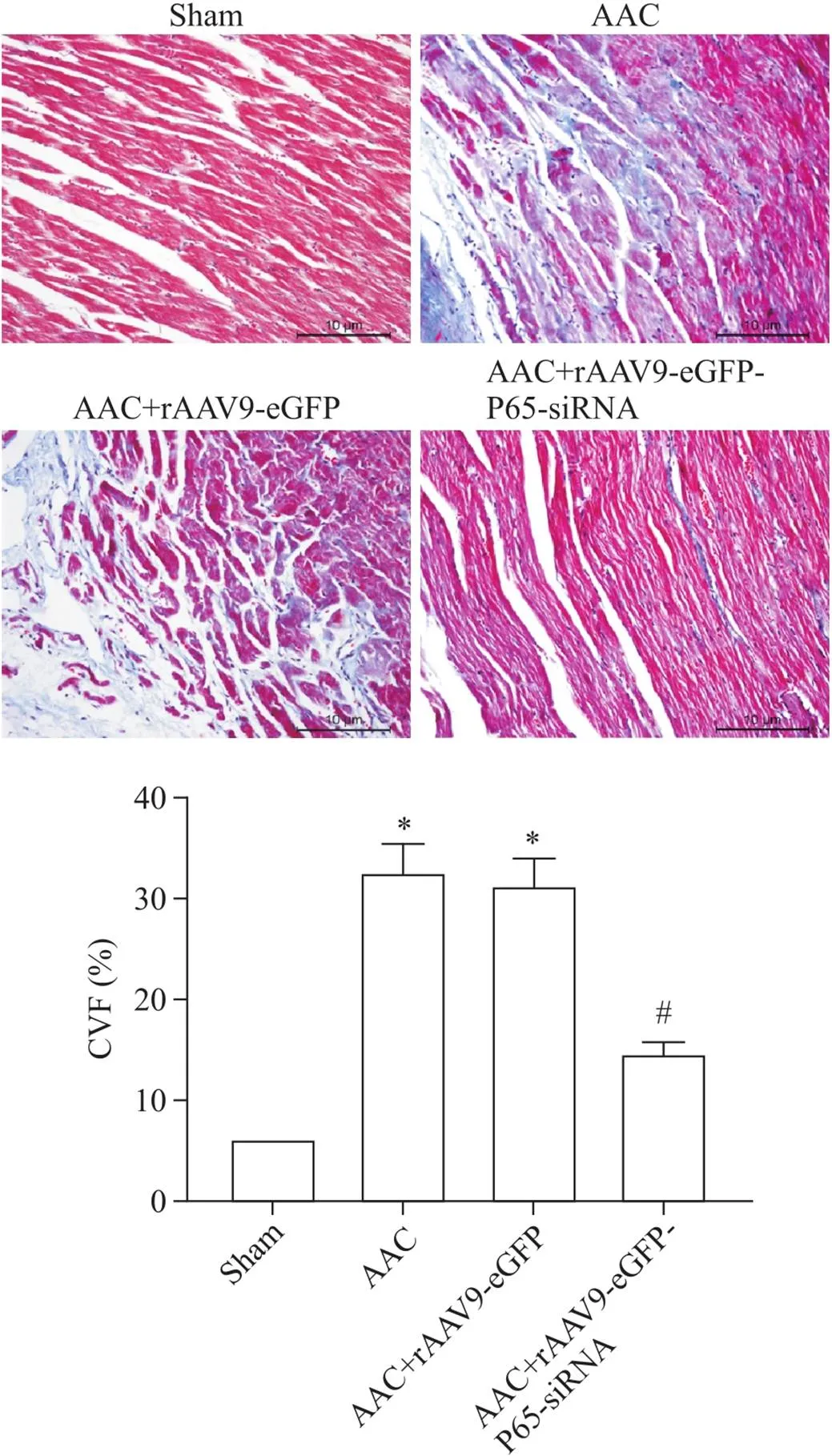
Figure 3. The results of Masson staining.The scale bar=10 μm. Mean±SD.n=9.*P<0.05 vs sham group; # P<0.05 vs AAC group.
6 TUNEL法检测各组大鼠左心凋亡心肌细胞数量的比较
术后4周取部分左心包埋切片后行TUNEL染色,高倍显微镜下计数凋亡阳性细胞数量所占百分比。与假手术组相比,AAC组和AAC+rAAV9-eGFP组的凋亡细胞数占总细胞的比例明显增大(<0.05);与AAC组相比,AAC+rAAV9-eGFP-P65-siRNA组凋亡细胞数所占总细胞比例明显降低(<0.05),而AAC+rAAV9-eGFP组的凋亡细胞数占总细胞的比例则无明显变化,差异无统计学显著性(>0.05),见图4。
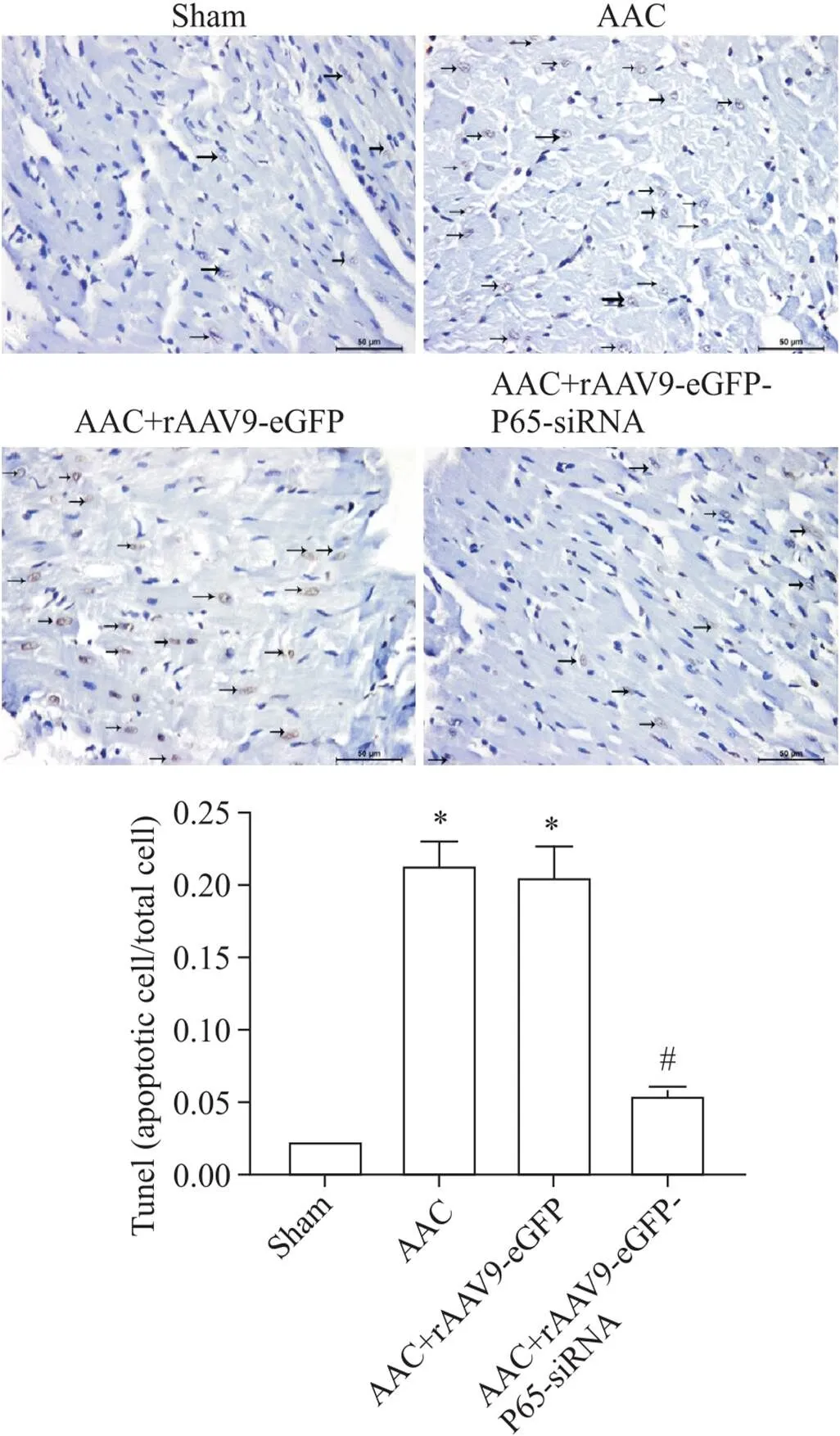
Figure 4. The results of TUNEL staining.The scale bar=50 μm.Mean±SD.n=9.*P<0.05 vs sham group; # P<0.05 vs AAC group.
7 Western blot检测cleaved caspase-3蛋白在心肌中的变化
与假手术组相比,AAC组和AAC+rAAV9-eGFP组的cleaved caspase-3蛋白水平明显升高(<0.05);与AAC组相比,AAC+rAAV9-eGFP-P65-siRNA组的cleaved-caspase-3蛋白水平降低,差异有统计学意义,(<0.05),而AAC+rAAV9-eGFP组的cleaved caspase-3蛋白水平无显著变化(>0.05),见图5。
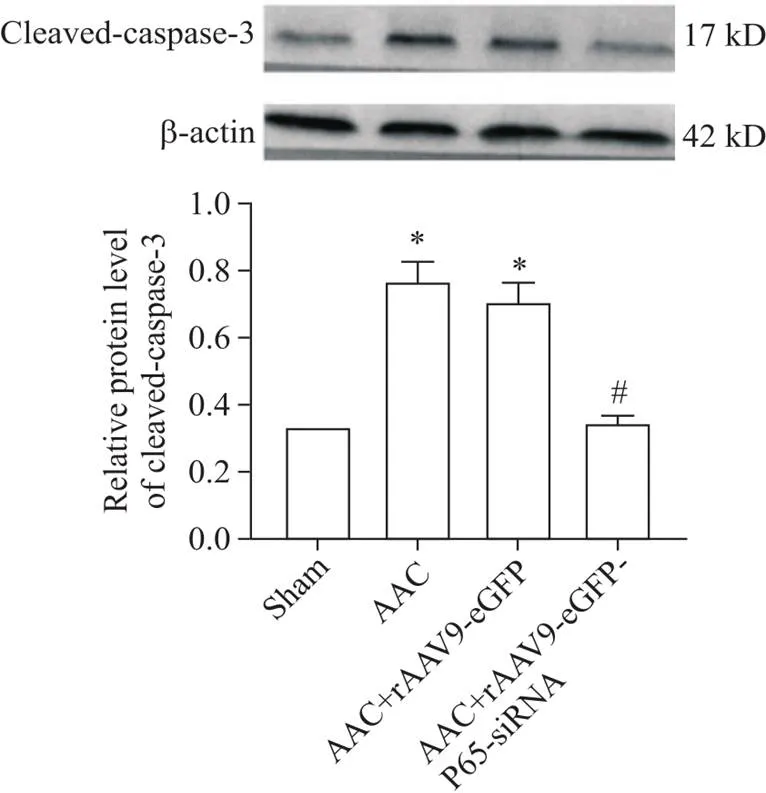
Figure 5. The results of Western blot for determining the protein levels of cleaved caspase-3.Mean±SD.n=3.* P<0.05 vs sham group;#P<0.05 vs AAC group.
8 ELISA检测各组大鼠血清TNF-α和IL-6含量的比较
与假手术组相比,AAC组与AAC+rAAV9-eGFP组的TNF-α含量均有明显升高(<0.05);AAC+rAAV9-eGFP-P65-siRNA组与AAC组相比,TNF-α明显降低(<0.05)。与假手术组相比,AAC组、AAC+rAAV9-eGFP组的IL-6水平均有明显升高(<0.05);AAC+rAAV9-eGFP-P65-siRNA组与AAC组相比,IL-6含量的差异无统计学显著性(>0.05),见表2。
讨论
心肌肥厚是压力负荷过重的情况下,心肌总量增加,收缩力加强,使心脏得以维持正常的血循环的一种代偿功能。但这种代偿功能也有其不利之处,主要因为肥大的心肌需氧增加,而冠状动脉的供血量往往不能予以满足,造成心肌缺血,这将最后导致心力衰竭的发生[7- 8]。虽众多研究表明NF-κB信号通路的激活与心肌肥厚等多种心血管疾病有着密切的联系[9- 10],但其中的分子机制却始终有待探索。在NF-κB信号通路激活中,被称为NF-κB的p50/P65异源二聚体发挥主要的生理作用[11],且与心血管疾病密切相关[12]。有研究表明P65含有DNA结合域负责结合启动子改变下游基因转录,下调P65后可提高心肌细胞抗氧化的能力[10]。本研究中压力超负荷组大鼠P65含量明显高于正常组。因此,P65很可能成为治疗压力超负荷性心功能不全的有效靶标。
高血压是心血管疾病最普遍的病理刺激因素之一[13],因此压力负荷型模型常用于心血管疾病的研究[14],其中腹主动脉缩窄模型为压力负荷模型中较为理想的一种。有研究证实rAAV9-eGFP对心肌有极强的靶向亲和力,可长期稳定地表达外源基因[15]。高效特异性的RNAi 技术作为新兴的基因阻断技术具有传统反义技术无可比拟的优势。据此,本研究通过建立腹主动脉缩窄模型复制压力超负荷动物模型,观察rAAV-9 介导 siRNA 靶向干预大鼠心肌细胞基因表达载体对压力超负荷大鼠左心室的影响。本研究中,行腹主动脉结扎术后4周大鼠与正常组比较,表现明显呼吸困难、收缩压和舒张压明显上升、左心室心功能明显下降、心脏肥大,左心室纤维化严重,心肌凋亡明显。与假手术组比较感染rAAV9-eGFP-P65-siRNA组大鼠左心室P65含量明显降低,表明腺相关病毒介导的RNA干扰技术能有效沉默。
本研究发现,与未感染和感染rAAV9-eGFP组大鼠相比,感染rAAV9-eGFP-P65-siRNA组大鼠左室压力最大上升速率和左室压力最大下降速率均明显上升、左心室质量指数下降,胶原沉着减少,心肌凋亡数量减少。这说明干预大鼠心肌细胞基因表达可改善压力超负荷大鼠左心室功能,缓解心脏肥大、心肌纤维化并减少心肌凋亡,对压力超负荷大鼠左心功能具有保护作用。
越来越多的研究表明,NF-κB信号通路的激活会导致严重的炎症,从而导致组织损伤,引起器官功能障[16-17]。抑制NF-κB信号通路活性可抑制炎性细胞因子,如TNF-α和IL-6的释放[18]。炎症反应被证明在心力衰竭等心血管疾病的发病机制中起着关键作用[19]。因此抑制大鼠心肌细胞基因可能通过抑制炎症细胞因子的释放进而缓解压力超负荷大鼠各种病理表现。本研究发现,与未感染和感染rAAV9-eGFP组大鼠相比,感染rAAV9-eGFP-P65-siRNA组大鼠血清中TNF-α含量明显下降,而IL-6则无统计学意义的变化。表明抑制大鼠心肌细胞基因可能通过抑制炎性细胞因子TNF-α的释放,进而对压力超负荷大鼠左心功能起到保护作用。
有研究表明心肌细胞敲除可促进压力过负荷引起的心肌肥大并向心衰发展[20]。在该研究中选用的动物模型为12周龄,且压力过载6周的经多次杂交而形成的心肌细胞特异性无P65表达的小鼠。此种动物模型虽有较强的心肌P65缺失特异性,但大周龄且长时间的压力过载更利于氧化应激的形成从而加剧不可逆性心肌损伤及心力衰竭的严重程度从而触发相关信号通路对P65的调节功能有一定影响;此外,经多次杂交后的小鼠模型的生理特性与本实验选用SD大鼠有一定差异。本实验中选用6周龄压力过载4周大鼠和对心肌有较强靶向作用的rAAV9-eGFP靶向干预P65,虽一定程度上减轻了氧化应激所致的不可逆心肌损伤及触发相关通路的干扰却不足以形成心力衰竭,且P65降低对其它组织的影响及对其他组织与心肌间影响的相互作用还有待进一步研究。
综上所述,本研究采用9型腺相关病毒介导的RNA干扰技术建立的P65低表达压力超负荷动物模型实验,提示重组腺相关病毒rAAV-9 介导 siRNA 靶向干预大鼠心肌细胞基因表达可改善压力超负荷大鼠左心室功能,缓解心脏肥大、心肌纤维化,其机制可能与抑制炎症细胞因子TNF-α的释放相关。
[1] Sorrentino MJ. The evolution from hypertension to heart failure[J]. Heart Failure Clinics, 2019, 15(4): 447-453.
[2] Diogo GB, Marina F, José G, et al. Nuclear factor (NF) κB polymorphism is associated with heart function in patients with heart failure[J]. BMC Med Genet, 2010, 11:89.
[3] Han A, Lu Y, Zheng Q, et al. Qiliqiangxin attenuates cardiac remodeling via inhibition of TGF-β1/Smad3 and NF-κB signaling pathways in a rat model of myocardial infarction[J]. Cell Physiol Biochem, 2018, 45(5):1797-1806.
[4] Kumar P,Gogulamudi V, Periyasamy R, et al. Inhibition of HDAC enhances STAT acetylation, blocks NF-κB, and suppresses the renal inflammation and fibrosis inhaplotype male mice[J]. Am J Physiol Renal Physiol, 2017, 313(3):F781-F795.
[5] Hamid T, Guo SZ, Kingery JR, et al. Cardiomyocyte NF-κB P65 promotes adverse remodelling, apoptosis, and endoplasmic reticulum stress in heart failure[J]. Cardiovasc Res, 2011, 89(1):129-138.
[6]邢梦瑶,马小娟,巩雪俐,等. 9型腺相关病毒介导RNA干扰抑制基因表达对血管紧张素Ⅱ诱导H9c2细胞凋亡的影响[J]. 中国病理生理杂志, 2018,34(11):2101-2105.
Xing MY, Ma XJ, Gong XL, et al. Adeno-associated virus type 9-mediatedsilencing inhibits angiotensin Ⅱ-induced apoptosis of H9c2 cells[J]. Chin J Pathophysiol, 2018, 34(11):2101-2105.
[7] Li Q, Wei GC, Tao T. Leukocyte immunoglobulin-like receptor B4 (LILRB4) negatively mediates the pathological cardiac hypertrophy by suppressing fibrosis, inflammation and apoptosis via the activation of NF-κB signaling[J]. Biochem Biophys Res Commun, 2019, 509(1):16-23.
[8]张飞飞,赵士霞,郝清卿,等. 心脏收缩力调节对慢性心力衰竭兔心室肌电重构的影响[J]. 中国病理生理杂志, 2020, 36(3):547-551.
Zhang FF, Zhao SX, Hao QQ, et al. Effects of cardiac contractility modulation on ventricular electrical remodeling in rabbits with chronic heart failure[J]. Chin J Pathophysiol, 2020, 36(3):547-551.
[9] Liu G, Zhang H, Hao F, et al. Clusterin reduces cold ischemia-reperfusion injury in heart transplantation through regulation of NF-κB signaling and Bax/Bcl-xL expression[J]. Cell Physiol Biochem, 2018, 45(3):1003-1012.
[10] Tran DH, May HI, Li Q, et al. Chronic activation of hexosamine biosynthesis in the heart triggers pathological cardiac remodeling[J]. Nat Commun, 2020, 11(1):1771.
[11] 马莉,杨兰,陈天铎,等. 核因子-κB与心力衰竭的关系[J]. 中国循环杂志, 2002, 17(4):315-316.
Ma L, Yang L, Chen TZ, et al. Relationship between nuclear factor-κB and heart failure[J]. Chin Circ J, 2002, 17(4):315-316.
[12] van der Heiden K, Cuhlmann S, Luong le A, et al. Role of nuclear factor κB in cardiovascular health and disease[J]. Clin Sci(Lond), 2010, 118(10):593-605.
[13] Slivnick J, Lampert BC. Hypertension and heart failure[J]. Heart Fail Clin, 2019, 15(4):531-541.
[14] Di Palo KE, Barone NJ. Hypertension and heart failure: prevention, targets, and treatment[J]. Heart Fail Clin, 2020, 16(1):99-106.
[15] 翔马,姚永钊,陈邦党. 9型腺相关病毒转染乳鼠心肌细胞的可行性及安全性[J]. 中国组织工程研究, 2012, 16(2):277-281.
Xiang M, Yao YZ, Chen BD. Feasibility and safety of adeno-associated virus serotype 9 transfection of neonatal rat cardiomyocytes[J]. Chin J Tissue Eng Res, 2012, 16(2):277-281.
[16] Abdel-Daim M, Khalil SR, Awad A, et al. Ethanolic extract of moringa oleifera leaves influences NF-κB signaling pathway to restore kidney tissue from cobalt-mediated oxidative injury and inflammation in rats[J]. Nutrients, 2020, 12(4):1031.
[17] Zhang Q, Lenardo MJ, Baltimore D. 30 Years of NF-κB: A blossoming of relevance to human pathobiology[J]. Cell, 2017, 168(1/2):37-57.
[18] Zhao C, Wang Y, Yuan X, et al. Berberine inhibits lipopolysaccharide-induced expression of inflammatory cytokines by suppressing TLR4-mediated NF-κB and MAPK signaling pathways in rumen epithelial cells of Holstein calves[J]. J Dairy Res, 2019, 86(2):171-176.
[19] Sorriento D, Iaccarino G. Inflammation and cardiovascular diseases: the most recent findings[J]. Int J Mol Sci, 2019, 20(16):3879.
[20] Javan H, Szucsik AM, Li L, et al. Cardiomyocyte P65 nuclear factor-κB is necessary for compensatory adaptation to pressure overload[J]. Circ Heart Fail, 2015, 8(1):109-118.
Effects of rAAV9-mediated siRNA forknockdown on myocardial fibrosis and apoptosis in rats with pressure overload
WANG Xu-yue, BAO Ya-li, ZHANG Tian, LING Chan, WANG Yi-ping, WU Zhen-hong, SUN Zhan
(,830011,)
To investigate the effect ofgene knock-down mediated by recombinant adeno-associated virus serotype 9 (rAAV9) on the cardiac function of pressure overload rat and its possible mechanism.The rat model of left ventricular hypertrophy was established by abdominal aortic coarctation(AAC). SD rats were randomly divided into sham operation group, AAC group, AAC+rAAV9-eGFP group and AAC+rAAV9-eGFP-P65-siRNA group. The abdominal cavity was closed directly after laparotomy in the rats of sham operation group, the abdominal cavity was closed after ligation of the abdominal aorta in the rats of AAC group, and normal saline, rAAV9-eGFP and rAAV9-eGFP-P65-siRNA were injected into the tail vein 3 d after operation. After 4 weeks, the hemodynamic indexes were measured, the heart mass parameters were calculated, the degree of myocardial fibrosis was detected by Masson staining, the expression level of myocardial P65 was detected by Western blot, the degree of apoptosis was detected by TUNEL staining, and the serum contents of tumor necrosis factor-α (TNF-α) and interleukin-6 (IL-6) of the rats in each group were measured by ELISA.The expression of P65 in AAC group and AAC+rAAV9-eGFP group was higher than that in sham operation group, while the expression of P65 in AAC+rAAV9-eGFP-P65-siRNA group was significantly lower than that in AAC group. The levels of systolic blood prossure (SBP), diastolic blood pressure (DBP), left ventricular weight/body weight (LVW/BW), cardiomyocyte apoptotic rate and TNF- α and IL-6 in AAC group and AAC+rAAV9-eGFP group were higher than those in sham operation group, while SBP, DBP, LVW/BW, cardiomyocyte apoptosis rate and TNF-α in AAC+rAAV9-eGFP-P65-siRNA group were significantly lower than those in AAC group. The results of Masson staining showed that the deposition of collagen in cardiac tissue in AAC group and AAC+rAAV9-eGFP group was higher than that in sham operation group, and treatment with rAAV9-eGFP-P65-siRNA alleviated hypertension-induced fibrosis.Knockdown ofgene reduces the degree of left ventricular fibrosis and apoptosis in rats with stress overload, and its mechanism is related to the regulation of NF-κB pathway and the reduction of inflammatory response.
Recombinant adeno-associated virus serotype 9; P65 protein; Hypertension; Heart failure; Myocardial fibrosis; Apoptosis
R542.2+3; R363.2
A
10.3969/j.issn.1000-4718.2020.11.003
1000-4718(2020)11-1938-07
2020-07-16
2020-10-27
国家自然科学基金资助项目(No.81560078);新疆维吾尔自治区自然科学基金资助项目(No.2019D01C207)
Tel: 0991-4365064; E-mail: sunzhan724@126.com
(责任编辑:宋延君,余小慧)
