短乳杆菌鸟氨酸氨甲酰基转移酶的重组表达及其性质研究
2020-12-01方若思周澄笑金诚豫张一维黄温迪吕常江肖功年龚金炎陈启和
方若思 周澄笑 金诚豫 张一维 黄温迪 黄 俊 吕常江 肖功年 龚金炎 陈启和
(1 浙江科技学院 杭州310023 2 浙江省农产品化学与生物加工技术重点实验室 杭州310023 3 浙江大学 杭州310058)
鸟氨酸氨甲酰转移酶(OTCase/OTC,EC 2.1.3.3) 是瓜氨酸合成代谢中的一个关键酶,广泛存在于动、植物与微生物中,分布于生物生长发育的各个阶段。在原核生物和真菌中,OTCase 是一种双功能酶,不仅可催化瓜氨酸的合成,也催化瓜氨酸的降解[1-2];在植物中,它是尿素循环第1 步反应的催化酶,催化鸟氨酸和氨甲酰磷酸反应合成瓜氨酸和磷酸盐[3];在动物中,OTCase 主要参与尿素循环,是尿素循环的关键酶之一;在人体内,OTCase是肝脏尿素循环的必需酶,OTCase 的缺失常导致嗜睡、呕吐、精神发育迟缓等症状,同时OTCase的缺失与否也可作为肝细胞癌的早期诊断指标之一[4-5]。
鸟氨酸氨甲酰基转移酶参与乳酸菌精氨酸代谢途径的关键一步,即将瓜氨酸分解成为鸟氨酸和氨甲酰磷酸。瓜氨酸是一种非蛋白质氨基酸,因最先从西瓜中获取而得名[6]。研究表明,瓜氨酸对于男性性功能障碍、高血压和冠心病具有一定疗效,并可作为人体NO 产生的评价因子,且在脑血流的调节,提高身体免疫力和美容护肤中具有重要的作用[7-10]。
除上述优点外,瓜氨酸也是发酵食品中氨基甲酸乙酯的重要前体物[11-12]。氨基甲酸乙酯(简称EC,又称脲烷),是一种在试验动物甚至人体内造成多位点致癌的物质,2007年国际癌症研究机构认定EC 为2A 类致癌物质,与丙烯酰胺同等危险。EC 存在于多种发酵食品,尤其是发酵的酒精饮料中,如葡萄酒、黄酒、日本清酒等[13-14]。
酒类中的瓜氨酸主要来自精氨酸降解。在乳酸菌中,精氨酸的降解通过精氨酸脱亚胺酶途径(arginine deiminase pathway,ADI pathway)完成。在这一途径中,包含3 个关键酶:精氨酸脱亚胺酶(ADI,arginine deiminase,EC 3.5.3.6)、鸟氨酸氨甲酰转移酶 (OTC,ornithine transcarbamylse,EC 2.1.3.3) 和氨基甲酸激酶(CK,carbamatekinase,EC 2.7.2.2)[15],它们分别由arcA、arcB 和arcC 基因编码[16],如图1所示。

图1 乳酸菌中精氨酸的代谢途径Fig.1 Arginine metabolic pathway in LAB
目前,对精氨酸脱亚胺酶的研究较为透彻,而对鸟氨酸氨甲酰基转移酶的研究仍为空白。寻找更加安全有效的OTCase 具有重要的研究价值。
乳杆菌是一类革兰氏阳性兼性厌氧菌,在含碳水化合物的动物及植物发酵产品以及温血类动物的消化系统中十分常见,作为一般认为安全(Generally recognized as safe,GRAS)的食品级微生物,在食品、工业、农牧业及医药等领域中亦拥有重要的应用价值。挖掘益生性乳酸菌源的各种酶类是目前人们的关注点之一。短乳杆菌(Lactobacillus brevis) 是乳杆菌属中一种非常重要的菌种,根据NCBI 数据库显示短乳杆菌中无疑存在着具有生物活性的OTCase。获取并研究短乳杆菌的OTCase 酶学性质,将为探索其应用价值奠定基础。
1 材料和方法
1.1 试验材料
1.1.1 菌株和质粒 短乳杆菌(Lactobacillus brevis),由浙江大学食品微生物重点实验室保存;大肠杆菌BL21(DE3),购自全试金公司;质粒pET-28a,由浙江科学院保存。
1.1.2 主要试剂 细菌基因组提取试剂盒、PCR产物回收试剂盒、琼脂糖凝胶回收试剂盒、质粒DNA 提取试剂盒、L-精氨酸、DL-鸟氨酸、茚三酮、异丙基-β-D-硫代吡喃半乳糖苷(IPTG)、硫酸卡那霉素(Kan)、Ni-NTA 琼脂糖树脂,购自生工生物工程(上海)股份有限公司;T4 DNA 连接酶、限制性内切酶BamHI、SalI,购自TaKaRa 公司,
1.1.3 培养基
1)LB 培养基 酵母提取物5 g/L,胰蛋白胨10 g/L,NaCl 10 g/L,pH 7.0,用于大肠杆菌的培养。
2)MRS 培养基 蛋白胨10 g/L,牛肉浸粉5 g/L,酵母浸粉4 g/L,葡萄糖20 g/L,吐温80 1 g/L,磷酸氢二钾2 g/L,乙酸钠5 g/L,柠檬酸三胺2 g/L,硫酸镁0.2 g/L,硫酸锰0.05 g/L,pH 6.2,用于短乳杆菌的培养。
1.2 鸟氨酸氨甲酰基转移酶的克隆
短乳杆菌鸟氨酸氨甲酰基转移酶的正向引物序列:5’-cgcggatccATGACTAAGGATTTTCGGGAA AATGTA-3’(下划线为BamHI 识别序列);反向引物 序 列:5’-acgcgtcgacTTAAGCTCGTGGAATGAA TAAGTTACCT-3’(下划线为SalI 识别序列)。以短乳杆菌的基因组DNA 为模板,进行鸟氨酸氨甲酰基转移酶的基因扩增,反应程序:98 °C 变性5 min,以98°C 20 s,55°C 15 s,72°C 20 s 反应35个循环后,72 °C 延伸7 min,最后冷却至4 °C。PCR 产物经1%琼脂糖凝胶电泳验证后采用PCR产物纯化试剂盒纯化。
1.3 重组表达质粒的构建
采用限制性内切酶BamHI 和SalI 分别对鸟氨酸氨甲酰基转移酶基因片段和载体pET-28a 进行双酶切。酶切产物经胶回收试剂盒回收,连接并转化大肠杆菌BL21(DE3)感受态细胞,涂布在含卡那霉素的LB 培养平板上,经菌落PCR 验证后,筛选得到阳性克隆,提取阳性克隆子DNA 后测序验证。
1.4 重组鸟氨酸氨甲酰基转移酶的诱导表达与分离纯化
挑取阳性单菌落接种于5 mL LB 培养基中,于37°C、200 r/min 振荡培养过夜。按体积分数1%接种量转接于200 mL LB 培养基中,继续于37°C、200 r/min 振荡培养,至OD600nm值在0.6~0.8时,加入异丙基-β-D-硫代吡喃半乳糖苷(IPTG),25°C、180 r/min 诱导培养过夜。
离心、收集菌体后,加入30 mL 缓冲液 (50 mmol/L NaH2PO4,300 mmol/L NaCl,20 mmol/L 咪唑pH 8.0) 重悬菌体,随后冰水浴超声破碎细胞,4°C、9 000/min 离心30 min,获得上清液。
Ni-NTA 琼脂糖树脂是螯合金属Ni2+而形成的一种亲和层析介质。该纯化介质对带有His-Tag的蛋白有专一的吸附能力,能使His-Tag 蛋白结合在Ni-NTA 亲和层析介质上,而没有结合的杂蛋白被洗涤掉。结合在介质上的蛋白经一定浓度的咪唑洗脱下来,得到高纯度的目的蛋白。参照Ni-NTA 琼脂糖树脂的使用说明,采用亲和层析纯化重组蛋白,随后用SDS-PAGE 检测蛋白纯度及分子质量。
1.5 重组鸟氨酸氨甲酰基转移酶活性的测定[17]
取125 μL 酶液与125 μL 10 mmol/L MnCl2在55 ℃下培养20 min,激活酶,加入250 μL 0.1 mol/L 精氨酸底物(pH 9.5),于37 ℃水解55 min。取样100 μL,加入300 μL 冰醋酸终止酶反应,最后加入100 μL 70 mmol/L 茚三酮进行比色测定,检测有无鸟氨酸形成。煮沸30 min 后测OD515nm值。根据鸟氨酸浓度标准曲线拟合方程计算酶液中鸟氨酸含量,蛋白含量采用Brandford 法测定。OTC 酶活定义为每分钟水解1 mg 蛋白质产生1 μmol 鸟氨酸所需的酶量(OTC)为1 个酶活单位。
1.6 重组鸟氨酸氨甲酰基转移酶的酶学性质研究
1.6.1 重组鸟氨酸氨甲酰基转移酶最适温度的测定 将酶液转移至离心管中,加入底物,分别置于25,35,45,55,65,75 ℃条件下反应,测定酶活。
1.6.2 重组鸟氨酸氨甲酰基转移酶热稳定性的测定 将酶液分别置于4,37,60 ℃中保温放置0,20,40 min,1,2,3 h 后进行反应,测定其活性。
1.6.3 重组鸟氨酸氨甲酰基转移酶最适pH 的测定 配制pH 5.5~11.5 的精氨酸底物,加入酶液,反应后测定酶活。
1.6.4 NaCl 和乙醇对酶活稳定性的影响 将纯化得到的酶液在不同NaCl 质量分数 (0%,2.5%,5%,10%,15%,18%,20%)的缓冲液中保温1 h,测定酶活,确定NaCl 对酶活稳定性的影响。将纯化的酶液在不同乙醇体积分数(0%,2.5%,5%,10%,15%,18%,20%)的缓冲液中保温1 h,测定酶活,确定乙醇对酶活稳定性的影响。
1.6.5 重组鸟氨酸氨甲酰基转移酶的动力学参数的测定 酶的米氏常数Km值,即酶促反应速度为最大反应速度的二分之一时的底物浓度,是酶的非常重要的动力学常数,表示酶与反应底物的结合能力。Km越小,结合能力越强,反之亦然。在pH 9.5,37 ℃条件下,以精氨酸为底物,分别测定重组ADI 在底物浓度为0.01~1 mol/L 时的反应速度,然后将试验数据按Lineweaver-Burk 双倒数法作图,求出酶的Km和Vmax。
2 试验结果
2.1 重组鸟氨酸氨甲酰基转移酶基因序列的测定结果
将构建并鉴定的重组质粒交由上海生工生物技术有限公司测序,结果该序列与短乳杆菌具有100%的相似性,表明重组鸟氨酸氨甲酰基转移酶构建成功。
2.2 重组鸟氨酸氨甲酰基转移酶的分离纯化
见图2。
2.3 重组鸟氨酸氨甲酰基转移酶的酶学性质
2.3.1 重组鸟氨酸氨甲酰基转移酶的最适反应温度 温度对酶活性的影响表现在两个方面:一是温度升高,提高了分子运动速率,从而增加了底物分子与酶蛋白的结合几率;二是温度影响酶蛋白分子的结构,当温度过高时易使蛋白变性失活,降低酶分子的催化效率。综上,温度对酶活性的影响是两个因素综合作用的结果。其它反应条件相同,在25~75 ℃范围,间隔10 ℃测定不同温度下的酶活性,结果见图3。
结果表明,重组鸟氨酸氨甲酰基转移酶的酶活随温度的升高而升高,在温度高于45 ℃后酶活的提高幅度较大,55 ℃时酶活达到最高值,随后急速下降。综上,此OTC 酶的最适反应温度为55℃。

图2 重组OTCase 纯化SDS-PAGE 电泳图Fig.2 SDS-PAGE analysis for the purified recombinant OTCase

图3 温度对重组OTCase 活性的影响Fig.3 Effects of temperature on activity of the recombinant OTCase
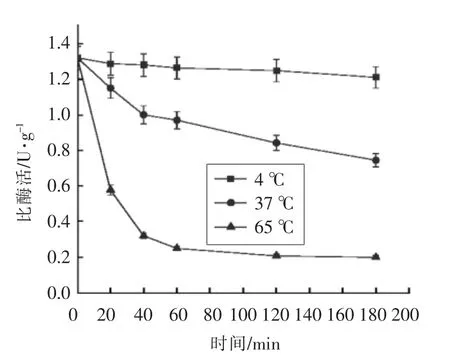
图4 不同温度下鸟氨酸氨甲酰基转移酶的稳定性Fig.4 Stability of the recombinant OTCase at different temperature
2.4 重组鸟氨酸氨甲酰基转移酶的热稳定性
重组鸟氨酸氨甲酰基转移酶在4 ℃放置3 h后活性差异不大,在37 ℃下放置3 h 仍保持50%以上的生物活性,然而,其在65 ℃下的半衰期仅为10 min,放置40 min 后已检测不到活性。
2.5 重组鸟氨酸氨甲酰基转移酶的最适pH 值
pH 值对酶活性的影响主要是酸性或碱性环境改变酶的空间结构。在其它反应条件相同的前提下,在pH 5.5~11.5 范围测定酶活性,结果见图5。
如图5所示,鸟氨酸氨甲酰基转移酶活性随pH值的变化而变化。当pH 5.5~6.5 时,随着pH 值的升高,酶活性升高,在pH 6.5 时酶活性达到最高值。当pH 高于6.5 后,酶活下降,在pH 11.0时,酶活力仅为最高值的1/6,表明此酶为酸性偏中性酶。
2.6 NaCl 和乙醇对重组鸟氨酸氨甲酰基转移酶活性稳定性的影响
发酵食品和饮料酒中普遍存在 NaCl 和乙醇,例如酱油中NaCl 质量分数为18%左右,黄酒、葡萄酒中乙醇体积分数为8%~15%。考察OTC酶对盐和乙醇的耐受性,有利于为其在发酵食品中的应用提供参考。

图5 pH 值对重组OTCase 活性的影响Fig.5 Effects of pH on activity of the recombinant OTCase
如图6可知,OTC 酶的活性随着乙醇、NaCl浓度的变化而变化。乙醇体积分数为5%时酶活性达到最高值,随着乙醇浓度的增加,酶活性也开始降低,但不明显,这表明该OTC 酶在含酒精的发酵食品或饮料中具有一定的应用潜力。而在NaCl质量分数为2.5%~5%时,酶活性随NaCl 浓度的增加而增加,在盐NaCl 5%时酶活性最高。随后在NaCl 质量分数为5%~20%时,酶活性随NaCl 浓度的增加而降低,NaCl 20%左右时酶活性最低。试验结果表明,即使在高盐浓度的反应体系中,OTC 酶活性受到的影响也不大,表明该酶在高浓度盐的溶液中具有一定的应用潜力。

图6 鸟氨酸氨甲酰基转移酶对乙醇和氯化钠的耐受性Fig.6 Effects of ethanol and NaCl on OTCase activity
2.7 重组鸟氨酸氨甲酰基转移酶的动力学参数
以精氨酸为底物,利用Lineweaver-Burk 双倒数法测定重组鸟氨酸氨甲酰基转移酶的米氏常数。重组酶的Km为1.58 mmol,Vmax为5.88 mmol/min。
3 结论
以短乳杆菌的基因序列为模板,通过分子克隆手段获得鸟氨酸氨甲酰基转移酶基因,以大肠杆菌为宿主进行重组表达,经Ni-NTA 亲和层析柱纯化获得重组蛋白,研究其酶学性质。重组鸟氨酸氨甲酰基转移酶最适温度为55°C,4 ℃下热稳定性优异,37 ℃下放置3 h 仍保持50%以上的生物活性。然而,在65 ℃放置40 min 后已检测不到酶活性。该酶的最适pH 值为6.5,在pH 值为碱性时,酶活力下降明显;5% NaCl 和5%乙醇时具有最高酶活性,而整体差异不明显,说明重组鸟氨酸氨甲酰基转移酶具有良好的耐盐和酒精耐受力。动力学参数Km和Vmax分别为1.58 mmol 和 5.88 mmol/min。由此可见,来源于短乳杆菌的鸟氨酸氨甲酰基转移酶具有良好的温度稳定性及耐盐、耐酒精能力,在酒类发酵中应用前景看好。
