南瓜色素的制备及抗氧化作用机制研究进展
2020-11-30胡炜陈天鉴钱颖聪林艺涵阮依莉张拥军
胡炜 陈天鉴 钱颖聪 林艺涵 阮依莉 张拥军
摘 要:南瓜中含有的南瓜色素是一类安全、着色力强且兼有营养保健功能的天然色素。笔者综述了南瓜色素的理化性质,包括南瓜色素的显色特点、脂溶性、稳定性与结构;南瓜色素提取与纯化的制备工艺,主要是β-胡萝卜素、α-胡萝卜素及叶黄素;南瓜色素的检测方法,包括分光光度法及色谱法;以及南瓜色素抗氧化性的作用机制及其在医药、保健领域的应用,并对南瓜色素分子结构鉴定方法、抗氧化应激作用的机制及结构与活性间的构效关系等提出展望,以期为南瓜色素的深化研究提供思路。
关键词:南瓜色素;理化性质;提取纯化;抗氧化
中图分类号:S642.1 文献标志码:A 文章编号:1673-2871(2020)09-001-06
Abstract: Pumpkin pigment is a kind of natural product with safety, strong coloring power and nutritional and health care functions. In this paper, the physical and chemical properties of pumpkin pigment were reviewed, covering the color characteristics, fat solubility, stability and structure, as well as the preparation process of extraction and purification of pumpkin pigment. Finally, the mechanism of antioxidation of pumpkin pigment and its application in the fields of medicine and health care were also reviewed. The prospect is put forward to provide ideas for deepening the exploration of pumpkin pigment.
Key words: Pumpkin; Pigment; Physicochemical properties; Extraction purification; Antioxidant
南瓜(Cucurbita)可分为中国南瓜(C. moschata D.)、印度南瓜(C. maxima D.)和美洲南瓜(C. Pepo D.)。其栽培历史悠久,根系发达,再生能力强,对土壤湿度无严格要求,适应性强,产量高,是世界范围内种植的经济重要物种。南瓜色素是一种少有的着色力强的理想天然色素,它克服了天然色素着色力不如人工合成色素的缺点,在很多方面能够得到应用。南瓜色素主要成分为脂溶性的类胡萝卜素,是使其果肉呈现强烈的黄色或橙色的原因。相较于同样应用于食品工业中的水溶性天然色素——花青素而言,类胡萝卜素具有抗氧化性的同时,着色力及稳定性都优于花青素[1-2]。虽然类胡萝卜素在蔬菜水果中很常见,但南瓜中的类胡萝卜素含量、种类都居于前列且较稳定。南瓜中主要的类胡萝卜素包括α-胡萝卜素、β-胡萝卜素、叶黄素、玉米黄质等[3-6]。根据宋新娜等[7]对美国140种食物类胡萝卜素含量的归纳总结,南瓜中所含α-胡萝卜素、β-胡萝卜素、β-隐黄质分别为8.34、42.26、34.71 μg·g-1,在140种食物中位列前十。此外,南瓜色素主要营养价值来自于其抗氧化能力和能够作为重要营养物质维生素A的前体,其中E-β-胡萝卜素具有100%的维生素A原活性[8]。通常情况下,黄色、橙色、红色的果蔬中全反式结构的β-胡萝卜素含量较高。Carvalho等[8]研究了2种长白南瓜,发现所有E-β-胡萝卜素均为A和B样品中质量分数最高的异构体,分别为244.22、141.95 μg·g-1,占β-胡萝卜素总量的80%左右。Carvalho等[9]发现去皮的C. moschata中含有235 μg·g-1的E-β-胡蘿卜素,都高于Donado Pestana[10]等研究的同样作为β-胡萝卜素重要来源的CNPH 1194甘薯(128.5 μg·g-1)。一般认为,E-β-胡萝卜素活性高于Z-β-胡萝卜素,汪之顼[11]的研究表明,β-胡萝卜素在部分中国成人体内转化成维生素A的比值为质量比9.1∶1,顺式结构的维生素A原活性约为其反式的一半[12]。它们具有的生理功能包括预防心血管疾病、白内障和衰老等。南瓜色素因具有此类营养特性和保健促进作用,是开发新型功能性食品、营养制剂和药物制剂的理想成分,可在食品、保健、医药等领域中得到充分应用[13-15]。笔者归纳总结了国内外对南瓜色素理化性质、提取纯化及其抗氧化性的研究现状,以期为南瓜色素在食品的加工生产、饲料生产与医药行业等应用中提供理论基础,进而开拓南瓜色素的市场。
1 南瓜色素的理化性质
1.1 南瓜色素的着色特点
南瓜色素是一种经提取、纯化、浓缩南瓜皮或南瓜果肉得到的黄色天然食品级色素。而南瓜色素中的类胡萝卜素是大部分南瓜主要呈黄色或橙色的原因,它在南瓜中的含量与成分组成因南瓜种类的不同而有所差异。从结构上看,类胡萝卜素主要由8个异戊二烯以及它们在分子间形成的共轭双键构成,这些偶联的双键结构使之主要呈黄、橙和红色。共轭双键的长度不同是产生颜色差异的原因,主要表现为吸收波长随共轭双键数量的增加向可见光区转移。
1.2 南瓜色素的溶解性
类胡萝卜素在蔬菜水果中很常见,而在南瓜中尤为丰富。南瓜中的类胡萝卜素是一种脂溶性的在芳香烃、脂肪烃、氯代烃等有机溶剂中能够溶解的四萜化合物,并且在极性较强的有机溶剂中溶解度较大。由于其疏水性与脂质组分有关,大多数类胡萝卜素都有1个或2个环结构,由末端基团的环化形成。
1.3 南瓜色素的稳定性
类胡萝卜素含有共轭双键长链,因而对光、氧、酸与高温敏感,氧化剂、金属离子等也会有所影响。孙明奇等[16]对柑橘果皮类胡萝卜素研究发现,在光、热、氧化剂和低pH条件下,类胡萝卜素容易降解,且随着温度上升、光照增强、氧化剂浓度增加及pH降低,降解作用加强。李晓银[17]研究柿果皮类胡萝卜素发现,当有二价和三价铁离子、铝离子、铜离子等存在时,类胡萝卜素容易被破坏,但破坏程度不同。邵金华等[18]以柚皮类胡萝卜素为研究对象,发现类胡萝卜素在高碱性环境中不稳定,而还原剂、防腐剂与甜味剂对它无明显影响。
南瓜色素是具有南瓜香甜气味且易潮解的橙黄色粉末,能够在乙醇、石油醚、丙酮等有机溶剂中溶解,其中,乙醇是最优溶剂。当pH为4~12时,酸碱性对南瓜色素影响不大,但当pH过低时会将其破坏。南瓜色素对光、热的耐受性较强,但光照时间过长或温度高于80 ℃会发生降解[19]。当金属离子浓度较低时,色素不受影响,浓度过高则会使色素沉淀。南瓜色素具备一定的抗氧化性与抗还原性,但双氧水等高浓度氧化剂会使其消色。在氯化钠、蔗糖、碳酸钠等常见食品添加剂存在的情况下,色素较稳定,枸橼酸钠可以使其增色,维生素C会使其消色。南瓜色素没有毒性,LD50为5 010 g·kg-1,不仅能应用于食品与化妆品的着色,还可用于保健品、药品中,且色素随浓度的不同,可呈现出红色到黄色这一范围内的所有颜色,染色范围十分广泛。
1.4 南瓜色素的結构
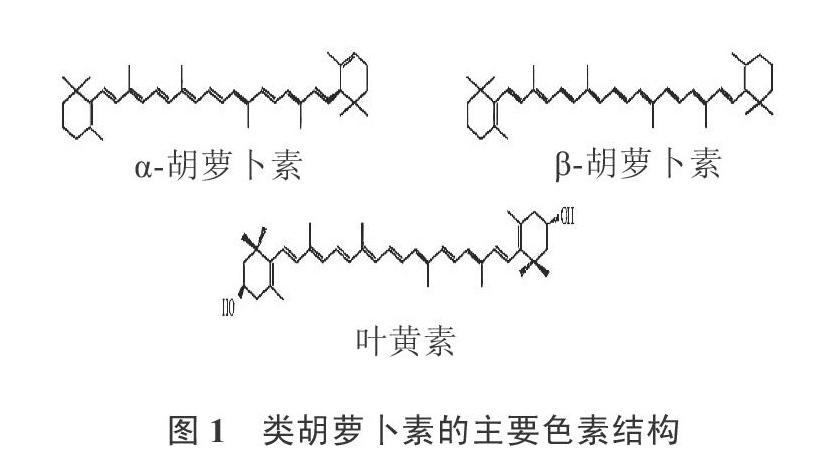
南瓜色素中的主要色素类胡萝卜素由异戊二烯构成,两个异戊二烯在中间尾—尾相联,首尾两个异戊二烯组成六元环结构,形成共轭双键长链。一般类胡萝卜素能够分成2种:烃类胡萝卜素和含氧衍生物。前者只含碳氢,后者除碳氢外还含有氧。而南瓜中的烃类胡萝卜素以α-胡萝卜素、β-胡萝卜素为主,含氧衍生物主要为叶黄素,结构如图1所示[20]。
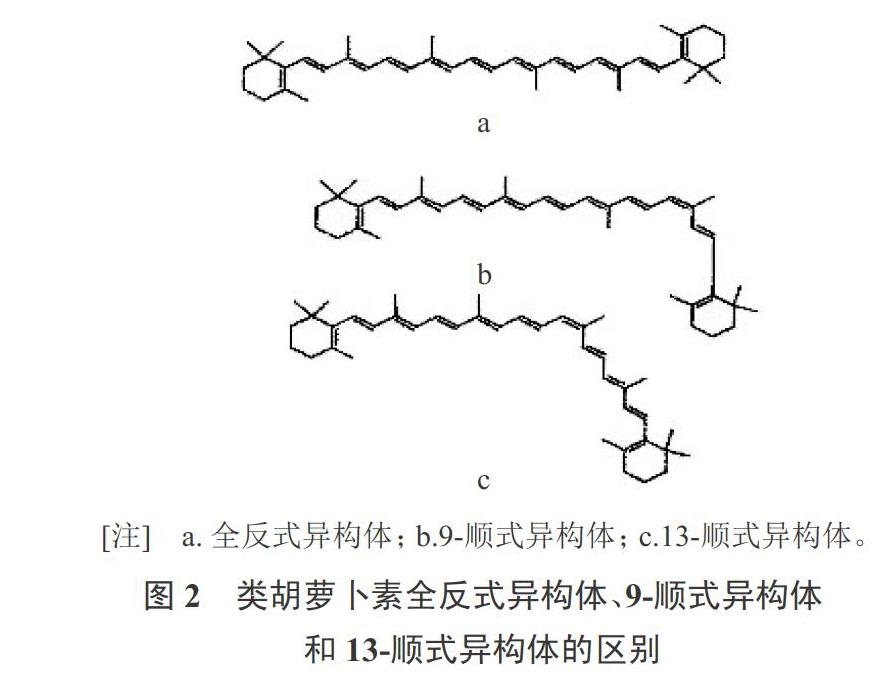
类胡萝卜素的结构最特别之处在于由长系统的п电子对所形成的一个共轭体系,因为碳碳双键、碳碳单键的存在,使类胡萝卜素分子具有很明显的立体异构特性。这种特性决定了类胡萝卜素的分子形状、化学反应性、吸光性以及颜色。多烯链上的每个双键都有两类几何构型,即顺、反式异构体(图2)。一般,类胡萝卜素的构型为全反式。现今包括我国在内的各个国家侧重于南瓜色素的特性研究,对其结构和组分的近探究比较少见。
2 南瓜色素制备方法
2.1 南瓜色素的提取
经高效液相色谱分析试验[21-22],南瓜色素主要由3种类胡萝卜素组成,分别为叶黄素、β-胡萝卜素和α-胡萝卜素。
2.1.1 β-胡萝卜素的提取 南瓜色素的主要成分为β-胡萝卜素,又称维生素A源,除可作为着色剂外,也可作为营养增补剂[23]。敬大江等[24]采用质量分数为0.7%的二水氯化钙溶液处理,然后再以固液比1∶8~1∶15的石油醚作为溶剂对南瓜中的β-胡萝卜素进行萃取,提取率可达85%。于开源等[25]采用复合溶剂对南瓜中的β-胡萝卜素进行提取分离,利用响应分析法对提取条件进行优化,得出提取的最优参数为石油醚用量40 mL、温度40 ℃、时间93 min,得到β-胡萝卜素的质量浓度是10.086 μg·mL-1。试验所得最优的复配溶剂为石油醚、乙醇、水,其中乙醇∶水的最佳体积比为1∶2。β-胡萝卜素萃取率受温度和石油醚用量的影响较大,受萃取时间影响较小;β-胡萝卜素萃取率的曲面效应受时间与石油醚用量、温度与石油醚用量的交互影响明显。溶剂提取法不需要复杂的操作技术和设备,但所需提取时间较长,获得的β-胡萝卜素纯度较差,需要进一步纯化。
2.1.2 α-胡萝卜素的提取 可采用溶剂提取、微波辅助提取、超声波辅助提取等方法。使用这些方法提取时,往往得到的是β-胡萝卜素、α-胡萝卜素、叶黄素等南瓜色素的混合物。赵二劳等[26]以95%乙醇作浸提剂,经过单因素与正交试验,得出南瓜色素的最优提取参数:超声功率80 W、提取时间40 min、料液比(g·mL-1)1∶10。由此,粗提的色素提取率达到10.6%。超声波辅助法减少耗时、提高效率、降低能耗,而且在低温下也可进行。夏丽丽等[23]运用该法提取南瓜中的β-胡萝卜素、α-胡萝卜素、叶黄素等,经过正交试验获得最优参数为:以95%乙醇为提取剂,料液比(g·mL-1)1∶60、微波功率640 W、提取时间3 min。相较于传统水浴提取法,该法溶剂消耗量更少、加热快、受热均匀、耗时短,且提取率提高。
2.1.3 叶黄素的提取 南瓜中的叶黄素可以通过超临界二氧化碳萃取,超临界二氧化碳萃取是一类以CO2为提取溶剂的提取办法。在定温定压前提下,CO2呈现超临界流体状态,兼具气体的流动性与液体的溶解性[25],可将叶黄素提取出来。徐丽萍[27]用该法提取‘红蜜南瓜中的叶黄素,获得的最佳参数是:温度40 ℃、压力15 MPa、时间4 h、CO2流量20 kg·h-1,由此得到的提取率为88%。超临界二氧化碳萃取具有提取率高、损失少、有机溶剂不残留等优势,且CO2气体易得,价格低廉,没有毒性[28],具有较低临界温度和压力[29-31],避免了传统的沸点溶剂对色素结构和功能的破坏[32],该技术已在食品、香辛料、医药等领域得到广泛应用。
2.2 南瓜色素的纯化
2.2.1 β-胡萝卜素纯化 β-胡萝卜素可采用柱层析的方法纯化,又因其极性小,故也可用石油醚进行纯化。胡朝辉等[33]从极大螺旋藻中提取纯化β-胡萝卜素时采用体积分数为3%的乙酸乙酯和石油醚洗脱,通过氧化铝柱进行色谱分析,平均回收率为96.8%。夏薇等[34]采用以硅胶为吸附剂的层析柱,石油醚为单一洗脱剂,从霉烟或碎烟末浸膏中纯化β-胡萝卜素,去除脂溶性杂质包括叶黄素和α-胡萝卜素,回收率达到80%。
2.2.2 α-胡萝卜素纯化 α-胡萝卜素纯化可以采用柱层析和纸层析的方法。徐杰等[35]从贵州黑糯米稻米种皮中纯化α-胡萝卜素,先采用以硅胶为吸附剂的硅胶柱,以BAW上层(正丁醇∶冰醋酸∶水=4∶1∶5)为洗脱剂;再将硅胶得到的色带洗下浓缩,经滤纸作纸层析分离,以BAW上层为展开剂,分离纯化色素,得到α-胡萝卜素质量分数为1.80 μg·g-1(鲜质量)。
2.2.3 叶黄素纯化 叶黄素纯化可以采用柱层析的方法,当需要纯化的物质种类少、分子结构差异大(如叶黄素和胡萝卜素)时,可以利用其溶解性差异来进行分离[36]。汪廷彩[37]采用柱层析的方法对叶黄素进行纯化,上层为硅胶和活性氧化铝,作为保护填充;下层为硅胶,作为主层析柱。先用三氯甲烷溶解,去除水溶性杂质,再用正己烷去除脂溶性杂质,包括β-胡萝卜素和α-胡萝卜素等,最终得到平均得率85.4%、纯度为92.5%的叶黄素纯化品。
3 南瓜色素的检测方法
3.1 分光光度法
杜咏梅等[38]对样本中叶绿素和叶黄素进行酯皂化,再用乙醚分离,减小其他色素或化学成分的干扰,最后将萃取出的类胡萝卜素配制成不同浓度的溶液在445 nm下测量吸光度,得出类胡萝卜素溶液浓度与吸光度呈线性关系,因此,利用分光光度法定量检测类胡萝卜素具有可行性。分光光度法操作较简便,不需价格高昂的设备,更适合定量检测类胡萝卜素,但结果的精密度较低,需要优化试验条件,而且南瓜色素是由多种色素构成的复杂色素,缺少标准品,用分光光度法对其进行准确定量仍需进一步探究。
3.2 色谱法
色谱法包括薄层色谱法、高效液相色谱法(HPLC)等,既可用于定性分析,也可用于准确定量。郭庆启等[39]采用纸色谱法,展开剂选用水-浓盐酸-甲酸(体积比为51.4∶24.9∶23.7),試验测量并计算得出Rf值,并与标准值进行比对,得出黑加仑果渣花色苷主要包括矢车菊色素与飞燕草色素。颜少宾等[40]通过HPLC法检测桃果实中类胡萝卜素成分及含量,结果发现,色素含量由高至低依次为β-胡萝卜素、玉米黄素、α-胡萝卜素、β-隐黄质、叶黄素。吴增茹等[41]采用HPLC法测定国内外共31种南瓜中的β-胡萝卜素,得出不同种类南瓜中该色素质量分数有较大区别,平均为9.52 μg·g-1(鲜质量)。其中,HPLC法检测速度快、灵敏度高及样品用量少,近年来使用较多,但操作较复杂,设备昂贵。
4 南瓜色素的抗氧化性
南瓜色素是一种具有生物活性、可作为抗氧化剂使用、含有共轭双键系的萜烯基团类天然色素,它能够影响细胞生长调节、调节基因表达和免疫反应[42]。近年来,对于花青素等的抗氧化性研究较多,而目前国内外对于南瓜色素的抗氧化能力尚不明确。但南瓜色素的氧化应激反应与花青素等的抗氧化性研究存在共通性,可以参考花青素这类色素的抗氧化性的研究方法对南瓜色素进行研究,可通过体内、体外试验探讨其作用机制。体外试验包括羟自由基(·OH)和DPPH自由基(DPPH·)清除能力测定等,体内试验包含线虫、大鼠和小鼠试验。其中线虫试验利用的秀丽隐杆线虫(Caenorhabditiselegans)目前备受关注,它具有结构简单、繁殖量大、方便观察等特点,且大多与人体病状有关的基因和通路涵盖在线虫基因组中。在秀丽隐杆线虫上进行南瓜色素抗氧化性的研究,便于观察,应用线虫模型的研究结果也可以外推到人类[43-44]。
4.1 清除自由基
南瓜色素中的类胡萝卜素由于电子转移机制或可能的加成反应能与自由基作用。经由这种方式,类胡萝卜素将会防止细胞损伤和氧化应激[45]。南瓜色素中具有的多个共轭多烯双键使之与含氧自由基不可逆地形成稳定的碳中心自由基,并可逆地与氧作用产生一类新型过氧化自由基链。正常的生理代谢过程中会有少数含氧自由基在人体中生成,并会很快被人体中的抗氧化酶或抗氧化剂去除,通常对细胞、组织没有损害。然而,氧分压很大程度上影响了这个可逆反应的速率。在氧分压减小的情况下,反应会朝碳核自由基方向进行,使人体中过氧化自由基含量减少,阻碍自由基的链锁反应。此外,β-胡萝卜素的稳定性使其在极低的氧分压下依旧可以防止形成过氧化自由基链[46-47]。邓丽君等[48]利用ABTS法、DPPH法及FRAP法对光合细菌中类胡萝卜素进行试验验证,自由基可被类胡萝卜素清除,且各分色素清除力有差异,然而都大于总色素的清除力,可能是不同分色素的结构相互影响导致总色素的抗氧化能力反而下降。
4.2 淬灭单线态氧
南瓜色素中的类胡萝卜素属于萜烯基团类中含有多个共轭双键的不饱和化合物,是一种单线态氧淬灭剂,能阻止自由基进一步产生。三线态类胡萝卜素(3CAR)可通过与溶剂质检的振动与旋转来淬灭三线态光敏物质(3S)和单线态氧(1O2),生成光敏物质(S)和基态氧。赵文恩[49]采用超微弱发光测量仪于710 nm下测定H2O2-NaOCl体系中的1O2发光,探究类胡萝卜素猝灭1O2,发现该过程为物理机制,类胡萝卜素在作用后结构并未发生改变,经过能量转移仍可淬灭更多单线态氧和三线态光敏物质。反应式如(1)和(2)。
4.3 抑制过氧化效应
生物体内抗氧化酶活性随着年龄的增长或因某些病理状态而降低,而机体内氧化剂(如ROS)的产生增加,因此两者失去平衡会引起氧化应激反应。氧化应激反应是一种重要的病理生理状态,它会氧化损伤许多生物大分子,形成氧化物或过氧化物,从而损伤酶、细胞膜、组织和基因,因此损害细胞的完整性及功能进行性,引发心脏病、癌症、衰老等。许多研究报道了各种类胡萝卜素具有非常有效的过氧化自由基的淬灭能力,尤其是那些导致脂质过氧化反应的类胡萝卜素,但其机制尚不明确。
细胞内存在多种机制可以产生活性氧,此类活性氧能使DNA断裂、导致脂质过氧化、改变酶活性等。许多研究表明,此类由活性氧引起的氧化损伤可被类胡萝卜素抑制,但起作用的关键性基团尚不明确。所以应研究南瓜色素的结构,对其产生作用的基团进行试验验证[50]。
5 小结与展望
类胡萝卜素作为一种生物抗氧化剂对人体非常有利。而南瓜是类胡萝素含量最高的蔬果之一,生产成本低,资源极为丰富,易于贮存,因此围绕其开展类胡萝卜素研究尤显必要。且由于人们日益推崇天然健康的生活习惯,该研究方向具有广阔的市场应用前景,可进行更深化、系统的研究。
如今,国内不乏南瓜色素提取技术及优化的探究,然而还停留于浅层,缺乏系统、科学的归纳,更不用说投入到大规模生产中,与国外研究进展差距较大。且南瓜中的大部分色素尚未被鉴定或测量。其主要原因是目前还没有从南瓜中定量提取色素的方法。开发简单、快速、毒性小的南瓜色素的制备与测定方法是目前亟待解决的问题。除此之外,对南瓜色素进行分子结构鉴定、抗氧化应激作用机制研究及结构与活性间的构效关系探究等仍需深入。
参考文献
[1] 赵宇瑛,张汉锋.花青素的研究现状及发展趋势[J].安徽农业科学,2005,33(5):904-905.
[2] 左玉,田芳.花青素稳定性研究进展[J].粮食与油脂,2014,27(7):1-5.
[3] BERGANTIN C,MAIETTI A,TEDESCHI P,et al.HPLC-UV/Vis-APCI-MS/MS Determination of major carotenoids and their bioaccessibility from ‘Delica(Cucurbita maxima)and ‘Violina(Cucurbita moschata)pumpkins as food traceability markers[J].Molecules,2018,23(11):1-13.
[4] KRECK M,KüRBEL P,LUDWIG M.Identification and quantification of carotenoids in pumpkin cultivars(Cucurbita maxima L.)and their juices by liquid chromatography with ultraviolet-diode array detection[J].Applied Botany and Food Quality,2006,80(2):93-99.
[5] PACHECO S,PEIXOTO F M,BORGUINI R G,et al.Microscale extraction method for HPLC carotenoid analysis in vegetable matrices[J].Scientia Agricola,2014,71(5):416-419.
[6] CZYNSKI B K,MICHALOWSKA A G.The profile of secondary metabolites and other bioactive compounds in Cucurbita pepo L. and Cucurbita moschata pumpkin cultivars[J].Molecules,2019,24:1-22.
[7] 宋新娜,汪之顼.美国的食物类胡萝卜素含量数据[J].国外医学卫生学分册,2007,34(3):182-187.
[8] CARVALHO L M J,SMIDERLE L A S M,CARVALHO J L V,et al.Assessment of carotenoids in pumpkins after different home cooking conditions[J].Food Science and Technology,2014,34(2):365-370.
[9] CARVALHO L M J,SMIDERLE L A S M,CARVALHO J L V,et al.Total carotenoid content,α-carotene and β-carotene,of landrace pumpkins(Cucurbita moschata Duch.):a preliminary study[J].Food Research International,2012,47(2):337-340.
[10] DONADO-PESTANA C M,SALGADO J M,RIOS A O,et al.Stability of carotenoids,total phenolics and in vitro antioxidant capacity in the thermal processing of orange-fleshed sweet potato (Ipomoea batatas Lam.) cultivars grown in Brazil[J].Plant Foods for Human Nutrition,2012,67(3):262-270.
[11] 汪之頊.人体内β-胡萝卜素转化为维生素A效率的评价研究[D].北京:中国疾病预防控制中心,2003.
[12] 李蕾,荫士安.影响蔬菜中β-胡萝卜素转化为维生素A的因素[J].国外医学(卫生学分册),2005,32(1):27-30.
[13] 邓俊琳,朱永清,刘小俊,等,李娟.HPLC法测定南瓜中β-胡萝卜素[J].中国食物与营养,2017,23(8):33-36.
[14] 苏晶莹,周向辉,孙婕,等.超声波辅助提取南瓜色素的工艺研究[J].食品研究与开发,2014,34(18):16-20.
[15] 刘洋,屈淑平,崔崇士.南瓜营养品质与功能成分研究现状与展望[J].中国瓜菜,2006,19(2):27-29.
[16] 孙明奇,潘思轶,胡建中,等.环境条件对柑橘果皮类胡萝卜素稳定性影响研究[J].食品科学,2008,29(6):127-129.
[17] 李晓银.柿子皮中类胡萝卜素化合物的分离鉴定及稳定性研究[D].西安:西北工业大学,2006.
[18] 邵金华,朱智勇,李军艳,等.柚皮中类胡萝卜素的提取及其稳定性的研究[J].食品工业科技,2014,35(2):281-285.
[19] PROVESI J G,DIAS C O,AMANTE E R.Changes in carotenoids during processing and storage of pumpkin puree[J].Food Chemistry,2011,128(1):195-202.
[20] 田密霞,胡文忠,霍晓雪,等.高效液相色谱法测定南瓜中β-胡萝卜素和VE的含量[J].食品与发酵工业,2010(12):165-168.
[21] 许舒雯,陈龙胜,彭丽华.南瓜果肉中色素的研究[J].安徽农业科学,2015,43(36):142-144.
[22] 王彬,林亮,陈敏氡.南瓜类胡萝卜素含量的超高效液相色谱分析[J].农学学报,2017,7(12):22-27.
[23] 夏丽丽,郝利平.微波助提南瓜黄色素最佳提取条件的研究[J].化学分析计量,2008(2):57-59.
[24] 敬大江,谢洗龙,刘洁,等.南瓜中天然β—胡萝卜素的提取研究[J].山西食品工业,2003(1):2+17.
[25] 于开源,鞠晓峰,郑丽娜,等.响应法优化南瓜中色素的提取工艺研究[J].食品研究与开发,2015,36(2):24-29.
[26] 赵二劳,梁兴红,张海容.南瓜多糖超声波提取条件的优化[J].食品研究与开发,2006,27(6):65-66.
[27] 徐丽萍.红蜜南瓜中叶黄素的超临界CO2流体萃取分离方法研究[J].中国食品学报,2007,7(3):94-97.
[28] FIKSELOVA M,SILHAR S,MARECEK J,et al.Extraction of carrot(Daucus carota L.)carotenes under different conditions[J].Czech Journal of Food Sciences,2008,36:268-274.
[29] ROZZI N L,SINGH R K.Supercritical fluids and the food industry[J].Comprehensive Reviews in Food Science and Food Safety,2006,1(1):33-44.
[30] CALVO M M,DADO D,SANTA-MARIA G.Influence of extraction with ethanol or ethyl acetate on the yield of lycopene,β-carotene,phytoene and phytofluene from tomato peel powder[J].European Food Research and Technology,2007,224(5):567-571.
[31] ABBAS K A,MOHAMED A,ABDULAMIR A S,et al.A review on supercritical fluid extraction as new analytical method[J]. American Journal of Biochemistry and Biotechnology,2008,4(4):345-353.
[32] SHI J,MITTAL G,KIM E,et al.Solubility of carotenoids in supercritical CO2[J].Food Reviews International,2007,23(4):341-371.
[33] 胡朝輝,刘志礼.极大螺旋藻中β-胡萝卜素的分离纯化及定量测定[J].色谱.2001(1):85-87.
[34] 夏薇,陈新志.烟叶中β胡萝卜素的分离纯化和测定[J].色谱,2004(1):54-56.
[35] 徐杰,林正眉.贵州黑糯米稻米种皮成分的分离纯化与结构鉴定[J].中国粮油学报,2003,18(2):9-13.
[36] LI H B,JIANG Y,CHEN F.Isolation and purification of lutein from the microalga chlorella vulgaris by extraction after saponification[J].Journal of Agricultural and Food Chemistry,2002,50(5):1070-1072.
[37] 汪廷彩.南瓜黄色素中叶黄素的纯化及特性研究[D].杭州:浙江大学,2004.
[38] 杜咏梅,张怀宝,王晓玲,等.光度法测定烟草中总类胡萝卜素的方法研究[J].中国烟草科学,2003(3):28-29.
[39] 郭庆启,张娜,刘洪博,等.大孔树脂法纯化黑加仑果渣花色苷及初步鉴定[J].中国调味品,2010,35(9):100-103.
[40] 颜少宾,蔡志翔,俞明亮,等.桃果实发育阶段肉色形成与类胡萝卜素的变化分析[J].西北植物学报,2013,33(3):613-619.
[41] 吴增茹,金同铭.用高效液相色谱法测定不同品种南瓜中的β-胡萝卜素的含量[J].华北农学报,1998,13(3):3-5.
[42] CHERYL L R.Carotenoids:Biology and treatment[J].Pharmacol Therapeutics,1997,75(3):185-197.
[43] 何露,李中,韦睿,等.姜黄素类化合物提高线虫的抗氧化应激能力[J].中国病理生理杂志,2014,30(1):154-158.
[44] 李萍,米生权,冯亚芳,等.姜黄素对秀丽隐杆线虫降脂及抗氧化保护作用[J].食品工业科技,2017,38(14):289-293.
[45] EL-AGAMEY A,LOWE M G,MCGARVEY J D,et al.Carotenoid radical chemistry and antioxidant/pro-oxidant properties[J].Archives of Biochemistry and Biophysics,2004,430(1):37-48.
[46] 刘翔,惠伯棣.类胡萝卜素在体内外的抗氧化活性[J].食品工业科技,2008,29(10):279-282.
[47] STAHL W,HEINRICH U,JUNGMANN H,et al.Carotenoids and carotenoids plus vitamin E protect against ultraviolet light–induced erythema in humans[J].The American Journal of Clinical Nutrition,2000,71(3):795-798.
[48] 邓丽君,赵天风,张莉青,等.PSB-B类胡萝卜素的抗氧化活性研究[J].陕西农业科学,2016,62(1):61-63.
[49] 赵文恩,韩雅珊,乔旭光.类胡萝卜素清除活性氧自由基的机理[J].化学通报,1999(4):3-5.
[50] MELENDEZ-MRTINEZ A J,BRITTON G,VICARIO I M,et al.Relationship between the colour and the chemical structure of carotenoid pigments[J].Food Chemistry,2006,101(3):1145-1150.
