可构建不同三维微环境的细胞培养芯片设计与制作*
2020-11-27陈淑豪丁来钱何玫娟李经民
陈淑豪,刘 冲,丁来钱,何玫娟,李经民※
(1.大连理工大学机械工程学院,辽宁大连 116024;2.大连理工大学辽宁省微纳技术及系统重点实验室,辽宁大连 116024)
0 引言
细胞是生命体的基本单元,细胞层面的各类研究在探寻生命规律、研究疾病病理、药物开发及筛选等方面有不可或缺的价值[1]。细胞培养作为生命科学领域中最重要的研究技术,关键在于如何在体外构建与在体细胞生存环境相似的微环境[2-3]。已有大量研究表明细胞生存的三维微环境中各种细胞因子、神经递质、细胞之间及细胞与细胞外基质(Extracellular matrix,ECM)相互粘附作用中的多种信号积极参与了调节细胞生长、分化、繁殖及凋亡等生命活动[4-5]。
近年来,微流控技术快速发展,被广泛应用于细胞研究。微流控芯片凭借其体积小、高通量、试剂消耗少、样本量需求小等优越性能,可对细胞进行二维或三维培养[6]。相比二维环境,三维培养能更真实还原细胞的生长特性和行为表现[7]。三维细胞培养微流控芯片设计已成为当前的研究热点。Benjamin等[8]设计了一种三层微流控装置用于模拟肿瘤细胞穿过血管的过程。装置中层的微孔parylene膜能模拟血管壁的支撑结构,并对其进行水凝胶处理为细胞提供三维生长环境。Carlos 等[9]设计的微流控装置能对3D-ECM 水凝胶进行图案化,通过建模分析了微器件中集成三维凝胶的微结构尺寸,并观察了三维空间中乳腺癌细胞受巨噬细胞影响的表型。Ioannis 等[10]开发了一种基于微流控技术的构建三维血管界面的方法,观察肿瘤转移时内皮屏障功能。芯片中引入生物水凝胶形成三维的观测界面。刘军山等[11]制作并验证了一种用于细胞三维培养的集成微柱阵列的微流控芯片,对微柱间距进行了优化设计。Supriya 等[12]开发的三维细胞培养微流控平台可以研究肿瘤与内皮细胞之间的双向串扰。综合分析各种三维细胞培养微流控器件,微柱结构包裹ECM模拟材料(如鼠尾胶原),能在相邻微空间实现生物化学信息交流,适用于模拟在体微环境下的细胞生长。但芯片的微结构设计对ECM 水凝胶包裹效果的影响,以及芯片设计在构建仿生三维微环境和构建用于对比的不同微环境的研究仍有待完善。
本文设计了一种可建立不同三维微环境的细胞培养微流控芯片。在建模仿真优化芯片微结构设计的同时,对细胞培养池两侧形成的不同小分子浓度分布微环境进行了实验验证。所设计的芯片能为细胞与微环境相互作用机制的研究提供一个新的技术平台。
1 芯片设计及仿真分析
1.1 芯片整体结构设计
本文设计的三维细胞培养微流控芯片如图1 所示。芯片选用聚二甲基硅氧烷(Polydimethylsiloxane,PDMS)制作成型,PDMS具有良好的生物相容性和透气性,适合作为细胞培养的基底材料,且其透光性好便于观察细胞生长的状态[2]。芯片由下层结构片和上层盖片组成,芯片的微结构主要包括细胞培养池、3D-ECM 水凝胶微通道、微柱和培养液微通道。在细胞培养池两侧设计具有间隙的微柱结构,使细胞培养池与两侧并置凝胶通道形成连续界面,允许细胞和旁通道微空间相互作用。芯片中心微通道上串联3 个宽度600 μm 的圆形细胞培养池,样本能以高密度植入培养池从而增大样本数。两侧结构呈对称设计,向外依次为凝胶微通道和最外侧培养液微通道,宽度均为400 μm。水凝胶可以独立地填充至2 个凝胶微通道,封装在局部微柱中从而建立三维环境。通过调整最外侧溶液成分可调节小分子扩散下微环境状态。此外,芯片微柱结构的形状设计影响水凝胶封装的性能,研究分析了不同微柱对封装3D-ECM 水凝胶的效果从而优化芯片设计。确定微柱为直径150 μm 的圆形结构,间隙为50 μm;凝胶微通道宽度为400 μm,高150 μm。
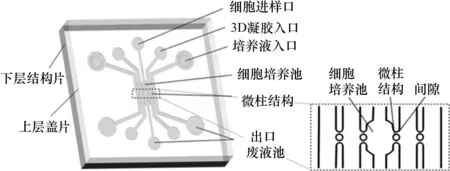
图1 微流控芯片结构示意图
1.2 微柱结构仿真优化
为实现在芯片上建立模拟在体3D-ECM 的空间环境,在芯片中引入生物水凝胶材料(如鼠尾胶原)。芯片中带间隙的微柱结构的设计影响区域图案化水凝胶的效果。水凝胶溶液在微柱间隙的封装由前进界面的压力差决定,根据Younglaplace方程(方程表明,气液压力差是表面张力和界面曲率的函数)可计算溶液界面压力差[9],如下所示:

式中:γ 为溶液的表面张力;θs为液体与侧壁的前进接触角;θv为液体与上下壁的前进接触角;w和h分别为微通道的宽度和高度。
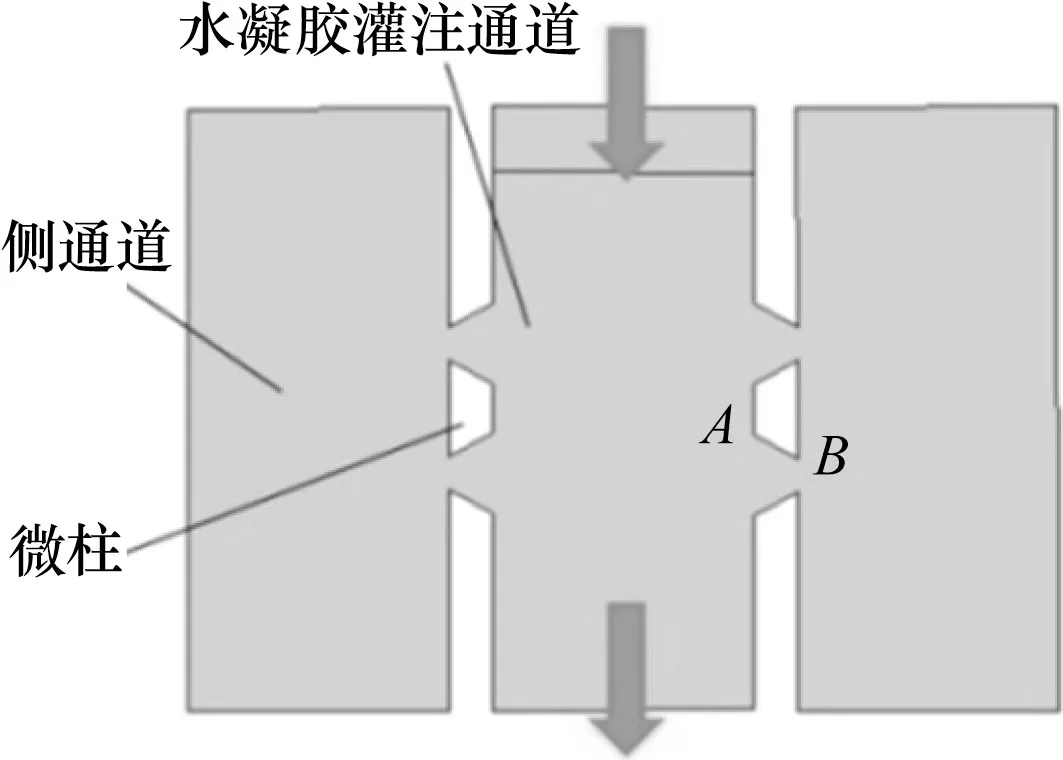
图2 模拟胶原溶液注入的几何模型
水凝胶溶液注入过程中与微柱侧壁的接触角随着微柱形状变化而改变,在此对梯形、六边形、八边形和圆形(外接圆直径均为150 μm)微柱封装性能进行仿真分析。由于芯片设计在高度方向结构一致,可对水凝胶注入微通道建立二维模型进行模拟仿真,图2所示为基本的梯形模型,箭头方向表示水凝胶溶液的入口和出口,梯形侧边AB范围内分析水凝胶的封装效果。根据水凝胶注入的微通道尺寸变化的影响[9],选定微通道宽度为400 μm。根据对微柱间隙的相关研究[11],微柱间隙设定50 μm。用Comsol 5.3两相流-水平集物理场,模拟胶原溶液注入具有不同微结构芯片的过程。
仿真参数设置如下:(1)胶原溶液浓度为1 mg/mL,用流变仪测得的黏度为0.036 Pa·s,用液滴形状分析仪测得的表面张力系数为0.060 N/m;(2)选定水凝胶溶液入口,设定入口压力1 000 Pa;选定出口,设定出口压力为0;(3)湿润壁接触角设置为41°,芯片的制作工艺中采用氧等离子表面处理键合两层PDMS,也对微通道亲疏水性进行改性,用液滴形状分析仪测得胶原溶液与改性后的PDMS 接触角为41°;(4)细化网格,使用瞬态求解器计算水凝胶注入不同微结构的封装效果。结果如图3 所示,水凝胶溶液在110 ms 可注满模型,相比梯形微柱间隙溶液已经有溢出,圆形微柱溶液界面未越过间隙。此外圆形微柱能长时间保持溶液界面不溢出间隙,对水凝胶溶液的封装效果最佳。

图3 不同形状微柱封装效果仿真结果对比
1.3 芯片两侧构建不同微环境的仿真分析
细胞生长的微环境中,控制周围可溶性小分子浓度梯度,对于研究生物化学信号诱导生物反应的定量关系至关重要。本文对封装水凝胶后芯片的三维空间中小分子扩散进行三维仿真。用Comsol 5.3 仿真软件中的多孔介质流动物理场和稀物质传递物理场耦合,对单培养池的模型计算分析,获得了小分子浓度随时间变化的分布。仿真参数设置如下:(1)外侧旁通道流动类型为层流,封装水凝胶的微通道流动类型为多孔介质流,壁面无滑移;(2)多孔基体渗透率为2×10-9m2,孔隙率为0.98(排液法测得);(3)外侧培养液两通道入口速度为2 μL/min,出口处抑制回流且出口压力为0;(4)葡萄糖作为培养基中的主要营养物质,在此用葡萄糖来代表微环境中小分子物质,两个培养液微通道入口浓度分别设为50 mmol/L(高糖)和10 mmol/L(低糖),葡萄糖扩散系数为0.96×10-9m2/s(37 ℃)。
分析结果如图4 所示。在微流控芯片中,并置微通道的连续界面上(如截线)可以生成介于外侧培养液通道葡萄糖浓度之间的浓度梯度,如图4(a)所示。截线处的连续界面上,葡萄糖浓度梯度随时间发生变化,如图4(b)所示,芯片内2 h可以形成较稳定的浓度分布,保证了芯片内微环境的稳定性。在培养池两侧的水凝胶微空间中构建了两种不同的小分子浓度刺激(图4(b)虚线标记处),形成了两种不同的微环境。在培养池中三维培养细胞,可在培养池两侧的连续界面中对比研究不同微环境下的细胞生长特性。

图4 芯片微环境的生化因子浓度变化分析
2 实验与结果
2.1 微流控芯片制作
该微流控芯片采用浇注成型的方法制作。制作过程:(1)利用微加工技术制作模具,模具的制作工艺流程如图5所示;(2)浇注PDMS 溶液,80 ℃下固化2 h 后拔模;(3)用等离子体清洗机对PDMS下层结构片和上层盖片进行氧等离子体处理,对准键合完成芯片制作,芯片实物如图6所示。

图5 芯片结构片的制作工艺流程

图6 芯片实物图
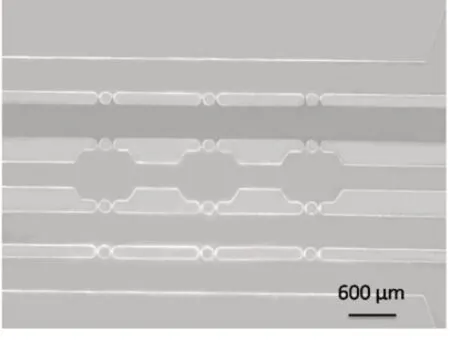
图7 芯片内水凝胶的封装
2.2 芯片三维微环境构建验证
2.2.1 水凝胶封装实验
对优化设计的微流控芯片注入Ⅰ型胶原溶液,验证芯片微结构的封装性能。稀释5 mg/mL胶原溶液为1 mg/mL,稀释溶液为0.01 mol/L 磷酸盐缓冲液(PBS),并加入0.1 mol/L 的NaOH 溶液调节pH 值至中性。使用移液枪将30 μL 胶原溶液注入微通道入口。在工具显微镜下实验验证了圆形微柱的水凝胶封装效果最佳,将胶原溶液灌注至芯片的水凝胶微通道,5 s可注满单个微通道,且在微柱间隙产生稳定的气液界面。水凝胶封装在微柱区域且放置长时间不会溢出,如图7所示,红色染料染色水凝胶便于观察。
2.2.2 不同三维微环境建立验证

图8 小分子扩散实验平台
为了研究芯片中细胞培养池两侧形成的微环境分布,对完成封装凝胶的芯片进行小分子扩散实验。实验中用荧光素钠(扩散系数0.36×10-9m2/s)模拟生化因子,与葡萄糖的扩散速度相近。利用倒置荧光显微镜搭建实验平台,如图8所示。控制微注射泵加压同时驱动芯片外侧2个旁通道的荧光素溶液流动,形成稳定的层流状态,流速为2 μL/min。2个旁通道中以浓度比5∶1的荧光素钠溶液进行第1组实验,其中高浓度一侧荧光素浓度为50 μmol/L。设置显微镜每隔5 min拍照一次,实验记录了两侧三维凝胶通道的荧光扩散状态,从而进行两侧水凝胶空间微环境对比。此外,调整荧光素钠浓度比2∶1进行第2组实验,高浓度一侧荧光素浓度为40 μmol/L。
荧光素钠在芯片三维空间扩散如图9所示。利用Matlab软件对荧光图像进行处理,表征荧光素钠在胶原水凝胶微环境分析区域(图9(a)标记处)的扩散情况。芯片中荧光素分子可在2.5 h扩散稳定,形成了稳定的浓度梯度。在同组实验中,对称2 个水凝胶旁通道可形成两种不同浓度的稳定微环境,如图9(b)所示。第1 组实验结果显示,在两侧的三维基质空间形成了差距较大的高低两种稳定的小分子浓度分布;第2组实验在两侧三维基质环境中减缓了浓度差距,也形成了不同的稳定小分子浓度环境。这实现了芯片中培养池两侧不同小分子浓度微环境的控制。

图9 芯片微环境内荧光素浓度表征
3 结束语
本文设计了一种能构建不同三维微环境的细胞培养微流控芯片。通过建模仿真优化了芯片结构设计,确定了圆形微柱用于封装水凝胶,并模拟两个三维基质空间中的小分子扩散分布。利用微加工工艺制作芯片,并验证了芯片封装水凝胶构建三维微环境的效果。设计实验验证了芯片内部建立扩散小分子高低两种浓度的微环境,通过调节不同的外侧培养液组分可控制多种稳定微环境的形成。芯片可用于体外模拟细胞生长与微环境相互作用的各种分析研究。
