基于乳腺癌细胞研究中药成分与量子点的联合作用及相关机制
2020-11-24张晓膺
黄 贵,王 磊,张晓膺
(苏州大学附属第三医院 a. 乳腺外科,b. 心胸外科,中国 常州 213003)
量子点具有光电性质稳定性良好、荧光量子产率较高、抗干扰性较强、比表面积大且易于修饰等优点,因而被广泛用于疾病诊断、药物载体运输以及生物成像等生物医药学研究和光电器件的制备中[1,2],但量子点的应用一直受到其潜在毒性的限制。科学实验及工业生产中排放的量子点不可避免地进入环境,也给生态环境及人体健康造成严重的威胁[3]。
考虑到量子点优良的光学性能,其已成为生命科学研究及药物开发中不可或缺的工具。研究者开始针对量子点的生物毒性进行减毒处理,包括采用壳层结构(ZnS或CdS)或更换非金属核(碳量子点或ZnS)[4,5]。这些处理被认为可以降低量子点中的重金属释放,但量子点自身纳米效应引发的毒性依然存在,并被认为是量子点毒性的主要来源[6]。因此,筛选降低纳米粒子毒性的配伍试剂成为一种新的尝试办法。
尽管量子点的毒性机理各异,但其毒性中伴随的氧化应激压力升高现象获得了较多研究者的认可[7,8]。有鉴于此,筛选抗氧化试剂与量子点进行配伍或进行量子点修饰成为可能。我国是中药的发源地,有大量的中草药被发现并用于疾病治疗中。这些中药因来源于自然,具有良好的生物亲和力,因此常被用于配伍药方的研制中,用于增强效果与降低毒性[9]。这一类的药物包括甘草、乳蓟以及熊胆粉等,考虑到中药成分的复杂性,研究者进一步提纯了其中的主要成分,包括甘草酸、熊去氧胆酸以及水飞蓟宾等,研究其与其他药物或毒素的联合作用[10-12]。结果表明,这些成分具有优良的抗氧化能力,并可实现对多种肝脏及肾脏毒素的解毒作用。然而这些成分是否同样能应用于量子点解毒中仍未可知,同时其中涉及的相关机制仍需进一步探讨。
此外,不论是笔者还是其他研究团队均发现,ATP结合(ABC)转运蛋白参与了量子点的外排过程,因此可能对其标记及载体效果带来较大影响[13,14]。同时肿瘤细胞易于通过高表达ABC转运蛋白获得耐药性,从而降低基于量子点的肿瘤标记或纳米载药效应[15]。随着对中药成分研究的深入,其介导的ABC转运蛋白抑制效应逐渐被发现,例如,紫草素被发现可显著抑制人卵巢癌细胞中的多药耐药蛋白(MDR1),从而增加了紫杉醇的细胞毒性[16]。类似的结果也被发现于水飞蓟宾[17]及熊去氧胆酸[18]中,从而提示我们可通过筛选合适的配伍中药成分,同时获得增强肿瘤治疗效果及保护正常组织的功效。
作为一种常见的肿瘤,乳腺癌细胞具有较强的氧化还原体系和抗氧化能力,且易于在药物处理过程中获得多药耐药作用,因此常被用于包括量子点在内的多种纳米粒子、药物及化学试剂的毒性机制研究中[19-22]。因此,本文中以乳腺癌细胞系(SK-BR-3)为模型,首先研究量子点氧化应激毒性的来源,其次检测中草药成分对巯基丙酸修饰碲化镉(MPA-CdTe)量子点毒性的降低作用,并通过氧化应激压力水平、抗氧化酶及ABC转运蛋白基因水平变化,解析其中可能的原理。其中,MPA-CdTe量子点为有较多文献报道的典型易致毒性量子点[23]。
1 材料与方法
1.1 材料
人乳腺癌(SK-BR-3)细胞购自上海中科院细胞库;DMEM培养基来自Thermo fisher公司;从Sigma-Aldrich公司购买如下产品:巯基丙酸(MPA),NaBH4,Te粉,CdCl2,噻唑蓝(MTT)、5,5′-二硫代(双硝基苯甲酸)(DTNB),甘草酸,甘草酸二铵,水飞蓟宾及熊去氧胆酸;胰酶、乙二胺四乙酸(EDTA)、磷酸缓冲液(PBS)、RNA提取及逆转录试剂盒购自生工生物工程(上海)股份有限公司;超氧化物歧化酶(SOD)及丙二醛(MDA)检测试剂盒来自碧云天生物技术研究所;其余试剂为国产,分析纯。
1.2 方法
1.2.1 量子点合成及表征 采用水热法合成MPA-CdTe量子点[24],即以Te粉、CdCl2及NaBH4为原料,以MPA为稳定剂,在氮气保护下,加热至200 ℃,回流法制备量子点。所获得量子点经异丙醇沉淀收集后,烘干称取质量,并加入超纯水配制为200 g·L-1的溶液。取溶液在紫外可见分光光度计(Cary 300,Agilent Technologies Inc.,美国)中检测吸收光谱;在荧光光谱仪(Edinburgh FLS920,Edinburgh Instruments Ltd.,英国)中,以340 nm为激发波长,检测荧光发射光谱。将量子点溶液滴于碳膜支撑的铜网上(商品),红外灯下烘干,利用透射电镜(HT7700,Hitachi High-Tech,日本)进行检测,获得量子点的大小以及粒径分布信息。量子点溶液静置48 h后,15 294×g离心,取上清用PinAAcle 900T原子吸收光谱仪(PerkinElmer,美国)进行检测,并发现其中游离Cd2+浓度为量子点浓度的1%。
1.2.2 细胞培养 SK-BR-3细胞培养于含10%胎牛血清及双抗(青霉素及链霉素均为10 g·L-1)的DMEM培养基中,细胞生长于37 ℃,含5%CO2的培养箱中,每隔24 h更换培养基,当细胞长至80%融合后,用EDTA-胰酶缓冲液(含2.5 g·L-1胰酶及1 g·L-1EDTA的PBS溶液)进行消化传代。
1.2.3 细胞处理 SK-BR-3细胞长至80%融合后,分别进行量子点或量子点-中药成分配伍处理。对于量子点单处理组,细胞经PBS洗涤后,加入含MPA-CdTe量子点25,50,100,200,400 nmol·L-1的DMEM培养基处理。为准确反映量子点自身的毒性,同时进行对比实验,分别向细胞中加入含CdCl2浓度为0.25,0.5,1,2,4 nmol·L-1的DMEM培养液。对于配伍处理组,细胞经PBS洗涤后,置于含100 nmol·L-1的MPA-CdTe量子点及甘草酸(5,10,20 μmol·L-1)、熊去氧胆酸(25,50,100 μmol·L-1)或水飞蓟宾(100,200,400 μmol·L-1)的DMEM培养基中。上述处理48 h后,收集细胞进行后续指标检测。本文中甘草酸、熊去氧胆酸直接溶解于培养基中,水飞蓟宾则首先溶解于二甲基亚砜,并在临用前用培养基进行稀释。二甲基亚砜终浓度不超过0.1%,中药成分浓度参考文献值[10-12],并经预实验证明为不具有毒性的最大浓度。CdCl2浓度选择为量子点浓度的1/100,因其为量子点溶液静置48 h后释放的游离Cd2+浓度。
1.2.4 细胞MTT实验 对照组及处理组的细胞经PBS洗涤后,加入600 μL MTT溶液(1 g·L-1,配制于PBS中),37 ℃含5%CO2的培养箱中孵育3 h,之后以1 mL含0.1%盐酸的异丙醇萃取,所得溶液测570 nm下的吸光度。
1.2.5 GSH检测 培养中的细胞经处理后,采用PBS洗涤并加入500 μL TritonX-100溶液(1%溶解于PBS中),30 min后收集裂解液,12 000 r·min-1离心去沉淀,取10 μL上清液并加入200 μL含1 g·L-1DTNB的PBS缓冲液,30 min后检测412 nm处的吸光度,GSH含量根据标准品进行计算,并表征为对照组的百分比。
1.2.6 SOD检测 细胞经处理后,采用PBS洗涤并经500 μL TritonX-100溶液裂解后,取10 μL裂解液用氮蓝四唑法试剂盒进行检测,另取10 μL裂解液用BCA总蛋白检测试剂盒测定总蛋白含量。SOD酶活依据氮蓝四唑生成蓝甲臜(560 nm)的抑制率来计算,经总蛋白校准后,表征为对照组的百分比。
1.2.7 MDA检测 细胞经处理后,采用PBS洗涤并经500 μL TritonX-100溶液裂解后,取100 μL裂解液,采用脂质氧化试剂盒进行检测。MDA水平表征为MDA-硫代巴比妥酸复合物(535 nm)的形成速度。经总蛋白校准后,表征为对照组的百分比。
1.2.8 RT-PCR检测 细胞总RNA用Thermofisher 公司提供的离心柱型RNA 提取试剂盒制备,RNA浓度采用紫外吸光光度法(260 nm)测定[25]。第一链cDNA的合成及进一步的PCR扩增试剂盒均来自上海生工,过程均按相应试剂盒说明书进行。PCR反应中所用的引物,包括β-肌动蛋白(ACTIN)、谷胱甘肽巯基转移酶(GST)、超氧化物歧化酶(SOD)、多药耐药蛋白(MDR1)及多药耐药相关蛋白(MRP1),采用Primer 5.0软件进行设计[26]并总结于表1,扩增仪器为7900HT Fast 荧光定量PCR仪,条件为95 ℃10 min,40个循环(94 ℃10 s,60 ℃10 s,72 ℃10 s),之后72 ℃3 min进行延伸,RNA表达水平检测方法为2-ΔΔCT,参考基因为β-ACTIN。

表1 实验中采用的基因引物
1.2.9 Zeta电位及水合直径检测 量子点母液用含10%胎牛血清的DMEM培养基稀释至400 nmol·L-1,分别向其中加入20 μmol·L-1甘草酸、100 μmol·L-1熊去氧胆酸或400 μmol·L-1水飞蓟宾混合,48 h后,采用马尔文粒度仪(Zetasizer Nano ZS 90,Malvern Panlytical,英国)进行混合液中量子点的Zeta电位与水合直径检测。
1.3 统计学方法
实验中所涉及结果均为3批次不同样品结果的平均值。数据处理应用SPSS 16.0进行。组间数据差异基于方差分析进行,两组数据之间的对比则应用LSD法。P<0.05代表差异具有显著性差异。
2 结果
2.1 量子点理化性质表征
经TEM检测,所得量子点为单分散纳米粒子,平均粒径为(5.35±0.94) nm(图1A)。为进一步表征合成的量子点,笔者对其吸收及荧光发射光谱(380~700 nm)进行检测,所得结果显示量子点在所测范围内具有较长的吸收光谱及良好的荧光发射光谱。最大发射波长可确定在560 nm(图1B),为绿色荧光。该量子点可用于后续毒性研究中。
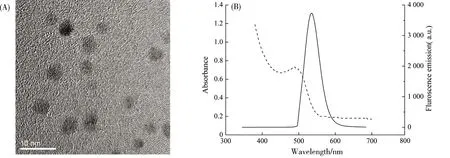
(A)量子点透射电镜图,表征量子点直径;(B)量子点溶液紫外/可见吸收(虚线)及荧光发射光谱(实线),激发波长为340 nm。
2.2 量子点引起的毒性及氧化应激压力检测
经量子点处理后,SK-BR-3细胞表现出明显的细胞毒性(图2),且半数致死量可确定在100 nmol·L-1附近。进一步对其引起的氧化应激压力检测可知,细胞中的GSH水平及SOD酶活均随量子点浓度的升高而降低,而MDA水平则随量子点的处理而逐渐上升。例如,经25 nmol·L-1量子点处理后,细胞GSH水平、SOD酶活及MDA分别为对照组的(86.32±3.33)%,(86.79±7.85)%及(111.20±14.06)%,即变化不大。但当量子点浓度增长为100 nmol·L-1后,上述参数变为(43.31±7.70)%,(59.18±12.00)%及(179.39±42.18)%。可见量子点的细胞毒性伴随着氧化应激压力的产生。更重要的是,同等游离浓度的Cd2+尚未产生显著的毒性,不论是细胞活率,或者GSH,SOD及MDA水平均未发生显著变化,因此本实验中所用的MPA-CdTe量子点毒性主要来自于自身。

图2 量子点(A)及CdCl2(B)处理SK-BR-3细胞48 h后引发的毒性及氧化应激损伤
2.3 中药成分对量子点毒性影响
通过与量子点共处理细胞,3种中药成分表现出不同的效果(图3)。其中甘草酸与水飞蓟宾表现出浓度依赖性的减毒作用,而熊去氧胆酸则无明显效果。其中,量子点采用半数致死量附近的100 nmol·L-1作为对照,其造成的细胞活率为(49.69±1.93)%。经10 μmol·L-1甘草酸共处理后,细胞活率升高为(74.20±3.81)%(P<0.01),而20 μmol·L-1甘草酸共处理进一步将细胞活率提升至(85.47±1.31)%(P<0.001)。水飞蓟宾共处理组明显的细胞活率提升出现于最大浓度,即400 μmol·L-1处,细胞活率为(66.89±5.22)%(P<0.01)。熊去氧胆酸共处理组细胞活率并未有明显的改变。
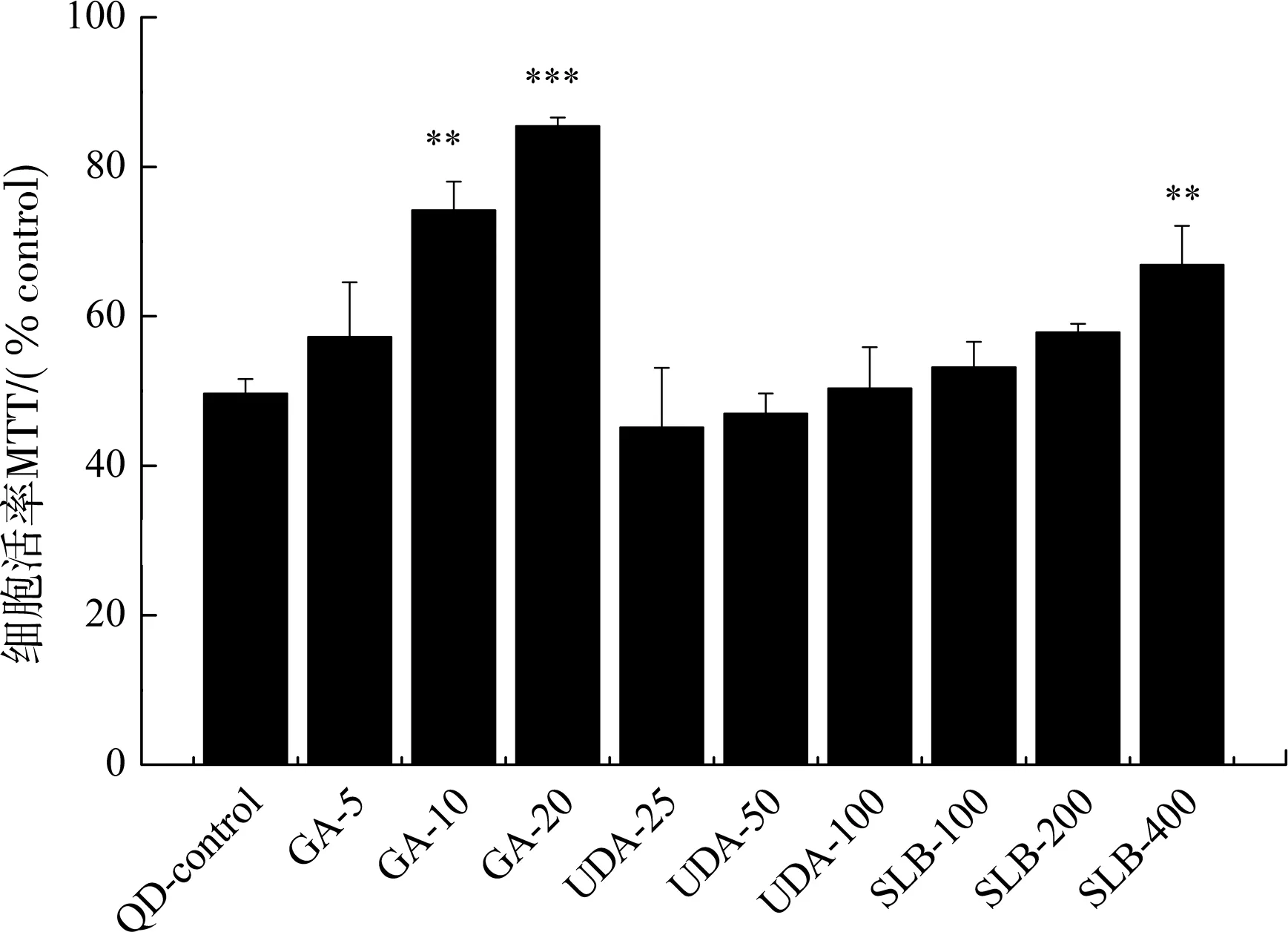
甘草酸(GA,5,10,20 μmol·L-1)、熊去氧胆酸(UDA,25,50,100 μmol·L-1)及水飞蓟宾(SLB,100,200,400 μmol·L-1)与100 nmol·L-1量子点共处理SK-BR-3细胞48 h后的细胞活率。**P<0.01,***P<0.001,对比于量子点单处理组。图3 中药成分与量子点共处理后细胞活率的升高情况 Fig. 3 Increase of cell viability after co-treatment of traditional Chinese medicine ingredients with quantum dots
2.4 中草药成分对量子点氧化应激压力的减小作用
为检测中草药成分对量子点的减毒作用来源,笔者针对两者共处理后细胞的氧化应激压力水平进行了检测(图4)。结果表明,甘草酸和水飞蓟宾能够浓度依赖性地降低细胞中的氧化应激压力,但熊去氧胆酸效果则较弱。例如,经100 nmol·L-1量子点处理48 h后,SK-BR-3细胞中的GSH水平为对照组的(43.31±7.70)%,但20 μmol·L-1甘草酸共处理可使细胞GSH水平至对照组相当的水平(P<0.001)。对应的,400 μmol·L-1水飞蓟宾共处理后细胞GSH水平为对照组的(73.14±11.85)%(P<0.01)。熊去氧胆酸100 μmol·L-1共处理后细胞GSH水平依然保持在(56.89±9.29)%,虽然较量子点单处理组有一定上升,但无显著性差异(P>0.05)。
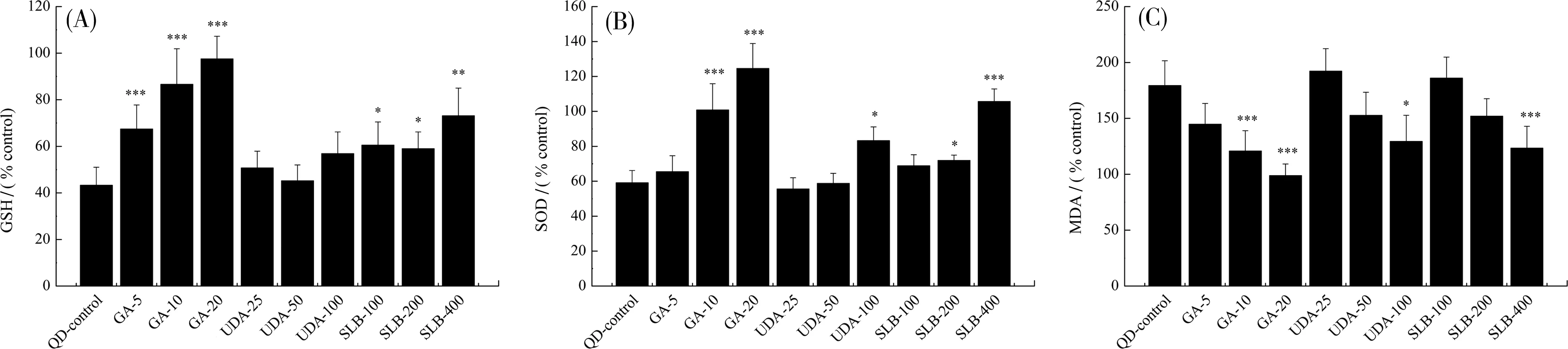
甘草酸(GA,5,10,20 μmol·L-1)、熊去氧胆酸(UDA,25,50,100 μmol·L-1)及水飞蓟宾(SLB,100,200,400 μmol·L-1)与100 nmol·L-1量子点共处理SK-BR-3细胞48 h后的GSH水平(A)、SOD活性(B)及MDA水平(C)。*P<0.05,**P<0.01,***P<0.001对比于量子点单处理组。
2.5 抗氧化酶的基因表达变化
为进一步阐释甘草酸及水飞蓟宾这两种中草药成分缓解量子点毒性的内在机理,笔者进一步对量子点单处理组及量子点和中草药成分共处理组的两种关键抗氧化酶GST及SOD的基因表达水平进行检测(图5)。结果表明,100 nmol·L-1的量子点处理可显著降低乳腺癌细胞中的GST及SOD基因表达水平,分别至对照组的0.40±0.25及0.78±0.23倍(P<0.05)。这些酶的基因表达水平可在GA及SLB处理后恢复,并最高可被诱导至对照组的6.34±0.37倍及6.84±0.58倍(20 μmol·L-1GA处理组,P<0.001)。
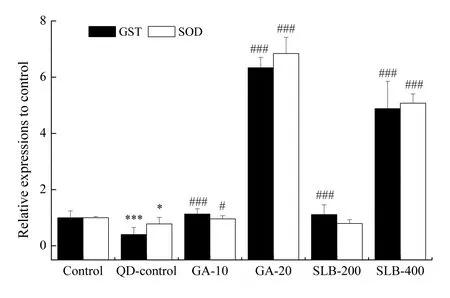
甘草酸(GA,10,20 μmol·L-1)及水飞蓟宾(SLB,200,400 μmol·L-1)与100 nmol·L-1量子点共处理SK-BR-3细胞48 h后的GST与SOD酶的基因表达水平。*P<0.05,***P<0.001对比于未处理对照组;#P<0.05,###P<0.001对比于量子点单处理组。
2.6 ABC转运蛋白的基因表达变化
本文还探索了中草药成分与量子点对ABC转运蛋白表达的影响。如图6所示,100 nmol·L-1量子点可显著诱导MDR1与MRP1的基因表达,使其表达量分别为对照组的6.03±1.48倍及5.46±1.69倍(P<0.001)即为可促进多药耐药现象的产生。但这种促进作用被甘草酸及水飞蓟宾降低,最低可分别至对照组的3.03±1.18倍及3.75±1.02倍(P<0.001)。
2.7 中草药成分与量子点的直接相互作用研究
为避免中草药成分与量子点之间的直接作用对其毒性产生影响,笔者对两者混合48 h后的量子点Zeta电位与水合直径进行检测。结果表明,中草药成分的存在并未影响量子点的表面电荷与水合直径(表2,P>0.05),即中草药成分与量子点并未发生明显的相互作用。
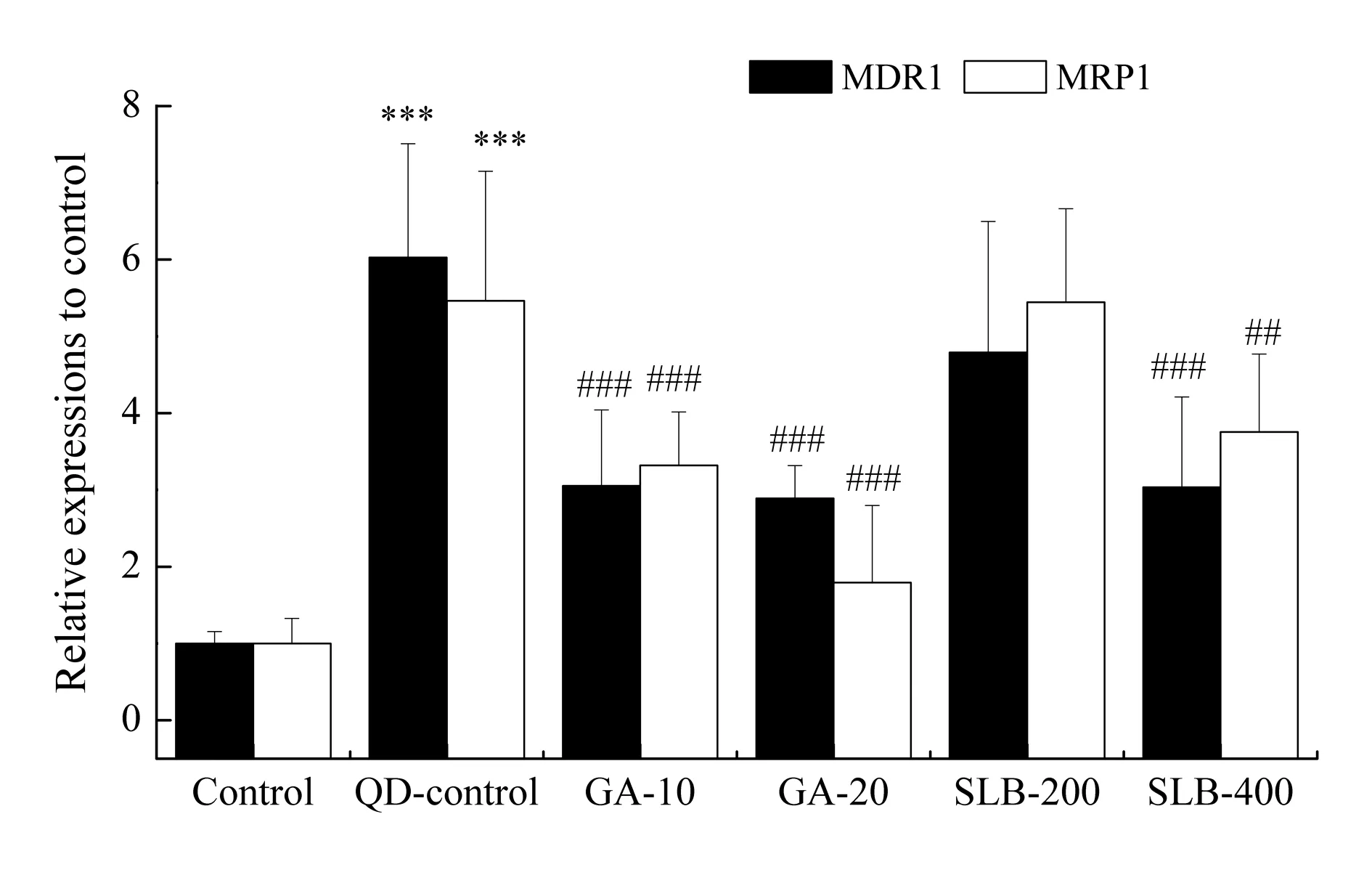
Fig. 5 Gene expressions of anti-oxidative enzymes of cells treated with Chinese herbal ingredients and quantum dots甘草酸(GA,10,20 μmol·L-1)及水飞蓟宾(SLB,200,400 μmol·L-1)与100 nmol·L-1量子点共处理SK-BR-3细胞48 h后的MDR1与MRP的基因表达水平。***P<0.001对比于未处理组; ##P<0.01,###P<0.001对比于未处理对照组。

表2 中草药成分与量子点相互作用后的Zeta-电位和水合直径
3 讨论
尽管具有良好的光学特性,基于量子点开发的载体药物及荧光探针依然无法进入临床及动物实验,这主要是因为其潜在的生物毒性[27]。在传统研究中,量子点释放的游离Cd2+被认为是量子点毒性的主要来源[28,29]。为此,研究者构建了CdS或ZnS壳层结构来减少Cd2+释放,或通过更换核心结构,如开发AgS及ZnS乃至碳量子点[30,31]。遗憾的是,这些努力并不能完全消除量子点本身的毒性,如碳量子点被发现仍会抑制小球藻的生长[32]。这是因为量子点毒性来源可能来自于自身的纳米效应[33]。然而,不论游离Cd2+还是量子点自身的纳米效应,均被发现通过诱导过氧化压力引发细胞及器官毒性[34,35]。因此,本文以具有较多毒性报道的MPA-CdTe 量子点为代表[36],以文献报道中具有较强抗氧化能力的甘草酸、水飞蓟宾及熊去氧胆酸为中药成分代表[37-39],研究中药成分对量子点的解毒作用,以期推出用于量子点应用配伍及毒性治疗法的方案。
应用MPA-CdTe 量子点,笔者发现其对SK-BR-3细胞造成了浓度依赖性的毒性,表现为细胞活率的下降及氧化应激压力的上升(图2A)。该结果与文献报道的量子点毒性机理一致,并揭示过氧化损伤为量子点毒性的重要来源[36]。通过与同等浓度的游离Cd2+作用效果对比可知,该量子点的毒性主要来源于自身,因其释放的Cd2+尚不足以引发细胞的任何变化(图2B)。事实上,这也与文献之前报道的结果一致,即量子点毒性往往大于其可能释放的重金属离子[40]。因此提示针对量子点的毒性研究应更多地关注其自身的纳米效应。
进一步地,量子点毒性可能被甘草酸、熊去氧胆酸及水飞蓟宾等中药成分缓解(图3)。报道发现[41-43],甘草酸、熊去氧胆酸及水飞蓟宾均具有较强的还原性,可降低配伍药物引发的过氧化压力,进而起到解毒的作用。然而笔者的实验结果表明,仅有甘草酸表达出了较强的解毒效果,水飞蓟宾效果相对较弱,熊去氧胆酸则未见效果。这可能与不同试剂的还原性大小相关,即不同草药成分对细胞氧化应激压力的降低能力不同,并通过本实验中GSH,SOD及MDA的检测得到了证明(图4)。更重要的是,其他纳米粒子,包括纳米金、纳米银、二氧化钛以及二氧化硅等纳米粒子均被发现引发了显著的细胞过氧化损伤[44],并被认为是纳米粒子共同的致毒性机理。因此本文结果表明,还原性中药成分不仅能够用于量子点毒性防治,也可用于其他纳米材料毒性的治疗中。
本文的研究结果表明,甘草酸和水飞蓟宾的处理还导致了抗氧化酶GST和SOD的表达水平上升(图5)。过去的文献表明,GST及SOD是机体及细胞实现消除过氧化压力,实现自我保护的主要蛋白[45]。其中,GST可通过催化GSH与重金属等外源物的结合反应,防止过氧化自由基的产生,起到解毒作用。SOD则是生物体内的抗氧化金属酶,能催化超氧阴离子自由基歧化生成氧和过氧化氢,在机体氧化与抗氧化平衡中起到至关重要的作用。已有众多的报道发现,GST及SOD均可在细胞或机体受到轻度过氧化损伤时上升表达,从而起到自我保护的作用[46,47]。然而,当外源物浓度超过细胞承受极限时,细胞出现严重损伤并出现GSH,GST及SOD水平的急剧下降(图2)。因此,甘草酸与水飞蓟宾的加入不仅实现了细胞过氧化损伤的修复,也有利于提升细胞自我保护机制,具有良好的保健效果。
此外,本文的一个有趣发现在于甘草酸与水飞蓟宾对于ABC转运蛋白的抑制作用(图6)。这一发现与文献报道的结果相符,表明中草药成分有作为转运蛋白抑制剂的潜力。长期的研究表明,包括MDR1及MRP1在内的ABC转运蛋白可在药物处理后上调,通过消耗ATP实现对多种药物的外排作用,也即多药耐药现象的产生。尽管迄今为止,已经过3代的抑制剂筛选,依然无法发现能够真正用于临床的多药耐药抑制剂[15,48]。这其中,生物安全性问题即为限制抑制剂使用的重要因素之一。有鉴于此,甘草酸、水飞蓟宾等中草药成分的高生物安全性可使其成为优良的ABC转运蛋白抑制剂,从而作为肿瘤治疗中的有效配伍成分。
考虑到中草药成分仍可通过与量子点结合改变其理化性质,进而降低其毒性。本文检测了培养基中量子点与各中草药成分混合后的水合粒径及表面电荷,结果表明其并无明显变化(表1)。与此同时,考虑到本文中所用MPA-COOH-QDs表面为负电荷,该类型量子点广泛报道的吸附对象为正电荷金属或其他正电荷底物,且作用机理为静电吸附[49,50]。而甘草酸、水飞蓟宾及熊去氧胆酸均为负电荷成分,因此其与量子点相互作用的可能性较小。因此,中草药成分的确通过影响细胞氧化应激通路,进而改变了量子点毒性,并可通过调控转运蛋白功能抑制多药耐药现象。
4 结论
本研究结果表明,MPA-CdTe量子点过氧化毒性主要来源于自身,而不是其释放的游离Cd2+。甘草酸及水飞蓟宾能够显著降低量子点的过氧化毒性、提高细胞抗氧化能力及抑制肿瘤细胞多药耐药作用,从而可以作为量子点应用中配伍药物,在降低细胞毒性的同时提高药物作用效果。
