2型糖尿病肾病并发骨质疏松大鼠模型研究
2020-11-24刘明明吕南宁许海燕华臻马勇黄桂成程建
刘明明 吕南宁 许海燕 华臻 马勇 黄桂成 程建
1.连云港市第二人民医院,徐州医科大学连云港临床学院,江苏 连云港 222000 2.徐州医科大学,江苏 徐州 221000 3.南京中医药大学骨伤研究所,江苏 南京 210000 4.南京中医药大学附属徐州市中心医院,江苏 徐州 221000
随着经济的快速发展,人们的生活水平、饮食结构得到了明显的改变,因而老年性相关的慢性代谢性疾病如2型糖尿病、骨质疏松症等的发病率也随之增加,这不仅降低了广大中老年人生活质量,也给社会带来了沉重的经济负担。我国作为世界第一人口大国,2型糖尿病的患病率在2017年统计已达10.4%,慢性微血管是2型糖尿病患者最常见的并发症,而糖尿病肾病又是对糖尿病患者影响最大的慢性微血管疾病,其发病率高达20%左右[1]。糖尿病肾病不仅是终末期肾病的最主要原因[2],同时也是糖尿病患者死亡的最重要原因[3-4]。大量的临床研究发现糖尿病肾病患者常常合并有骨质疏松症,其特征主要是各种原因导致的骨矿物质密度下降,骨骼强度受损,以及受到轻微外力即发生骨折,威胁着全世界数百万中老年人的健康与生活[5-6]。所以鉴于糖尿病肾病的高发病率以及严重危害中老年人的健康,其与骨质疏松症之间的关系愈来愈受到人们的关注。然而目前却鲜有对于糖尿病肾病并发骨质疏松的发病机制的研究,也没有明确疗效的治疗手段来阻逆它的进展。因此建立成功的2型糖尿病肾病并发骨质疏松的动物模型对于研究糖尿病肾病并发骨质疏松的发病机制及治疗手段具有重要的意义。然而,目前却缺少对糖尿病肾病并发骨质疏松的动物模型的建立方法与评价标准的研究,本文主要是研究糖尿病肾病并发骨质疏松的动物模型的建立方法以及对建模成功的衡量标准进行探讨,旨在为研究糖尿病肾病并发骨质疏松的发病机制及治疗手段提供基础依据。
1 材料和方法
1.1 造模动物及试剂
此次研究实验于2018年6月至2019年5月在徐州医科大学动物实验中心、连云港市第二人民医院完成。实验前已得到徐州医科大学动物实验伦理审批。
动物信息:随机选择雄性SD大鼠共70只,大鼠体重保持在(200±20) g,由徐州医科大学动物实验中心提供,合格证号:苏SYXK2008-0034。
试剂:链脲佐菌素(STZ)来自于calbiochem公司购买。由徐州医科大学动物实验中心统一配置高糖高脂喂养饲料,其配方采用目前实验经典配方:常规饲料66.5%,猪油10%,蔗糖20%,胆固醇2.5%,胆酸钠1%。
1.2 方法
1.2.1分组及处理:将70只正常SD大鼠随机分为2组,造模组50只,正常组20只。造模组予以高糖高脂饲料喂养,同时饮用12%果糖水。正常组予以普通饲料喂养,饮用正常自来水。4周后禁食12 h,造模组大鼠和正常组大鼠分别予以左下腹一次性注射链脲佐菌素(35 mg/kg)和柠檬酸缓冲液(0.1 mol/L)。两组注射完成后继续喂养4周,每周观察两组大鼠的尿量、进食量、饮水量、血糖以及体重。实验结束时造模组大鼠血糖<16.7 mmol/L、尿糖为阴性、尿蛋白定量<20 mg/24 h予以剔除,不计入统计[7-8]。
1.2.2骨密度:使用乙醚吸入式全身麻醉对两组大鼠进行全身麻醉,将麻醉后大鼠平躺于双能X射线骨密度仪(DXA)探头下,测量全部大鼠的骨密度(全身和左股骨)。
1.2.3生物力学实验检测骨强度:通过载荷-变形曲线可以获得股骨的结构力学参数,通过应力-应变曲线可以获得股骨的材料力学参数。采用股骨三点弯曲实验方法,记录载荷-变形曲线与应力-应变曲线。取出各组左侧股骨,去除股骨表面附着的软组织,各标本在制作过程中均用生理盐水纱布包裹。然后进行股骨生物力学测试,分别记录股骨的载荷-变形与应力-应变曲线。
1.2.4血及尿标本观察指标:通过代谢笼收集大鼠24 h尿液,并进行24 h尿蛋白定量及尿肌酐(Ucr)等相关指标检测。内眦取血,测定血肌酐(Scr)。依公式:Ccr=Ucr×24 h尿量/Scr计算Ccr。无水乙醚吸入麻醉后,开胸取心脏血,测定AST、ALB、ALT等生化指标。采用分光光度法和ELISA法测定大鼠血清中骨代谢相关指标:血Ca、血P、TALP、TRAP的变化。
1.2.5肾肥大指数:全部大鼠取双肾,用电子天平称重,肾肥大指数=肾重/体重。
1.2.6普通光镜观察:取大鼠右肾组织,固定在10%中性福尔马林液中,石蜡包埋,切成3 μm厚的切片,脱蜡水化,并进行HE染色,然后使用普通光学显微镜观察大鼠肾组织形态结构等。取大鼠股骨,剔除多余肌肉等软组织,将其固定甲醛(4%)溶液中,然后置于脱钙液(水杨酸、蒸馏水、36%盐酸、冰醋酸、)中脱钙48 h。沿股骨矢状面切成5 μm薄片,并进行HE染色。光学显微镜下,观察骨组织形态学变化。
1.3 数据分析
应用软件SPSS 13.0进行数据分析,数据使用平均值±标准误的形式表示,如果组间比较则采用独立样本t检验分析,对于多样本间比较则用方差分析方法,常规组间差异以P<0.05为有统计学意义。
2 结果
2.1 一般情况
正常组大鼠饮食、饮水无异常,大小便正常,精神状态良好,活泼健壮,毛发有光泽,体重随着周数的增加而增加,无死亡。造模组自注射链脲佐菌素2周后,大鼠明显表现为精神萎靡,反应迟钝,多饮、多食、多尿、体毛松散,活动减少,动作迟缓,部分出现腹泻,便秘、肠梗阻的交替症状。实验过程中,造模组1只大鼠因血糖不达标被剔除,3只因尿蛋白不达标被剔除。另外,造模组在腹腔注射链脲佐菌素成功后的4周内先后有4只死亡,最后在第8周造模组成功造模糖尿病肾病并发骨质疏松大鼠模型42只,造模成功率为84%。
2.2 体重、进食量、饮水量、肾重及肾肥大指数比较
建模之前,两组大鼠间体重、进食量及饮水量差异无明显差异性(P>0.05,见表1),喂养8周建模成功后,造模组大鼠体重明显低于正常对照组,造模组相较于正常组进食量与饮水量大幅度升高,差异有明显统计学意义(P<0.01,见表1)。并且造模组肾脏肥大明显,肾肥大指数显著高于正常组,差异有明显统计学意义(P<0.01,见表2)。

表 1 两组大鼠实验前后的体重、进食量及饮水量比较Table 1 Comparison of body weight, food intake, and water intake between the two groups before and after the experiment

表2 两组大鼠第8周肾重及肾肥大指数比较
2.3 血糖、24 h尿量及尿蛋白的改变
实验前两组大鼠的血糖、24 h尿量及尿蛋白比较无明显差异性(P>0.05,见图1~3),造模组予以高糖高脂喂食后,造模组的血糖及24 h尿量、尿蛋白逐渐增加,每2周所测得的血糖及24 h尿量、尿蛋白均较正常组增高,其差异有统计学意义(P<0.05)。4周后造模组予以STZ注射后,造模组的血糖及24 h尿量、尿蛋白异常增高。

图1 两组大鼠不同时间段的血糖比较Fig.1 Comparison of blood glucose between the two groups in different time periods
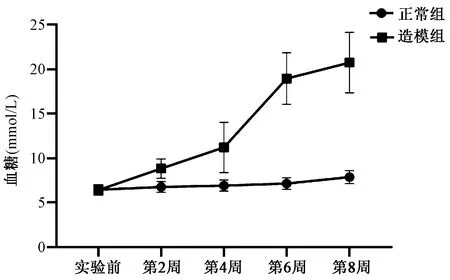
图2 两组大鼠不同时间段24 h尿量比较Fig.2 Comparison of 24 h urine volume between the two groups in different time periods

图3 两组大鼠不同时间段24 h尿蛋白量比较Fig.3 Comparison of 24 h urinary protein between the two groups in different time periods
2.4 两组大鼠第8周血、尿生化指标的对比
第8周检测两组大鼠血Ca、P和尿Ca、P指标,造模组血Ca、P明显低于正常组血Ca、P,差异有统计学意义(P<0.01,见表3),且造模组尿Ca、P含量明显高于正常组,差异有统计学意义(P<0.01,见表3)。

表3 两组大鼠第8周血Ca、P和尿Ca、P比较
第8周检测两组血清肌酐(Scr)、血尿素氮(BUN)、尿肌酐(Ucr)指标,造模组血清肌酐、血尿素氮明显高于正常组,差异有统计学意义(P<0.01,见表4),而造模组尿肌酐含量明显低于正常组,差异有统计学意义(P<0.01)。

表4 两组大鼠第8周Scr、BUN、Ucr指标比较
第8周检测两组血清总碱性磷酸酶(TALP)、抗酒石酸酸性磷酸酶(TRAR)指标,造模组TALP、TRAR明显高于正常组,差异有统计学意义(P<0.01,见表5)。

表5 两组大鼠第8周TALP、TRAR指标比较
2.5 生物力学及骨密度对比
第8周取各组左侧股骨,测量两组的生物力学指标,结果显示造模组的极限载荷、弹性模量和弯曲强度均低于正常组,差异有统计学意义(P<0.05,见表6)。

表6 两组大鼠第8周左侧股骨的极限载荷、弹性模量和弯曲强度指标对比
第8周采用双能X线检测两组大鼠全身、股骨骨密度(见图4)。与正常对照组大鼠相比,造模组大鼠的全身及左股骨骨密度均明显降低,差异有统计学意义(P<0.05,见表7)。

表7 两组大鼠第8周全身及左股骨密度比较(g/cm2)

图4 两组大鼠X线扫描图Fig.4 X-ray scan of rats in the two groups
2.6 大鼠肾、骨病理学观测
正常组大鼠肾皮质区肾小球及肾小管形态基本正常;造模组大鼠肾小球基底膜变厚,系膜基质扩张,肾小管出现空泡样病变,足细胞足突大量融合,甚至脱落丢失。正常组大鼠骨小梁形态基本正常,骨小梁粗大、均匀,排列紧凑,互相连接成网格状结构,并且骨髓腔清晰,形态规整。造模组大鼠显微镜观察骨小梁明显稀疏,小梁之间的间隙变大,小梁变细,数量减少,连续性中断,常见游离断增多,骨髓腔增大,且呈不规则形态。见图5。
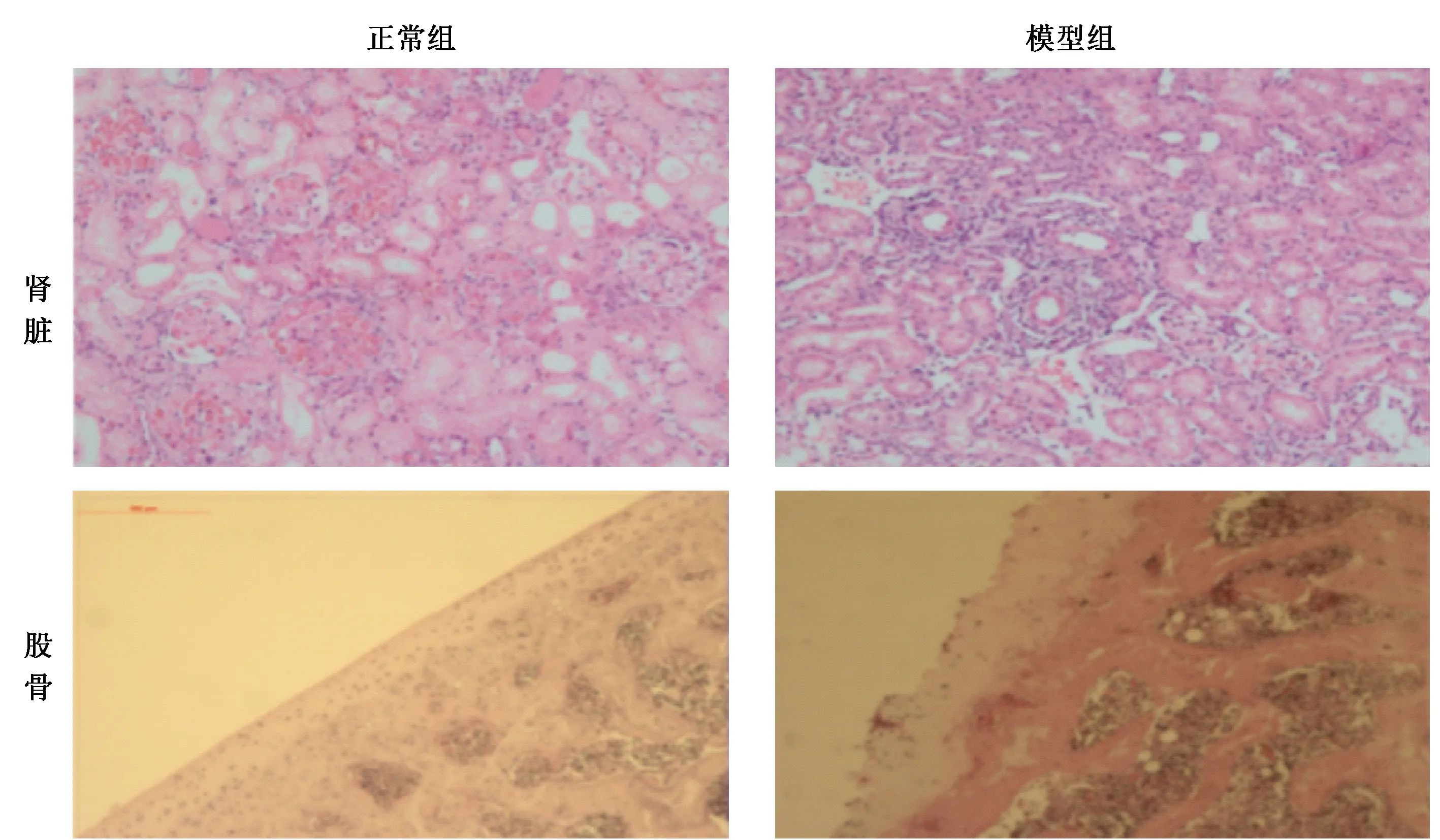
图5 两组大鼠肾、骨组织HE染色观察Fig.5 HE staining observation of the kidney and bone tissue in rats of the two groups
3 讨论
随着糖尿病肾病患者的病程进展,高血糖产生的渗透性利尿,使尿中钙、磷等排出增加,从而引起机体内骨代谢紊乱。长时间的尿糖升高会引起肾小管的病变,阻碍肾小管的重吸收,Ca、P排泄增多,血Ca、P减少,代偿性的甲状旁腺素分泌增多,增强破骨细胞活性,骨吸收增加,骨密度下降[9]。另一方面,糖尿病肾病患者体内增多的糖基化终末产物,促进成骨细胞的凋亡,导致骨合成不足,骨量减少,骨组织的细微结构发生改变,骨小梁数量逐渐变少、变细,并出现断裂,导致骨质疏松症的发生。
随着目前2型糖尿病肾病并发骨质疏松的发病日益严峻,进一步防治该病,建立良好的2型糖尿病肾病并发骨质疏松的动物模型已经迫在眉睫。既往的传统研究主要集中在2型糖尿病肾病的动物模型,而对于并发骨质疏松的2型糖尿病肾病的研究较少。传统的2型糖尿病肾病动物模型的建立方法主要有3种,包括自发性、诱发性和转基因动物模型。然而由于在自发性与转基因动物模型发病过程中遗传因素占据主导作用,这与临床上糖尿病肾病的病理特点并不完全相符,且这种模型动物在我国来源有限、价格昂贵,极大地限制了相关研究的开展。诱发性动物模型中,三联法(高能量饮食+STZ注射+单侧或部分肾切除)虽然造模时间较短,具有显著的生化、病理改变,但是存在操作复杂、容易感染、死亡率高的弊端[10],因此,从价格、操作性、死亡率、成模率等方面考虑,诱发性动物模型中高能量饮食联合STZ诱导的动物模型是目前较为理想的2型DN模型。高能量饮食(高糖、高脂、高糖高脂饲料)诱导胰岛素抵抗,4周后再通过注射小剂量链脲佐菌素,从而破坏部分胰岛β细胞,刺激胰岛素分泌减少,从而形成2型糖尿病肾病模型[11],此次实验通过高能量饮食诱导胰岛素抵抗,联合链脲佐菌素破坏部分胰岛β细胞,第8周时成功建立糖尿病肾病并发骨质疏松动物模型,成功率在84%。
临床糖尿病肾病并发骨质疏松主要表现为持续的血糖、糖化血红蛋白的升高,大量蛋白尿,并有饮水量多、尿量多和消瘦以及骨密度下降的症状。对于糖尿病肾病患者来说,尿蛋白的检测是其诊断的金标准之一,研究发现通过减少糖尿病患者的尿蛋白的排泄可以减少或者延缓糖尿病肾病的发生和病程进展[12-13]。不论是DN还是其他类型的肾病,蛋白尿与肾病的进展密切相关[14-15]。微量蛋白尿不仅是早期肾损伤的信号,出现微量蛋白尿时往往代表着患者肾小球已出现了广泛损伤,其出现可增加患者的死亡率[16]。本次实验中造模组在高糖高脂喂食后,尿量和尿蛋白逐渐增加,在第4周利用链脲佐菌素注射进行诱导后,造模组大鼠的尿量和尿蛋白与对照组相比,均明显增高。随着糖尿病肾病大鼠的肾功能逐渐下降,在第6周后,造模组大鼠的肾脏逐渐发生衰竭,尿量逐渐下降。在第8 周末,造模组大鼠的尿素氮、肌酐升高,体重增长缓慢,并且骨密度以及骨骼生物力学检测明显下降,符合糖尿病肾病并发骨质疏松的临床特点。最后病理组织染色显示正常组大鼠肾皮质区肾小球及肾小管形态以及骨小梁形态基本正常;造模组大鼠肾小球基底膜变厚,系膜基质扩张,足细胞足突大量融合,甚至脱落丢失。造模组大鼠骨小梁明显稀疏,小梁之间的间隙变大,小梁变细,数量减少,连续性中断,常见游离断增多,符合临床糖尿病肾病并发骨质疏松的病理特点。
本研究的意义在于:选择了模型大鼠的基础指标,包括血糖、体重、饮水量、尿量、尿蛋白、血脂、肾功能、骨密度及生物力学等,提供与临床糖尿病肾病并发骨质疏松的特点相符合的表现和数据性资料。表明STZ 诱导的糖尿病肾病并发骨质疏松模型具有成模快的特点,6周时已有大量蛋白尿的肾损伤表现,与人类糖尿病肾病高度相似,在第8周时骨密度明显下降,病情严重程度与病程相一致的特点。本研究成功建立了糖尿病肾病并发骨质疏松动物模型,为深入研究糖尿病肾病并发骨质疏松提供了基础。
