脓毒症患者血清PCT、CRP、IL-6 和IL-10水平检测及临床意义
2020-11-23韦小碗邹远妩梁亚萍
王 婷,韦小碗,杨 亮,邹远妩,梁亚萍,王 卓
1.陕西省安康市中心医院(安康725000);2.陕西省结核病防治院(陕西省第五人民医院)(西安710100)
脓毒症(Sepsis)是机体由于病原体进入血液循环而引发的全身炎症反应综合征(Systemic inflammatory response syndrome,SIRS),是诱发机体出现脓毒性休克及多器官功能衰竭的主要诱因,具有病情凶险、疾病迅速发展、病死率高的特点[1]。相关研究报道,脓毒症总体病死率达32.2%~55%,错过最佳治疗时间1 h,将增加5%~10%的死亡风险,且ICU约有40%~55%的脓毒症患者在30 d内因继发感染性休克而死亡[2]。因此,早期快速诊断对于脓毒症的治疗及预后至关重要。目前,国内外研究中关于与预测判断脓毒症或其预后相关的生物指标高达200多种[3],在临床工作中如何选择较高诊断价值的检验指标具有重要的意义。降钙素原(Procalcitonin,PCT)、C-反应蛋白(C-reactive protein,CRP)、白细胞介素 6(Interleukin 6,IL-6)、白细胞介素10(Interleukin 10,IL-10)是与机体发生感染或发展为脓毒症等感染性疾病密切相关的炎性指示物,但其在临床工作中对于脓毒症的预测判断价值还尚未明确[4]。本文通过分析比较脓毒症患者血清中炎性因子PCT、CRP、IL-6 和IL-10的水平变化,探讨血清中PCT、CRP、IL-6 和IL-10水平检测在脓毒症诊断中的临床价值。
资料与方法
1 一般资料 选择2015年1月至2018年12月在两院收治的40例脓毒症患者为脓毒症组、同期40例非感染性SIRS患者为非脓毒症组以及同期40例健康体检者为正常对照组。脓毒症组男27例,女13例,平均年龄(51.40±14.00)岁,平均BMI为(21.89±1.41)kg/m2;非脓毒症组男25例,女15例,平均年龄(49.85±13.78)岁,平均BMI为(22.34±1.48)kg/m2;正常对照组男23例,女17例,平均年龄(47.88±10.97)岁,平均BMI为(22.42±1.61)kg/m2。三组研究对象在性别、年龄、BMI之间比较均无统计学差异(P>0.05),具有可比性。病例纳入标准:①年龄>18岁并<80岁;②住院时间大于1 d;③脓毒症患者和SIRS患者的诊断严格依据《国际严重脓毒症及脓毒性休克诊疗指南(2012版)》的诊断标准[5];④非感染性SIRS患者血培养结果阴性,无感染灶,但依据上述标准诊断明确SIRS;⑤所有研究对象的临床资料完整。排除标准:①住院过程中要求转院、放弃治疗以及资料或结局不完整、无法追踪者;②入院前患有严重的脏器功能损伤者;③患有其他全身免疫性疾病,如HIV感染或恶性肿瘤者。本研究取得本院伦理委员会的批准,并取得患者及家属的知情同意。
2 仪器与试剂 主要试剂:血清PCT检测试剂盒,血清CRP检测试剂盒,血清 IL-6 ELISA试剂盒、血清IL-10 ELISA试剂盒。主要仪器:罗氏 Cobas E601电化学发光免疫分析仪,GETEIN1600荧光免疫定量分析仪。
3 检测方法 入院 24 h内抽取静脉血3~5 ml,4℃,3500 r/min离心5 min,取上清置于无菌小型离心管中,-80℃冻存。待所有样本收集完后,将血清取出冻融进行检测。血清PCT检测采用电化学发光法进行检测;血清CRP水平的检测使用GETEIN1600荧光免疫定量分析仪(基蛋生物科技公司)及相关试剂进行;血清 IL-6、IL-10 水平的测定使用酶联免疫吸附试验(ELISA)方法进行检测。
4 研究方法 根据脓毒症组患者28 d后是否存活将其分为存活组(n=24)和死亡组(n=16)。收集所有研究对象的年龄、性别、身高、体重等一般人口学资料,并追踪患者入院28 d内患者的存活情况。

结 果
1 三组研究对象检测指标比较 三组研究对象血清PCT、CRP、IL-6及IL-10水平之间比较差异均有统计学意义(P<0.01);脓毒症组血清中PCT、CRP、IL-6及IL-10水平均高于非脓毒症组和对照组,差异均有统计学意义(P<0.05);非脓毒血症组血清中PCT、CRP、IL-6水平均高于对照组,差异均有统计学意义(P<0.05);IL-10水平在非脓毒症组和正常对照组之间无统计学差异(P=0.33)。见表1。
2 脓毒症组不同预后患者检测指标比较 脓毒症组40例研究对象中存活者24(60.00%)例,死亡患者16(40.00%)例。死亡组血清中PCT、CRP、IL-6 及IL-10水平均显著高于存活组,差异有统计学意义(t=3.23,P<0.01;t=2.26,P=0.03;t=2.39,P=0.02;t=2.19,P=0.04)。见表2。
3 各检测指标对脓毒症的诊断价值 研究对象血清中PCT、CRP、IL-6及IL-10的ROC曲线(图1)。血清PCT对脓毒症诊断的曲线下面积(AUC)最大为0.84,灵敏度为87.50%,特异度为81.25%,最佳临界值为1.13 ng/ml;CRP的 AUC为0.76,灵敏度为75.00%,特异度为86.25%,最佳临界值为63.95 mg/ml;IL-6的 AUC为0.80,灵敏度为72.50%,特异度为88.75%,最佳临界值为105.20 pg/ml;IL-10的 AUC为0.76,灵敏度为82.50%,特异度为80.00%,最佳临界值为84.13 mg/ml。见表3。

表1 三组研究对象检测指标比较

表2 脓毒症组不同预后患者检测指标比较
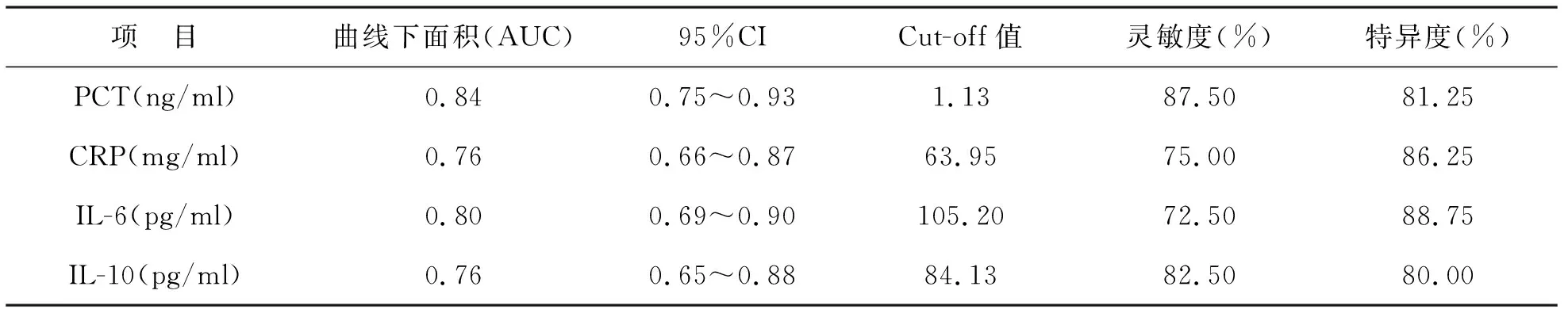
表3 各检测指标对脓毒症的诊断价值
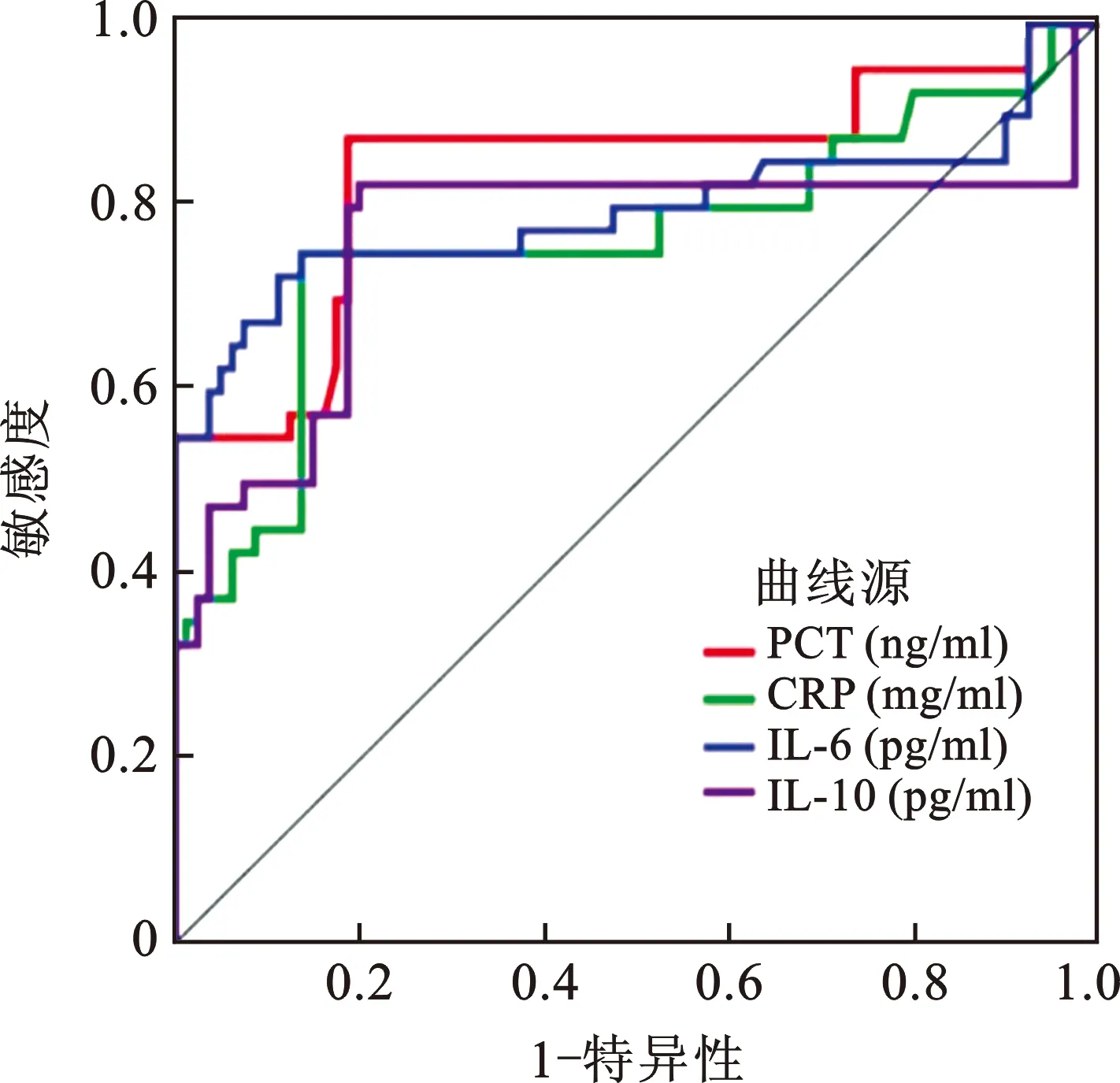
图1 PCT、CRP、IL-6、IL-10诊断脓毒症ROC曲线
讨 论
1 脓毒症炎症因子的研究现状 机体在各种原因作用下发生的一系列综合行的全身炎症反应称为SIRS,脓毒症是指基肽因发生感染而出现的SIRS,可进一步恶化,出现脓毒性休克或多器官功能障碍综合征(Multiple organ dysfunction syndrome,MODS)。近年研究表明[6],在脓毒症炎症的起始阶段,机体在外界作用下产生应激发生,并通过直接激活中性粒细胞、单核、淋巴细胞合成分泌细菌毒素或通过花生四烯酸的代谢间接促进合成分泌多种炎性物质和毒素,且多种炎症物质间互相作用影响,产生进阶反应,导致机体发生“瀑布样”的炎症反应;此外,细菌的内毒素和外毒素可直接作用于机体,增加血管的通透性,导致血小板的粘附,纤维蛋白的沉着,中性粒细胞脱颗粒或外逸,氧化反应产物增多,从而导致机体出现脓毒性休克或MODS。既往研究结果提示脓毒症是重症患者死亡的第一原因,且逐年增加[7]。本研究结果病死率为40.00%(16/40),与既往研究基本一致。多种炎性介质包括细胞因子及炎性物质的合成分泌均伴随着脓毒症的发生发展过程,且炎性物质对于脓毒症的进展及预后情况均具有重要的临床指导意义[8]。目前,与脓毒症预后判断的相关生物标记物多达 200多种,包括PCT、CRP、炎症反应介质TNF-α、IL-1和IL-6,抗炎症介质IL-4、IL-10和IL-13等炎症因子。既往有研究结果提示机体内炎性物质水平的变化情况对于临床诊断脓毒症病情进展情况以及转归情况[9]。临床工作中血液培养是诊断脓毒血症的金标准,但该诊断方法阳性率较低,且因依赖于微生物的自身生长周期,导致临床上对脓毒血症的诊断的限制,且有研究认为,约30%脓毒血症患者的血液微生物培养结果不一致;此外,由于脓毒血症缺乏特异性的早期临床症状,因此增加鉴别和诊断难度[10]。目前临床工作中对于脓毒血症的早期识别与诊断人缺乏客观的检验指标。因此,探索准确性较高的早期诊断方法或指标对临床上早期识别脓毒症、判断病情进展情况,并及时有效地采取治疗措施,改善预后具有重要意义。
2 血清PCT、CRP、IL-6 和IL-10在脓毒症中的变化及其诊断价值 临床诊断工作中,CRP是常见的炎症标记物质,属于急性期蛋白,正常健康人血清CRP浓度<10 mg/L,在机体处于全身感染状态时,CRP可在感染后4~6 h逐渐增加,36~50 h达高峰,峰值可达350~400 mg/L,可用于对患者治疗效果的评价与监测,为机体早期鉴别感染类型具有重要的临床参考价值[11]。本研究分析结果显示,脓毒症组患者血清CRP水平较非脓毒血症组和正常对照组明显升高;脓毒症不同预后患者CRP间也存在统计学差异,死亡组CRP的水平明显高于存活者。本实验结果显示,血清CRP的最佳诊断临界点为63.95 mg/ml时,灵敏度为75.00%,特异度为86.25%,AUC=0.76(95%CI:0.66~0.87)。提示机体血清CRP水平可作为指导临床诊疗活动的检验指标之一。IL-6是具有多重免疫调节功能的前炎症细胞因子,由单核、巨噬、内皮细胞在炎性因子刺激下产生,同时还具有刺激机体产生CRP、PCT 等炎性因子的作用,在细菌感染2~3 h即可达到峰值,在临床多用于诊断感染性疾病,且在鉴别诊断细菌感染和病毒感染具有较高的价值[12]。本研究结果显示脓毒症组IL-6水平明显高于非脓毒血症组和正常对照组,其结果也既往研究基本一致[13]。此外,本研究结果显示脓毒症死亡组IL-6的水平高于存活者,提示IL-6与脓毒症患者预后相关,即脓毒症患者的预后随IL-6水平的增高而越差。本研究结果显示,IL-6的最佳诊断点为105.20 pg/ml时,灵敏度为72.50%,特异度为88.75%,AUC=0.76(95%CI:0.69~0.90),提示 IL-6可以作为鉴别脓毒症的有效指标,并预示脓毒症患者预后。IL-10是由Th2细胞产生的抗炎细胞因子之一,在机体内主要抑制和终止炎性反应,相比于其他T细胞因子,IL-10的生物合成较晚,在炎性细胞刺激24~48 h后开始生物合成,且单核细胞分泌因子IL-10也相对较晚。IL-10可调节机体多余的促炎细胞因子,对促炎细胞因子如 IL-6等具有较强的抑制作用,可减少促炎细胞因子的释放,对脓毒症病情的控制和抑制远处脏器损伤有着重要作用,但血清IL-10水平过高,则诱导功能性免疫状态,易引发不可控的感染[14]。本研究结果显示脓毒症组血清中IL-10水平均高于非脓毒症组和正常对照组,且脓毒症死亡组血清中IL-10水平高于存活组,提示IL-10是脓毒症患者病情严重程度和死亡的预测因子之一。本研究结果显示,IL-10的最佳诊断点为84.13 pg/ml时,灵敏度为82.50%,特异度为80.00%,AUC=0.76(95%CI:0.65~0.88),提示机体血清IL-10的含量水平可早期预测脓毒症的发生发展[15]。PCT是一种非类固醇型的抗炎性物质,是物质降钙素的前体物,常只由甲状腺滤泡旁细胞分泌,在正常人体液中含量甚少,通常<0.1 μg/L,在细菌毒素侵入人体时,炎性细胞会刺激机体产生PCT,2~3 h迅速升高,8~24 h后 PCT浓度达到高峰,半衰期约为20~24 h,当血清PCT >0.5 μg/L时,则提示机体处于病理状态;当机体处于无炎症状态或机体具有局部病毒性感染时,血清PCT含量波动不明显[16-17],因此,血清PCT在炎性反应中特异性较高。本研究结果显示脓毒症组血清中PCT水平均高于非脓毒症组和正常对照组,且脓毒症死亡组血清中PCT水平高于存活组,因此血清PCT的含量被许多学者作为危重症患者诊断全身性感染的重要指标之一,可预测患者全身性感染的严重程度,血清中 PCT浓度越高,表明机体全身性感染程度越严重,因此临床上通常用 PCT来监测全身性感染的病情变化。本研究PCT最佳诊断值为1.13 ng/ml,其诊断脓毒症的灵敏度为 87.50%,特异度为81.25%,AUC为 0.84(95%CI:0.75~0.93),提示 PCT相比CRP、IL-6和IL-10指标对脓毒症均具有较高的诊断价值。因此,PCT 不仅在脓毒症诊断鉴别及预测预后情况中均具有较高的价值,对于临床工作中脓毒症患者的治疗也有一定的指导意义。
综上所述,血清PCT、CRP、IL-6及IL-10水平在在脓毒症患者中明显升高,并与脓毒症患者的预后有一定的相关性,对于脓毒症的早期诊断、早期治疗、预测预后具有重要意义。PCT的灵敏性优于CRP、IL-6及IL-10,IL-6的特异性优于其他指标。但由于本研究样本量较小,结果可能会产生偏倚,在今后的研究中,应扩大样本量,以充实研究结果。
