氮化铝粉末的制备及扩大实验研究
2020-11-21张岩岩刘永鹤李东红
张岩岩,刘永鹤,李东红,王 毅
(中铝郑州有色金属研究院有限公司,河南郑州450041)
AlN(氮化铝)粉体是属于新一代高导热电子基板关键材料,符合战略性新兴产业重点产品和服务指导目录中新型功能陶瓷材料-高导热陶瓷。与传统陶瓷材料相比,AlN材料具有优异的导热性能,理论热导率为320 W/(m·K),是氧化铝的7~10倍,与金属铜和铝相当;力学性能与Al2O3陶瓷相当;绝缘性能好(大于15 kV/cm);与硅及SiC相匹配的热膨胀系数;无毒、耐热冲击性好、耐等离子体侵蚀等。从而在电子、国防、信息、交通、航空航天、军工、通讯等诸多领域有良好的应用前景[1-2]。
氮化铝的合成方法主要有铝粉直接氮化法、碳热还原法、化学气相沉积法、高温自蔓延合成法等[3]。但由于化学气相沉积法原料价格高、设备复杂、产率低且产物氧含量高,实际工业应用意义不大;高温自蔓延合成法反应不易控制、技术成熟度低,产品质量不稳定且对设备的要求较高,目前也没有大规模的工业化应用[4]。已经应用于工业化生产的方法为碳热还原法和铝粉直接氮化法,如日本德山、日本东洋铝业、美国Surmet等企业。但铝粉直接氮化法[5]制备的氮化铝粉末形貌不规则、存在团聚、粒度分布宽、需要研磨过程。相比较而言,碳热还原法制备的氮化铝粉末近球形、纯度高、烧结活性高、粉末粒度细小、粒径分布窄且原料来源广[6-8]。本文在实验室研制的基础上,以α-Al2O3、γ-Al2O3,Al(OH)3、工业氧化铝等为铝源,以乙炔黑、碳黑、葡萄糖、树脂等为碳源做系统研究,考虑了氮化温度、反应时间、添加剂、原料处理及造粒工艺对合成氮化铝粉末性能的影响,对碳热还原法制备氮化铝扩大实验研究做了初步探讨。
1 实验
1.1 原料、试剂与仪器
试剂:工业氧化铝、高纯氧化铝、乙炔黑、葡萄糖、酚醛树脂、无水乙醇、AlF3等,均为分析纯。
仪器:VSF448型真空高温炉、YK-120型摇摆造粒机、Exd BT4型砂磨机、GMJ/B型球磨机、行星球磨机、高速分散机、电子天平。
1.2 测试设备
采用Xpert PRO型X-射线衍射仪测试样品的组成、分子或原子内部结构等信息;采用JSM-6360LV型扫描电子显微镜对样品的形貌进行观察;采用ON836氧氮分析仪测试样品中的O、N含量;采用CS230碳硫分析仪测试样品中的C含量;采用2000粒度测试仪测试样品粒径大小;采用4510F原子吸收分光光度计测试样品中元素Si、Fe、Na等杂质元素含量。
1.3 实验方法
首先,制备前驱物。按照一定的比例分别称取不同的铝源、碳源、添加剂(原料铝源需经前处理),以无水乙醇为球磨分散介质,分散4 h。将分散后的混合物在鼓风干燥箱中80℃烘干,待粉体干燥后粉碎、过筛处理,即获得前驱体粉末。
其次,进行氮化还原反应。将前驱体粉末造粒并烘干,石墨坩埚中置入造粒烘干后的前驱物,最后装入真空高温炉中。先将炉内抽至真空状态,再洗炉一次,控制一定的氮气流量,保持炉内微正压。然后设置温度曲线,通电升温,在流动氮气气氛中将前驱物分别加温至1 400~1 750℃,反应产物在600~800℃的流动的空气中进行脱碳处理,再对产品进行物理、化学分析。
2 结果与讨论
2.1 不同铝源对反应产物的影响
本实验在实验室研制的基础上,以α-Al2O3、工业氧化铝、γ-Al2O3、Al(OH)3及处理过的Al2O3为铝源(记为B、C、D、E、F)做扩大实验,图1为5种铝源在1 550℃、保温3 h碳热还原反应合成AlN粉末的X射线衍射谱图,其中B铝源在碳热还原前经砂磨处理后与碳源混合。从图1可以看出,氮化率由大到小顺序为B、C、D、E、F,这是由于不同的铝源物相组成不一样,反应活性不同,完全氮化需要的温度和时间存在差异[9]。特别是在公斤级实验中,要保证高温炉膛内的气体与颗粒充分接触,气-固反应顺利进行,铝源的比表面积越大越好。

图1 不同铝源制备出试样的XRD谱图
粉体粒度是影响粉体使用的一个关键指标。普遍认为,要制得导热性好、性能优良的AlN陶瓷材料,必须首先制备出粒度细、粒度分布窄、杂质少的AlN粉末[10]。表1为5种铝源在1 550℃、保温3 h碳热还原反应合成AlN粉末的粒度对比。由表1可以看出,制备出的产品粒度由小到大依次为B、E、D、C、F,且B铝源的粒度分布较窄。综合以上结果,确定B为扩大实验铝源。
2.2 不同碳源对反应产物的影响
本实验以葡萄糖、炭黑、乙炔黑、树脂(记为1#、2#、3#、4#)为 碳 源 做 扩 大 实 验,图2为4种 碳 源 在1 550℃、保温3 h碳热还原反应合成AlN粉末的X射线衍射谱图。图示表明氮化率3#>2#>4#>1#。主要因为氮化过程中,随着温度的升高,有机高分子碳源(葡萄糖等)分解产生H2O和CO2,气体的产生阻碍了粒子间的团聚,而且容易与铝源均匀混合,使反应容易进行[9]。虽然葡萄糖与铝源混合较均匀,但作为碳源其与疏松、轻质、细小的乙炔黑效果相近。综合以上原因,确定3#为扩大实验的碳源。

图2 不同碳源制备出试样的XRD谱图
2.3 氮化温度对氮化铝结晶性的影响
氮化反应的温度是碳热还原法制备氮化铝粉末的一个重要工艺参数。查阅文献及实验室研究表明,提高氮化温度、延长保温时间有利于氮化反应进行,合成的氮化铝粉末纯度较高[11]。图3为本扩大实验在氮气气氛中、1 250~1 750℃、保温4 h合成粉末的XRD衍射谱图。由图3可见,在保温4 h的前提下,温度为T5时氮化完全,产物为单相的AlN粉末。
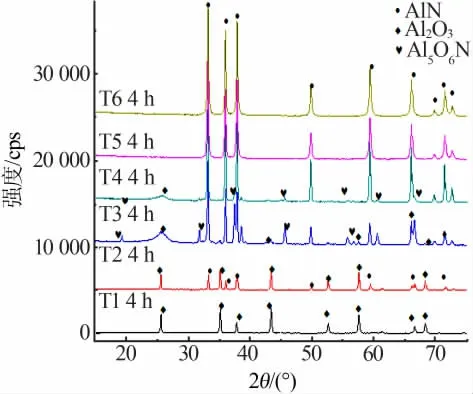
图3 1 250~1 750℃、保温4 h合成粉末的XRD谱图
图4为温度对氮化铝生成率的影响。由图4可以看出,随着温度的升高,反应的速度越来越慢。这主要和铝源的物相有关,α-Al2O3相比γ-Al2O3晶型稳定,反应活性差。在低温阶段,即1 250~1 450℃时,γ-Al2O3还未完全转化为α-Al2O3前已经开始氮化反应。
2.4 保温时间对氧化铝氮化反应的影响
如前所述,保温时间越长,氮化反应越完全[11]。本扩大实验在T4、T5温度下进行氮化反应,用相同的铝源、碳源且经过同样的工艺处理、设置一致的温控曲线,并保持氮气流量、流速一致,获得的氮化产物见表2。由表2可知,碳热还原法制备氮化铝扩大实验中,主要的反应产物有α-Al2O3、AlN、Al5O6N。在T4温度下,即使保温时间增至6 h,也很难实现氧化铝的完全氮化,如若再增大保温时间,能量消耗增多,成本递增,不利于工业生产;在T5温度下,随着保温时间延长,氮化率越来越高,当升至4 h时,产物为单相的AlN。因此扩大实验中欲制得单相的氮化铝粉体,反应温度要达到T5,且4 h为最少保温时间。

表2 不同保温时间的氮化反应产物
2.5 添加剂对氮化铝粉体结晶性的影响
加入一定量添加剂有利于氮化铝粉的合成[12-13],本扩大实验研究在实验原料中添加了additive-C以做研究。图5是在T5保温4 h合成粉末的XRD谱图。其中C、D添加了添加剂(质量分数不同),B未添加。从图5可以看出,虽然3个试样中的衍射峰都是AlN晶相的衍射峰,但添加添加剂的强度明显高于未添加的衍射峰强度,说明additive-C的加入有效降低了反应活化能,可将反应的活化能从250 kJ/mol降到190 kJ/mol,使AlN粉末的结晶度提高。
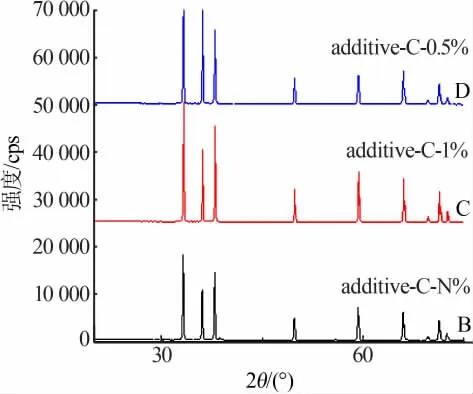
图5 5℃、保温4 h合成氮化铝的XRD谱图
2.6 中试实验及结果分析
工业化生产氮化铝粉体的关键是原料的混合和分散[14]。根据混合方法的不同制定了2种中试方案:1)采用高效分散机,将处理过的氧化铝粉、碳源、分散剂充分搅拌混合得前驱体;2)利用球磨罐将原料和分散剂一起球磨得均匀的前驱体,前驱体需再经造粒处理。经实验两种工艺制备出混合均匀的前驱体均可满足后续氮化实验的要求。但从工艺简单便利考虑,本扩大实验采用方案一,以铝源B、碳源3#为原料、在温度T5、保温4 h、additive-C-0.5%条件下进行了中试实验,实现单炉制备出5.4 kg氮化铝产品。将制备出的氮化铝粉体进行物相、电镜(图6)、粒度、化学成分、杂质分析(表3)。分析结果表明,该扩大实验制备出的氮化铝粉末形貌较好、粒度适宜、纯度较高、性能优良。

图6 中试实验合成氮化铝粉末SEM照片

表3 中试实验产品主要化学成分
3 结论
1)铝源B和3#碳源在碳热还原反应中氮化率更高,且经过砂磨处理后制备出的氮化铝粉体较细和均匀。2)在温度为T5时,Al2O3能够完全转化为AlN,随着反应时间的增加氮化率增大,最佳反应时间为4 h。3)添加添加剂及对前驱体进行造粒处理有利于扩大实验的氮化反应进行。
