五倍子抗炎、抗菌活性指导下的有效成分分离与抗口腔溃疡网络药理学评价
2020-11-20齐云云温鹏于诗怡李全凯李晓娟陈文韩博
齐云云,温鹏,于诗怡,李全凯,李晓娟,陈文,韩博
(石河子大学药学院/新疆植物药资源利用教育部重点实验室,新疆 石河子 832000)
世界上约有五分之一的人受到口腔溃疡的困扰,溃疡反复发作其病引起疼痛与不适,影响进食[1]。其病因复杂,认为与局部创伤、细菌感染、免疫紊乱等因素有关[2-3]。局部使用氯己定、类固醇类药物带来的牙齿着色、味觉障碍和药物依赖性等副作用使其在临床应用中受到限制[4-5]。2019版《国家基本药品目录》中收录的治疗口腔溃疡的中成药有冰硼散、口腔溃疡散和西帕依固龈液等。其中长期使用冰硼散会导致汞在人体内蓄积,不宜久服[6],且其有效成分—冰片会对感觉神经产生刺激,患者满意度较低;口腔溃疡散具有消溃止痛的功效,但其药性较弱,作用时间较短。在现有药物治疗效果不理想的情况下是否可以从植物药中寻找治疗口腔溃疡的药物?五倍子为五倍子蚜寄生在盐肤木等漆树科盐肤木属植物的叶上形成的虫瘿,主要成分为多酚类化合物(60%~80%)。
五倍子药用历史悠久,始载于距今1200余年的《本草拾遗》。研究表明,五倍子具有镇痛抗炎[7]、收敛止泻[8]及抗氧化[9]等药理活性,对多种动物模型均具有抗炎和镇痛作用,可作为治疗炎症和疼痛相关疾病的候选药物[7]。此外,五倍子对口腔致病菌具有一定抑制活性,能减少细菌粘附、清除口腔细菌生物膜[10]。目前对于五倍子在口腔溃疡治疗中发挥主要活性的化合物及其作用机制的系统性研究却鲜有报道,因此基于系统药理学从抗菌和抗炎两方面观察五倍子中活性化合物对口腔疾病的干预和影响。
本工作结合系统药理学结果与前期工作基础[11],采用C18柱层析分离五倍子中化学成分并采用LC-MS技术进行分析鉴定。通过系统药理学预测五倍子中化合物潜在靶点并研究其作用机制。通过体外抗菌实验检测五倍子中多酚成分段对口腔致病菌的抑制作用,以冰醋酸诱导的口腔溃疡大鼠为模型进行研究,筛选出五倍子中具有抗口腔溃疡活性的成分段,对系统药理学结果进行验证(图1)。
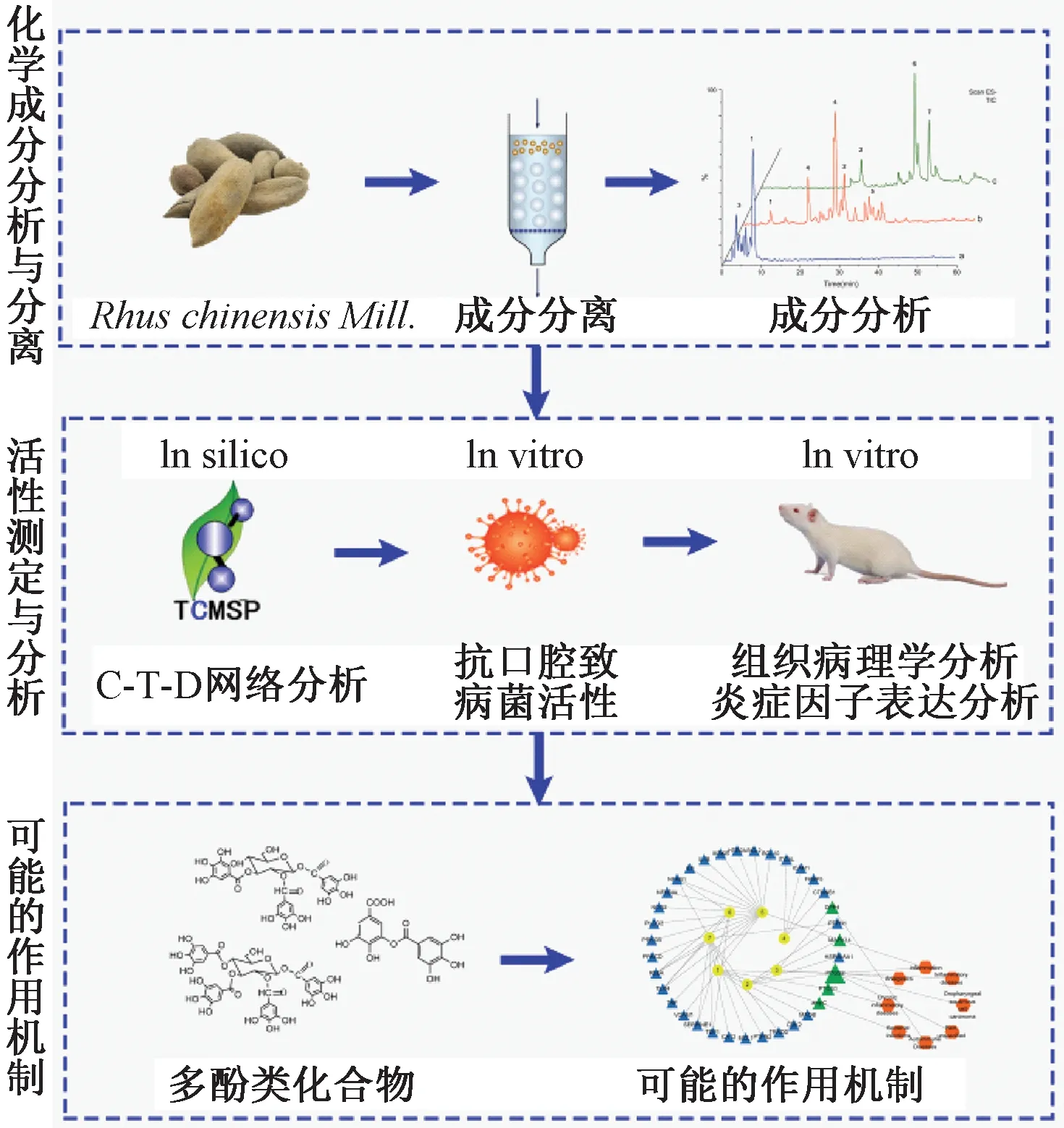
图1 工作思路图
1 材料与方法
1.1 实验动物与材料
1.1.1 试剂与材料
TNF-α ELISA试剂盒(上海酶联生物科技有限公司,批号SU-B20852);IL-1β 试剂盒(上海酶联生物科技有限公司,SU-B20174);IL-6 ELISA 试剂盒(上海酶联生物科技有限公司,SU-B20652);甲酸(天津光复精细化工研究所,批号20170806);微晶纤维素微孔滤膜(0.22 μm,上海兴亚净化材料厂);无水乙醇(天津风船化学试剂科技有限公司,批号20170525);乙腈(色谱级,美国Thermo Fisher公司,批号20170726);TSB培养基(南通凯恒生物科技发展有限公司,批号20180127);琼脂(南通凯恒生物科技发展有限公司,批号20180220);桂林西瓜霜(桂林三金药业股份有限公司,批号171246);多聚甲醛(索莱宝科技有限公司,批号20171016)。
五倍子购于陕西秦岭药材批发市场,经石河子大学药学院韩博教授鉴定为五倍子RhuschinensisMill.,存放于新疆特种植物药重点实验室药剂学研究室(批号:20180715)。
1.1.2 动物
健康SD大鼠60只,雌雄各30只,质量约(180±30)g,由新疆医科大学动物实验中心提供,实验动物生产许可证号:SCXK(新)2016—0003,合格证号:2016—0002。实验动物饲养于温度20~22 ℃,湿度45%~55%的环境中,食用标准颗粒状饲料,适应性饲养一周后进行实验。所有实验动物操作均符合医学实验动物管理实施细则相关政策,并经石河子大学医学院第一附属医院实验动物伦理委员会批准。
1.1.3 实验菌株
牙龈卟啉单胞菌(P.gingivalis, ATCC 33277)和粘性放线菌(A.viscosus,ATCC 27044)购自中国微生物菌种保藏中心。
1.1.4 仪器
液相色谱-质谱分析仪(HPLC-MS,美国Waters公司),自动纯化系统包括恒流泵(Waters 2545),补偿泵(waters 515),紫外可见光谱检测器(Waters 2489),QDa质谱检测器(Waters,美国),样品管理器(Waters 2767);旋转蒸发仪(RE-2000,上海亚龙生化仪器厂);电热恒温水浴锅(DZKW-S-6);Milli-Q Integral水系统(Millipore,Bedford,USA);分析天平(FA2014B,上海精密科学仪器有限公司);BBS-SDC型超净工作台(BIOBASE,济南鑫贝西生物技术有限公司);高压灭菌锅(HVE-50,日本Hirayama平山制作所株式会社);厌氧培养箱(Whitley DG250,英国Don Whitley Scientific);恒温培养摇床(QYC-200,上海新苗医疗器械制造有限公司);紫外分光光度计(UV-2600,日本岛津集团有限公司);低温超速离心机(HIMA,日本立川TACHI公司);电热恒温水浴锅(DZKW-S-6);Milli-Q Integral水系统(Millipore,Bedford,USA);分析天平(AR1140,奥豪斯仪器有限公司)。
1.2 方法
1.2.1 提取与分离
五倍子除去虫瘿后粉碎过80目筛,精密称定60.0 g,加180 mL蒸馏水煎煮3次,每次2 h,合并滤液,减压浓缩至50 mL。采用C18柱(30 cm×10 cm,i.d.)对五倍子浓缩液进行分离,分别用3倍柱体积的0%,30%,70%的乙醇-水溶液梯度洗脱,洗脱流速为4 mL/min,收集洗脱液,浓缩、冻干,得五倍子中三段组分,分别命名为GCE-1、GCE-2、GCE-3。取适量各组分稀释至2 mg·mL-1,过0.22 μm微晶纤维素微孔滤膜后滤液进LC-MS进行分析。
1.2.2 LC-MS分析
分析条件如下:色谱柱:C18柱(SunFire,5 μm,Ф 4.8×250 mm,Waters);流动相:A-0.2%甲酸水溶液,B-乙腈;梯度洗脱:0~4 min:93%~93% A;4~35 min:93%~80% A;35~50 min:80%~70% A;50~60 min:70%~0% A。流速:1 mL·min-1;进样量:20 μL;样品浓度:1 mg·mL-1;检测波长:254 nm和269 nm;电喷雾负离子模式;扫描范围:m/z 100~1250;源温度:120 ℃;去溶剂化温度:250 ℃;毛细管电压2.8 kV;锥电压50 V。
1.2.3 五倍子化合物建立、靶点预测与相互作用网络的构建
通常系统药理学研究中会通过化合物的吸收、分布、代谢和排泄(ADME)性质进行活性筛选,但在本研究中口服生物利用度对口腔黏膜局部给药影响较小,因此未通过ADME性质五倍子化合物进行筛选。采用LC-MS技术对五倍子中的成分进行分析,并结合文献挖掘与TCMSP数据库(http://lsp.nwu.edu.cn/tcmsp.php)检索构建五倍子成分库,以类药性(Drug likeness,DL)≥ 0.18为条件对五倍子中化合物进行初步筛选。DL是指影响药物分子药代动力学和药物性质的分子参数,用来评估化合物与药物相似程度[12]。基于随机森林(Random Forest,RF)和支持向量机(Support Vector Machine,SVM)两种算法,整合化学、基因组学和药理学信息对药物候选活性化合物进行靶标预测,并将RF≥0.7或SVM≥0.8的化合物和靶点相互作用视为有效。运用Cytoscape3.2.1软件绘制五倍子中化合物-靶点-疾病(C-T-D)网络进行分析。
1.2.4 最小抑菌浓度(MIC)的测定
将牙龈卟啉单胞菌及粘性放线菌于温度为37 ℃、湿度为75%的厌氧培养箱(CO2:N2:H2=8∶1:1)中培养至对数生长期,并稀释成浓度为108CFU/mL的菌液,采用二倍稀释法[13]测定五倍子中各组分对牙龈卟啉单胞菌及粘性放线菌的最小抑菌浓度。观察结果:若孔中培养基浑浊视为有细菌生长,孔中完全澄清视为无细菌生长。为验证结果的准确性,将各孔中的培养液接种于TSB琼脂培养基培养24 h,若仍无细菌生长,则该浓度为对应药液的MIC,每组实验平行3次。
1.2.5 抑菌圈实验
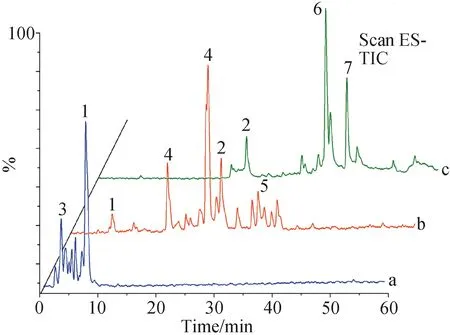
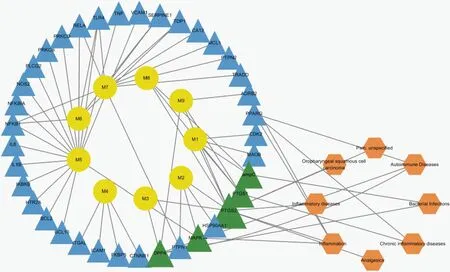
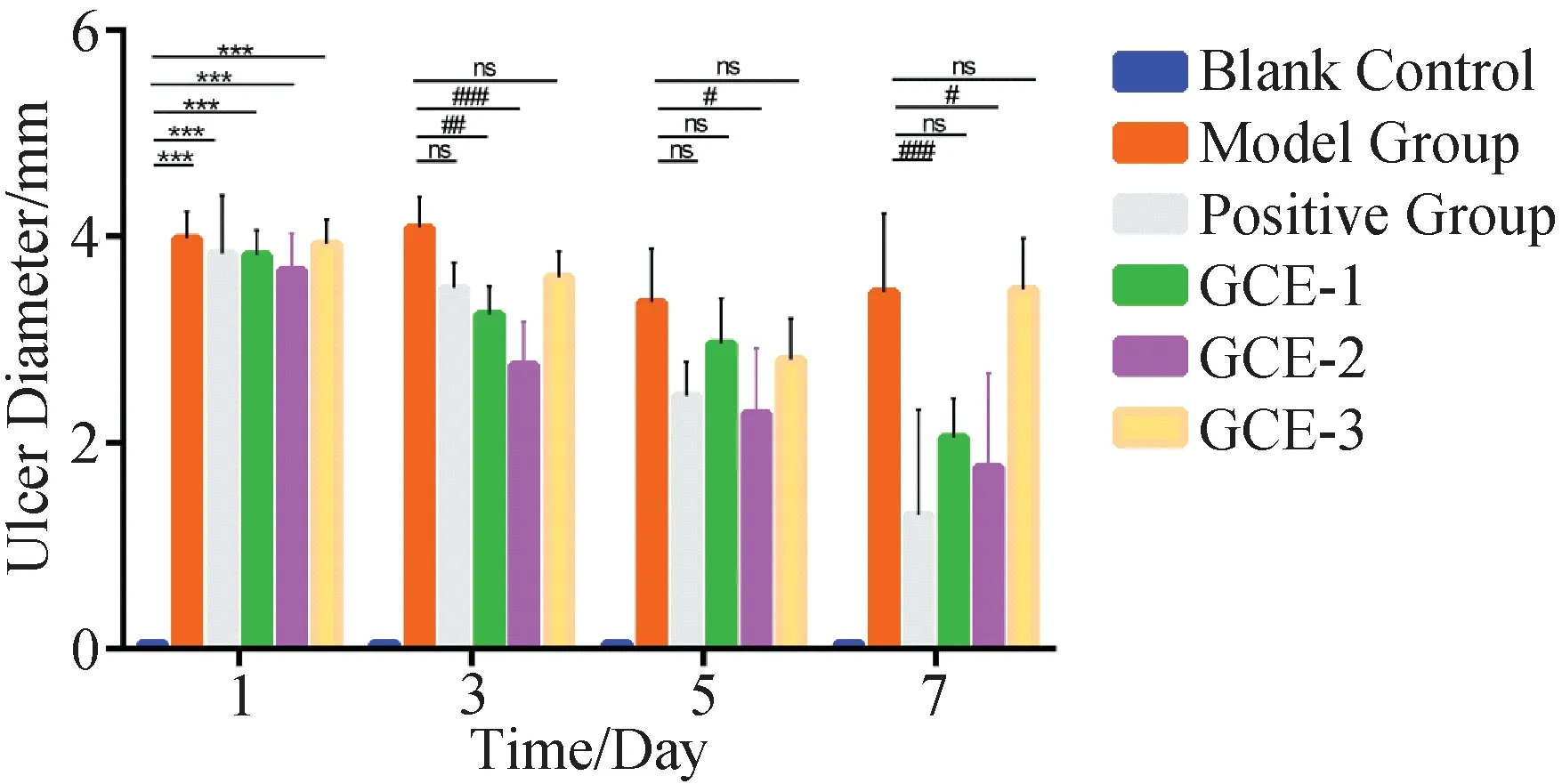
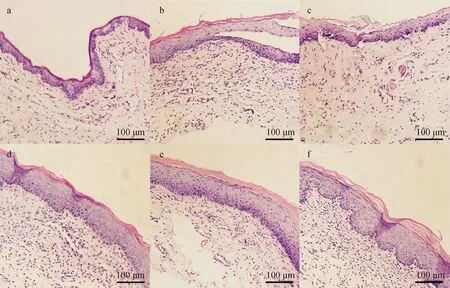
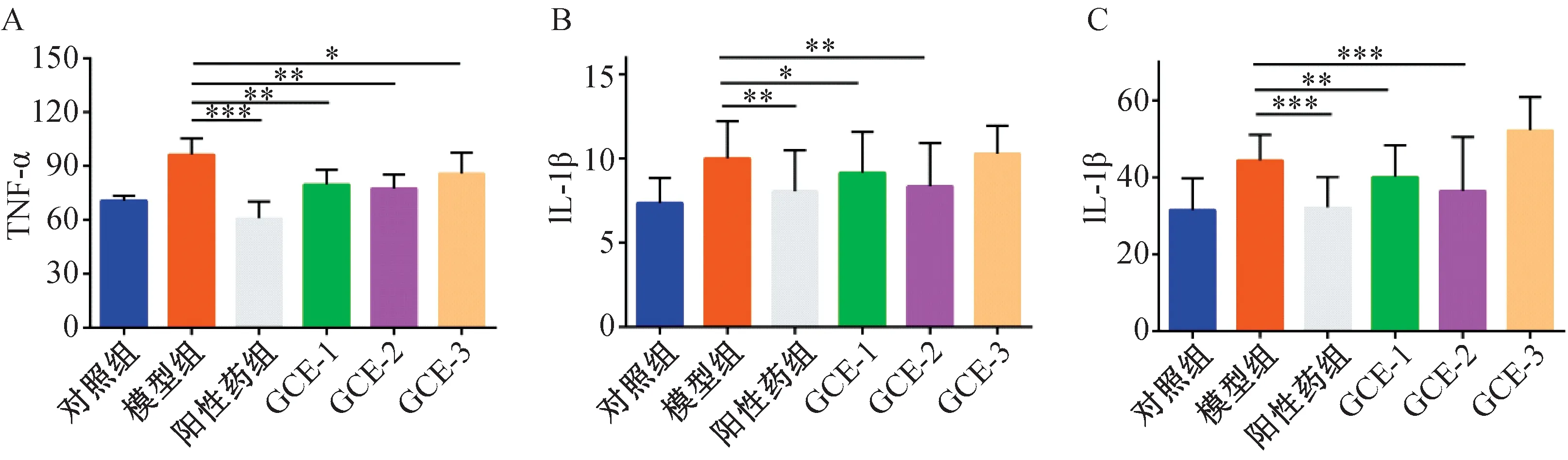
将牙龈卟啉单胞菌及粘性放线菌分别制备成浓度为108CFU/mL的菌液,采用牛津杯法测定1.2.5中筛选出的抑菌活性组分在不同浓度对牙龈卟啉单胞菌或粘性放线菌的抑菌圈大小[14],甲硝唑(5 mg·mL-1)作为阳性对照,每组设3个平行组。具体方法如下:于培养皿中加入15 mL TSB琼脂培养基和0.15 mL菌液,迅速混匀。待培养基凝固后,将牛津杯均匀放置于培养皿中,每孔加入各待测液100 μL。将培养皿置于37 ℃恒温培养箱中培养24 h观察结果,用游标卡尺测量抑菌圈的直径。抑菌效果判定标准:抑菌圈直径r>20 mm以上为极度敏感,15 mm 1.2.6 动物分组及给药 采用化学灼烧建立大鼠口腔溃疡模型[15]。大鼠腹腔注射水合氯醛(10%,3 mL·kg-1)麻醉,将直径为3 mm×3 mm滤纸片浸润50%冰醋酸后贴于下切牙唇侧黏膜30 s,对照组采用生理盐水浸润的滤纸同法处理,24 h后观察大鼠黏膜形成溃疡即为造模成功。将造模成功的大鼠随机分为GCE-1组(110 mg·mL-1)、GCE-2组(110 mg·mL-1)、GCE-3组(110 mg·mL-1)、模型组(生理盐水)、阳性药组(桂林西瓜霜,200 mg·mL-1),每组10只。造模24 h后开始进行药物干预,将0.15 mL各组药液喷于大鼠黏膜破损处,每天给药2次,连续7 d,给药后30 min内禁食禁水。治疗期间使用游标卡尺测量各组大鼠给药前及给药后第3天、第5天、第7天口腔溃疡的直径,观察大鼠溃疡面形态、愈合情况并拍照记录。 1.2.7 黏膜组织(HE)染色 治疗结束后处死大鼠,剪取口腔溃疡处黏膜组织。取部分溃疡组织于4%多聚甲醛溶液中固定、石蜡包埋、切片,HE染色并通过图像采集分析系统进行图像采集,观察各组溃疡组织病理学变化。 1.2.8 炎症因子的表达 精密称定剩余组织,加入9倍量的生理盐水进行匀浆处理,匀浆液于4 ℃、5 000×g离心10 min,取上清液按照ELISA试剂盒说明书分别检测TNF-α,IL-1β和IL-6含量。 1.2.9 统计分析 本课题组前期采用超高效液相色谱串联质谱技术 (UPLC-MS/MS) 对五倍子中的化合物快速分析鉴定[12],以多酚类化合物为主,且各化合物结构相似度高。为寻找五倍子中发挥药理作用的活性组分,通过各化合物的保留时间与柱层析分离结果,将五倍子中化合物分为GCE-1、GCE-2、GCE-3三段,并利用LC-MS技术对五倍子各组分进行分析、鉴定出7种多酚化合物,分别为没食子酸(m/z169.07)、双没食子酸(m/z321.09)、一-O-没食子酰基葡萄糖(m/z331.20)、二-O-没食子酰基葡萄糖(m/z483.27)、三-O-没食子酰基葡萄糖(m/z 635.35)、四-O-没食子酰基葡萄糖(m/z787.25)和五-O-没食子酰基葡萄糖(m/z939.27),GCE-1、GCE-2、GCE-3总离子流图如图2所示,GCE-1组包括没食子酸与一-O-没食子酰基葡萄糖,GCE-2组主要为双没食子酸、二-O-没食子酰基葡萄糖和三-O-没食子酰基葡萄糖,GCE-3组包括四-O-没食子酰基葡萄糖、五-O-没食子酰基葡萄糖。图2中部分化合物未完全分离,以图2a中化合物3为例,在保留时间为2~7 min内分布有6个峰,其分子量均为331,鉴定为一-O-没食子酰基葡萄糖的多个同分异构体,其结构和极性相似,不易通过C18柱分离。各组分化合物详细信息如表1所示。 a、b、c为GCE-1、GCE-2、GCE-3的总离子流图。 表1 LC-MS对五倍子中各组分化合物鉴别分析 五倍子化合物与其潜在靶点和疾病之间的相互作用关系如图3所示,包括52个节点和62条边,图中节点分别代表9个化合物成分(通过文献挖掘得到五倍子中化合物没食子酸甲酯和没食子酸乙酯,分别作为化合物M8、M9)、35个靶点和8类口腔溃疡相关疾病,化合物信息见表1,节点大小与此节点的degree值呈正相关。其中预测得到的核心靶点前列腺素G/H合酶2(PTGS2)、前列腺素G/H合酶1(PTGS1)、丝裂原激活蛋白激酶14(MAPK14)、二肽基肽酶4(DPP4)和ampC与口腔溃疡相关。PTGS2和PTGS1是炎性疾病的重要靶点,当机体受脂多糖、真菌病原体和TNF-α、IL-1β等促炎症因子刺激后,PTGS2和PTGS1的表达迅速增加,引起炎性反应,导致组织损伤[16-17]。MAPK14参与机体的免疫调节与炎症反应,可以调控TNF-α、IL-1、IL-6等细胞因子的基因表达[18]。 其中黄色圆形节点表示化合物,蓝色三角形节点表示靶点,绿色三角形节点表示核心靶点,橙色六边形节点口腔溃疡相关疾病,边表示相互作用关系。 通过PTGS2、PTGS1和MAPK14对巨噬细胞的凋亡、局灶性黏附和炎症的调节可能是五倍子中活性成分发挥抗炎活性的作用机制。DPP4是一种细胞表面糖蛋白,通过调节T细胞活化、细胞因子的水平、T细胞依赖性抗体的生成和B细胞免疫球蛋白参与介导机体免疫功能和疾病的发病机制,在巨噬细胞介导的炎症、组织重塑[19]和自身免疫性疾病中发挥重要作用[20],但其在口腔病理环境中的作用未见报道。ampC诱导了头孢菌素耐药性菌株的生长,其往往与肠菌群固有耐药性密切相关,但在口腔菌群中的作用未见文献报道。而有研究表明,在LPS诱导的牙龈成纤维细胞模型中Toll-like receptors 4(TLR4)表达水平与IL-1、IL-6的水平呈正相关,而antiTLR4单克隆抗体可抑制LPS诱导的人牙周膜细胞中TNF-α,IL-1β和IL-6的表达[21]。接下来本工作从抗菌和抗炎两个角度对五倍子中活性化合物及其作用机制进行初步分析。 采用二倍稀释法测定没食子各组分对牙龈卟啉单胞菌和粘性放线菌的MIC,结果如表2、表3所示。经验证,GCE-1、GCE-2和GCE-3对牙龈卟啉单胞菌的MIC分别为10、5、5 mg·mL-1,GCE-1、GCE-2和GCE-3对粘性放线菌的MIC分别为5、5、10 mg·mL-1。结果提示,GCE-2对两种口腔致病菌均具有强抗菌活性,GCE-1和GCE-3抗菌活性稍弱于GCE-2。 表2 五倍子各组分对牙龈卟啉单胞菌的MIC 表3 五倍子各组分对粘性放线菌的MIC 进一步采用牛津杯法测定5 mg·mL-1甲硝唑、10 mg·mL-1GCE-2(H- GCE-2)和5 mg·mL-1GCE-2(L- GCE- 2)对牙龈卟啉单胞菌和粘性放线菌的抑菌圈直径,结果图4所示。抗菌活性:甲硝唑>H-GCE-2 >L-GCE-2,牙龈卟啉单胞菌和粘性放线菌对GCE-2敏感程度呈浓度依赖性。结果提示,GCE-2具有一定抗菌能力,五倍子参与口腔溃疡的治疗机制可能与抗菌有关。 图4 GCE-2对牙龈卟啉单胞菌和粘性放线菌抑菌圈 实验周期安排如图5A所示,给药期间各组大鼠体重变化无明显差异,活动量正常,进食饮水、排便情况无明显差异。观察各组大鼠口腔溃疡面形态如图5B-D所示。冰醋酸刺激后可出现明显的口腔溃疡,表面覆有灰白色假膜,周围黏膜充血、红肿。在持续给药第3、5、7天分别记录各组大鼠黏膜表观,如图5D所示。 图5 实验周期图及治疗期间各组大鼠溃疡表观 模型大鼠口腔溃疡随着时间呈现出一定自愈性,溃疡面积略有减小。治疗后期经阳性药、GCE-1、GCE-2治疗的大鼠溃疡面有新生组织覆盖,周围黏膜充血红肿程度减轻,其中GCE-2效果仅次于阳性对照组,经GCE-3治疗的大鼠黏膜组织出现溃烂,颜色发黑。 治疗期间大鼠口腔溃疡直径如图6所示。 与模型组相比*P<0.05,**P<0.01 and ***P<0.001。 各组大鼠建模24 h后大鼠溃疡面积大小无统计学差异。治疗后期,模型大鼠口腔溃疡面积逐渐减小,表现出一定自愈性。与模型组比较,阳性药组、GCE-1和GCE-2治疗组溃疡直径显著减小(P<0.01),其中阳性药组与GCE-2治疗组分别有4只和3只大鼠溃疡完全愈合。而GCE-3成分组治疗期间溃疡面积与模型对照组无明显差异(P>0.05)。该结果与抗菌实验结果一致,提示GCE-2组分对冰醋酸诱导的口腔溃疡具有治疗作用。 大鼠口腔溃疡黏膜组织病理变化如图7所示。 A—对照组;b—模型组;c—阳性药组;d—GCE-1组;e—GCE-2组;f—GCE-3组 对照组口腔黏膜组织上皮完整,细胞排列有序,黏膜下层的结缔组织疏松,未见炎性细胞浸润。 模型组口腔黏膜组织破损,上皮层破溃脱落,结缔组织细胞排列不完整,黏膜下层炎性细胞浸润明显。 与模型组比较,阳性药组、GCE-1治疗组和GCE-2治疗的大鼠黏膜组织上皮层趋于完整,炎性细胞浸润明显减少。结果表明,GCE-2可促进冰醋酸诱导的黏膜组织病理结构的修复,原因可能为GCE-2中的多酚类化合物与溃疡表面蛋白质结合,形成保护膜,隔绝口腔中细菌与毒素的侵蚀,防止溃疡面继发感染,加速创面愈合。 实验性大鼠溃疡组织中IL-1β、IL-6、TNF-α含量变化如图8所示。与对照组相比,模型组大鼠溃疡组织中IL-1β、IL-6和TNF-α水平显著升高(P<0.05)。与模型组相比,GCE-1治疗组、GCE-2治疗组和阳性药组大鼠的溃疡组织中IL-1β、IL-6和TNF-α水平显著降低,其中阳性药组最显著(P<0.001),GCE-2治疗组次之(P<0.01),GCE-1治疗组较弱(P<0.05),GCE-3成分组IL-1β、IL-6水平无显著性差异(P>0.05),TNF-α水平显著降低(P<0.05)。结果提示,GCE-2可以降低溃疡组织中IL-1β、IL-6和TNF-α水平,其治疗醋酸诱导的口腔溃疡机制可能与炎症相关。 与模型组相比*P<0.05,**P<0.01 and ***P<0.001;n=6。 口腔溃疡的治疗以减轻患者疼痛,促进溃疡愈合,减少发作持续时间和复发率为主[22]。临床治疗口腔溃疡的中成药很多,如:西瓜霜、三七粉、青黛散等,但这些药物对改善患者疼痛及促进口腔溃疡的愈合无明显疗效[23]。五倍子多酚对口腔溃疡的疗效已有报道[24]。五倍子多酚类化合物与溃疡表面渗出物结合,收敛溃疡面;神经末梢蛋白质被沉淀,具有微弱的局麻作用,可缓解溃疡引起的疼痛;体外实验显示五倍子对口腔致病菌具有明显的抑制作用,可用于治疗继发性感染引起的口腔溃疡,不需要与其他抗菌药物联合使用。针对五倍子中活性化合物物质基础及作用机制不明确的问题,我们从系统水平对五倍子中的活性成分并作用机理进行研究。结果表明,组分GCE-2具有较强的抑菌活性及促进溃疡愈合、减轻炎症的作用,其主要成分为双没食子酸与三-O-没食子酰基葡萄糖,可作为五倍子中的活性成分单独或与其他药物联合用药用于口腔溃疡的治疗。 目前口腔溃疡模型建立方法包括免疫诱导法、化学灼烧法、氧自由基诱导法和细菌感染法等。其中,免疫诱导法与人体口腔溃疡发病机制相似,该模型具有免疫力低下、易复发等特点,但操作复杂、耗时长,且不易控制溃疡的数目、大小与出现部位;细菌诱导法适用于评价抗炎药物对感染性口腔溃疡的疗效,但该模型需反复注射,易引起动物感染,且成功率较低;氧自由基诱导法易引起动物全身毒性;化学灼烧法以冰醋酸、苯酚或氢氧化钠等诱导口腔溃疡的建立,且造模成功率高、个体差异性小,适用于规模较大的实验性动物研究[25]。因此本实验选择以50%冰醋酸诱导的大鼠口腔溃疡为模型,用于评价五倍子的抗炎活性。 在体内实验中主要成分为四-O-没食子酰基葡萄糖与五-O-没食子酰基葡萄糖的组分GCE-3对大鼠口腔溃疡疗效不佳,且干预后溃疡组织表面发黑。有文献记载,小鼠皮下注射或腹腔注射高剂量的五倍子煎煮液后出现局部组织糜烂、坏死或动物致死的现象,主要原因为五倍子鞣质进入体内被分解为梧酸和焦梧酸,产生大量分解物质,引起灶性肝细胞坏死,从而具有一定肝毒性[26]。另外,自1997年Christopher A.Lipinski提出类药性五原则后,大量文献将其用于评估活性化合物的类药性[27],如Shahinozzaman等[28]根据该法则和计算机辅助药物设计快速高效地筛选出草药中的PAK1抑制剂。通过类药性五项原则对四-O-没食子酰基葡萄糖与五-O-没食子酰基葡萄糖的类药性进行评估,违背了其分子量不大于500 Da和氢键供体不超过5个两项原则[29],成药性较低。本工作为五倍子在临床中的应用的安全性提供了依据。 系统药理学分析得知,五倍子化合物中可能通过靶点PTGS1、PTGS2、MAPK14、DPP4和ampC发挥治疗口腔溃疡的活性,但DPP4、ampC参与口腔溃疡发生发展过程的文献记载较少,经查阅文献,TLR4受体与IL-1β、IL-6和TNF-α等炎症因子可能参与口腔溃疡的病理过程中。因此本实验通过体内、外实验分离出五倍子中具有抗炎、抗菌活性的化合物,并对其作用机制进行了初步验证。系统药理学从化合物的吸收、分布、代谢和排泄(ADME)性质、靶点和蛋白相互作用网络等多方面对中草药中的活性成分与进行了大规模的数据整合,但仍存在一定局限性,需进一步通过体内、外实验进行相应的验证。且系统药理学计算无法分析出化合物与靶点之间的量效关系,这限制了其在中草药活性成分研究中的应用。为深入研究五倍子中活性化合物、靶点与疾病之间复杂的关系,我们通过LC-MS技术对各组分中的主要成分进行鉴定与分析,排除含量占比较低的化合物在疾病治疗中的发挥主导作用的可能。通过LC-MS技术与系统药理学相结合,对中草药中活性化合物及作用机制进行更精准的预测。 本工作从系统的角度为五倍子治疗口腔溃疡的活性成分及作用机理研究提供了新的策略,利于促进五倍子中单体成分的开发与应用[30]。同时为进一步研究五倍子中活性化合物组合,深入研究其药用价值提供了重要的参考。
2 结果
2.1 LC-MS分析结果

2.2 网络图构建与分析
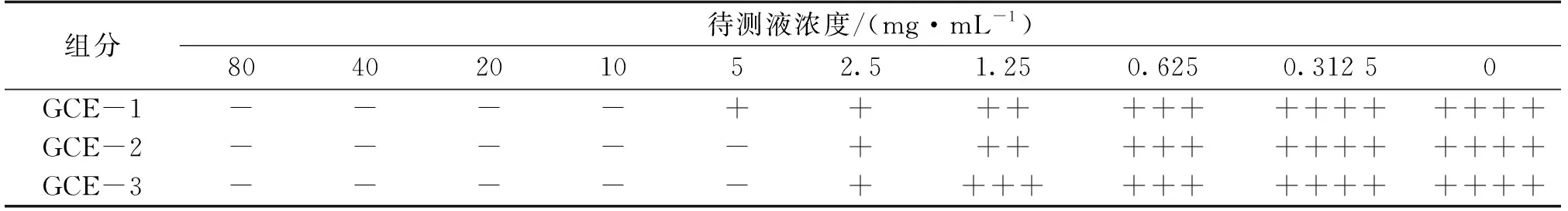
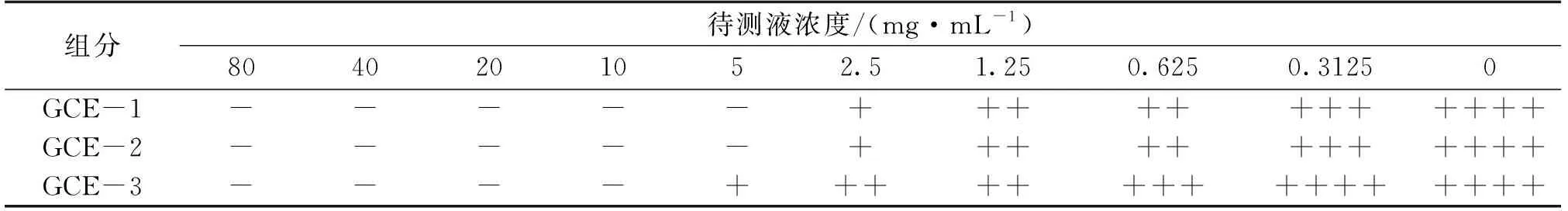
2.3 五倍子中各组分MIC测定结果
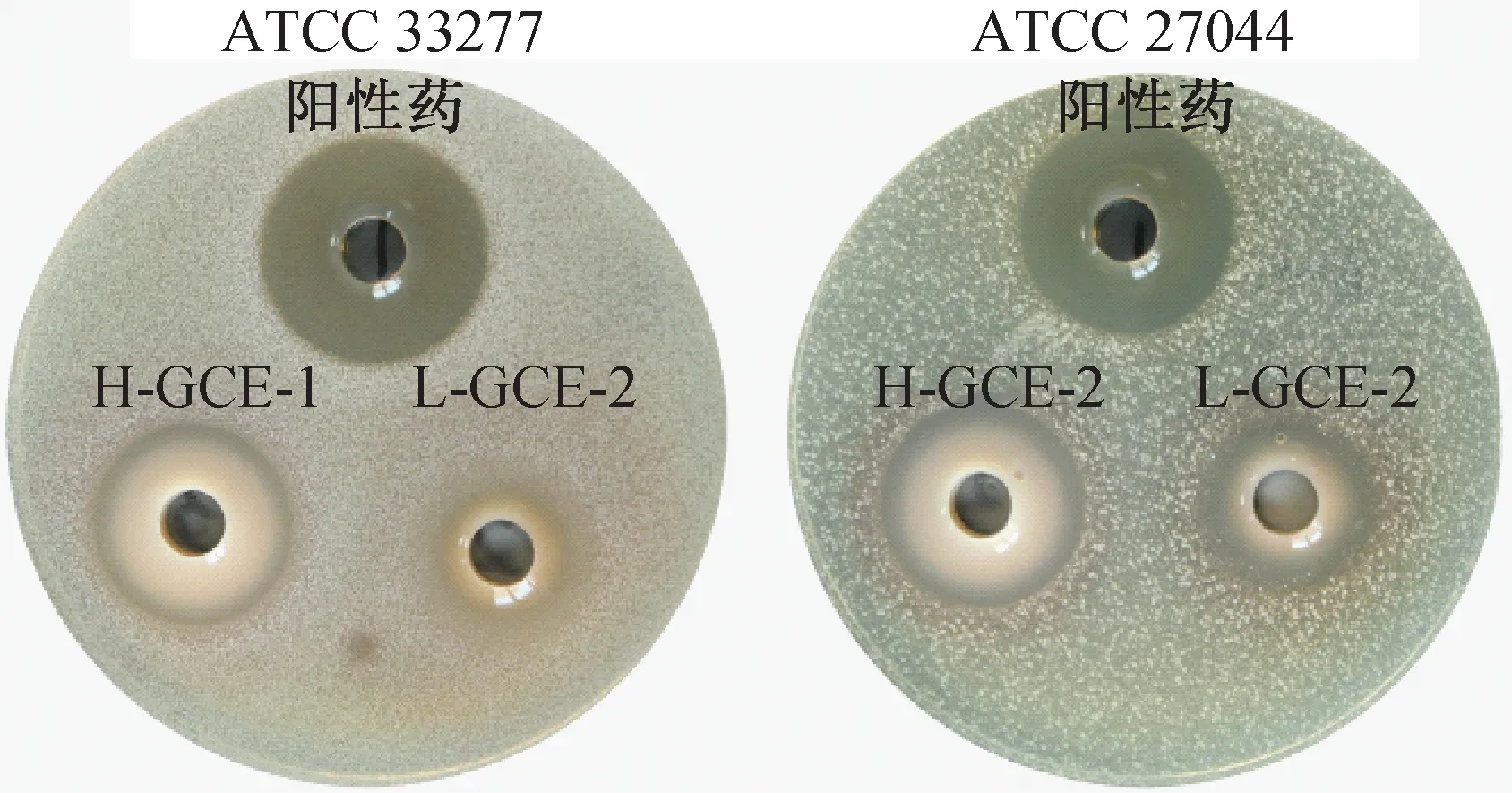
2.4 抑菌圈直径及药物敏感性测定结果
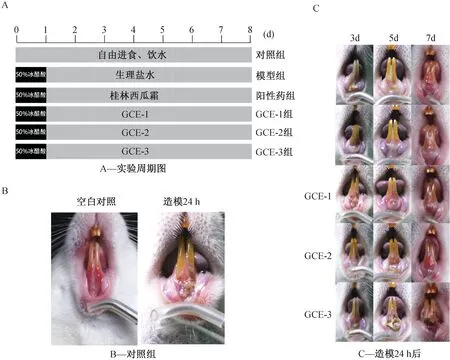
2.5 一般情况观察
2.6 实验期间大鼠溃疡直径记录
2.7 口腔黏膜组织病理切片分析
2.8 口腔溃疡大鼠TNF-α,IL-1β,IL-6表达变化
3 讨论
