异斯特维醇及其衍生物抗肿瘤活性研究进展
2020-11-19刘从军刘盼萍
刘从军,刘盼萍,柯 明
(郑州工程技术学院 化工食品学院,河南 郑州 450044)
异斯特维醇(isosteviol)是由天然产物甜菊苷在酸性条件下水解得到的四环二萜类化合物,分子结构如图1所示。早期研究发现,该化合物具有降血压、降血糖等药理功效。近年来,随着对其研究的深入,大量的异斯特维醇衍生物被设计和合成,一些新的性能也被开发,如:抗肿瘤活性、小分子催化性能、超分子自组装性能等[1]。尤其是部分衍生物展现出比其自身更好的抗肿瘤功效,促使研究者更进一步设计新型异斯特维醇衍生物,以期在抗肿瘤新药开发领域有更深层次的突破。基于此,本文综述异斯特维醇及其衍生物在抗肿瘤活性方面的最新研究进展,以期为此类化合物的抗肿瘤新药开发研究提供参考。
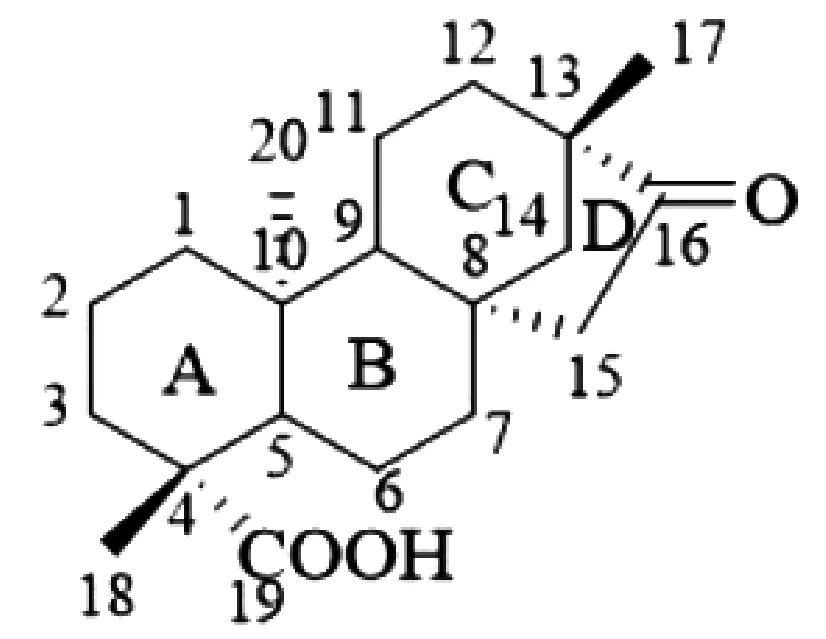
图1 异斯特维醇结构
1 异斯特维醇抗肿瘤活性
2006年,Wong[2]首先报道了异斯特维醇通过改变活性氧的生成来抑制血管紧缩素-II诱导的细胞增殖,从而推论出异斯特维醇具有抗肿瘤细胞增生的能力。
2015年,Al-Dhabi[3]利用不同浓度的异斯特维醇作用于Vero和MCF7 细胞,结果显示:异斯特维醇对两株肿瘤细胞的抑制呈现出时间和剂量的依赖性,对Vero和MCF7 细胞的IC50值分别为2.18 μg/mL和2.50 μg/mL。
2016年,王小侠[4]考察异斯特维醇对骨肉瘤细胞U-2OS生长的影响,结果显示:异斯特维醇对骨肉瘤细胞U-2OS的抑制呈现出时间和剂量依赖性。进一步机制研究发现:异斯特维醇通过促进活性氧的产生,降低细胞膜电位,破坏细胞膜完整性,上调Bax的表达和下调Bcl-2的表达而促进U-2OS细胞的凋亡。
2 异斯特维醇衍生物抗肿瘤活性
异斯特维醇自身的抗肿瘤活性吸引了研究者对其衍生物的进一步开发,以期获得抗肿瘤性能更好的新型衍生物。在研究异斯特维醇抗肿瘤活性过程中,研究者通过微生物转化、电化学法、化学合成法等对异斯特维醇的D环,19位羧基进行重点结构修饰,获得了大量的、结构新颖的异斯特维醇衍生物,并评价了部分新型衍生物的抗肿瘤活性,一些作用机制也被进一步探索。
2.1 D环修饰的异斯特维醇衍生物抗肿瘤活性
2009年,Wu[5]首先以异斯特维醇为原料,重点对其D环进行结构修饰,经酯化、还原、羟醛缩合、康尼查罗、1,3-偶极环加成等反应,合成出单羟基(1)、双羟基(2)、四氢异噁唑环(3)和吡唑环(4)骈异斯特维醇衍生物(图 2),评价了它们对B16-F10黑色素瘤细胞的抑制活性,结果显示这些化合物均表现出较好的细胞毒活性,尤其是化合物3和4对B16-F10黑色素瘤的抑制浓度IC50值分别达到15 μM/mL和19 μM/mL。并提出在异斯特维醇分子骨架上引入羟基或杂环能提高其抗肿瘤活性。
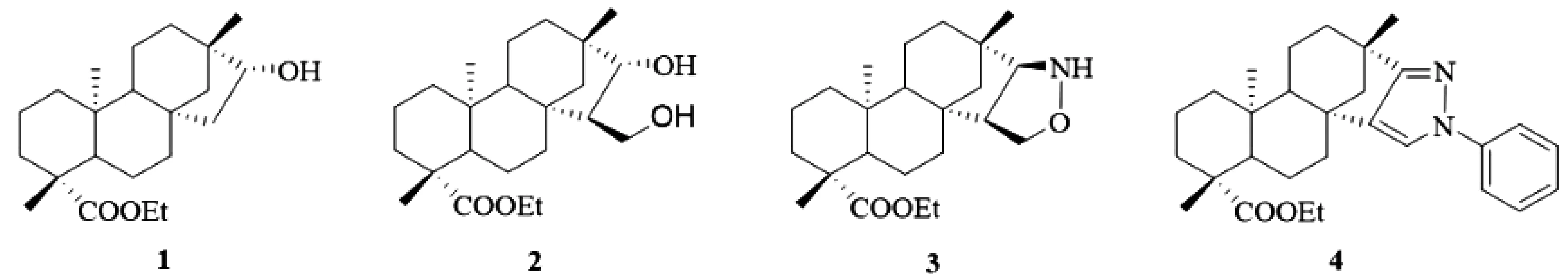
图2 D环修饰的羟基、杂环骈异斯特维醇衍生物1-4
在上述工作的基础上,2012年,Zhang等人[6]继续在异斯特维醇D环上引入羟基,合成出新型双羟基(5,6)、氨基醇(7,8)骈异斯特维醇衍生物(图3),评价了它们对EC9706,Eca109,PC-3和HCT-116四株肿瘤细胞的抑制活性,结果显示:含有多羟基的异斯特维醇衍生物对四组癌细胞表现出中等的抗肿瘤效果,而含有氨基醇亚结构单元的衍生物8表现出突出的抑制活性(IC50=4.01,5.02,15.31和12.25 μM/mL),并详细分析了羟基、氨基醇骈异斯特维醇衍生物结构与活性间的构效关系。

图3 D环修饰的羟基、氨基醇骈异斯特维醇衍生物5-8
基于D环修饰的氨基醇骈异斯特维醇衍生物具有较好的抗肿瘤功效,2016年,Liu[7]对异斯特维醇D环继续结构修饰,合成了与化合物8结构类似的化合物9和10,同时,对氨基醇亚结构单元又进一步改造,将一系列硫脲结构引入到氨基上(图4),评价了它们对HCT-116,HGC-27和JEKO-1三组肿瘤细胞的抑制活性,结果显示:含有硫脲结构片段的异斯特维醇衍生物表现出比前体化合物10更好的抗肿瘤效果,尤其是化合物11对HCT-116细胞的抑制活性IC50值达1.450 μM/mL。

图4 D环修饰的氨基醇、硫脲骈异斯特维醇衍生物9-11
2013年,Zhu[8]重点将活性杂环亚结构单元引入到异斯特维醇的D环区域,首先通过异斯特维醇酯化、Tollens反应,氧化、开环、缩合、环合等反应,将吡唑啉、吡唑和异噁唑环引入到异斯特维醇D环上,随后又将不同取代的苯环(12,13)、苯基硫脲(14)亚结构单元引入到杂环结构上(图5),合成出100多个新型衍生物,测试了衍生物对四株肿瘤细胞SGC7901,A549,Raji和Hela的抑制活性。结果发现这些化合物对Raji细胞具有显著的抑制效果,尤其是2,4-二氯苯基吡唑取代的异斯特维醇衍生物对Raji细胞的IC50达到1.09 μM/mL。
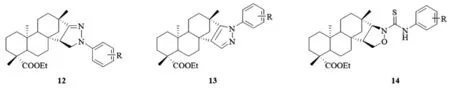
图5 D环修饰的吡唑啉、吡唑和异噁唑骈异斯特维醇衍生物12-14
2014-2016年,Khaybullin[9]和Liu[10]等人分别对异斯特维醇D环羰基和羟甲基进行结构修饰引入叠氮基;随后,利用“Huisgen click”反应将1,2,3-三氮唑结构单元引入到异斯特维醇的D环区域,合成了20余个1,2,3-三氮唑骈异斯特维醇衍生物,评价了16位羰基修饰的1,2,3-三氮唑骈异斯特维醇衍生物对MDA-231,A-549,ASPC-1,PC-3,HCT-116和HeLa肿瘤细胞的抑制活性,其中化合物15(图6)对HeLa细胞的抑制效果最好,IC50值达(29.62±1.52) μM/mL。15羟甲基修饰的1,2,3-三氮唑骈异斯特维醇衍生物抑制HCT-116和JEKO-1细胞的作用结果显示:化合物16(图6)对HCT-116细胞的抑制效果最好,IC50值达(2.987±0.098)μM/mL。

图6 D环修饰的1,2,3-三氮唑骈异斯特维醇衍生物15,16
D环区域引入α,β-环外不饱和酮、酯等亚结构单元也被证实能够提高其抗肿瘤活性。自2011年以来,Li研究小组[11]相继在异斯特维醇D环上引入α,β-环外不饱和酮、酯等结构单元合成出10多个α,β-环外不饱和酮、酯骈异斯特维醇衍生物(图7),其中抗肿瘤活性较好的化合物18对MDA-MB-231和MGC-803细胞的抑制浓度IC50值分别为1.58和2.22 μM/mL;化合物19在对PC-3,HCT-116,MDA-MB-231,K-562,HepG-2和MGC-803肿瘤细胞的活性评价中,选择性地抑制MGC-803细胞的生长(IC50= 11.23 μM/mL)。

图7 D环修饰的α,β-环外不饱和酮、酯骈异斯特维醇衍生物17-19
Liu[12]发现在异斯特维醇D环区域引入氮氧化物结构片段也能提高其抗肿瘤活性。该小组通过多步反应,合成出了系列新型D环修饰的氮氧化物骈异斯特维醇衍生物,评价了其对HepG-2,B16-F10,HCT-116,Huh-7和SW6-20细胞的抑制活性,结果显示,化合物20和21(图8)对B16-F10细胞生长具有较好的抑制作用。从进一步的构效关系研究中发现,化合物分子中的NO释放量与化合物的抗肿瘤效果呈现正比关系,说明氮氧化物亚结构在其抗肿瘤过程中扮演着极其重要的作用。

图8 D环修饰的氮氧化物骈异斯特维醇衍生物20,21
D环开环也能够提高异斯特维醇的抗肿瘤活性。2013年,Das[13]从毛茛科草本植物白头翁(Pulsatilla nigricans)中提取得到异斯特维醇D环开环产物22(图9),其抑制HeLa细胞的IC50值为 50.8 μg/mL。进一步机制研究结果显示,化合物22促使HeLa细胞细胞核固缩和核小体间DNA断裂,从而导致癌细胞的凋亡。
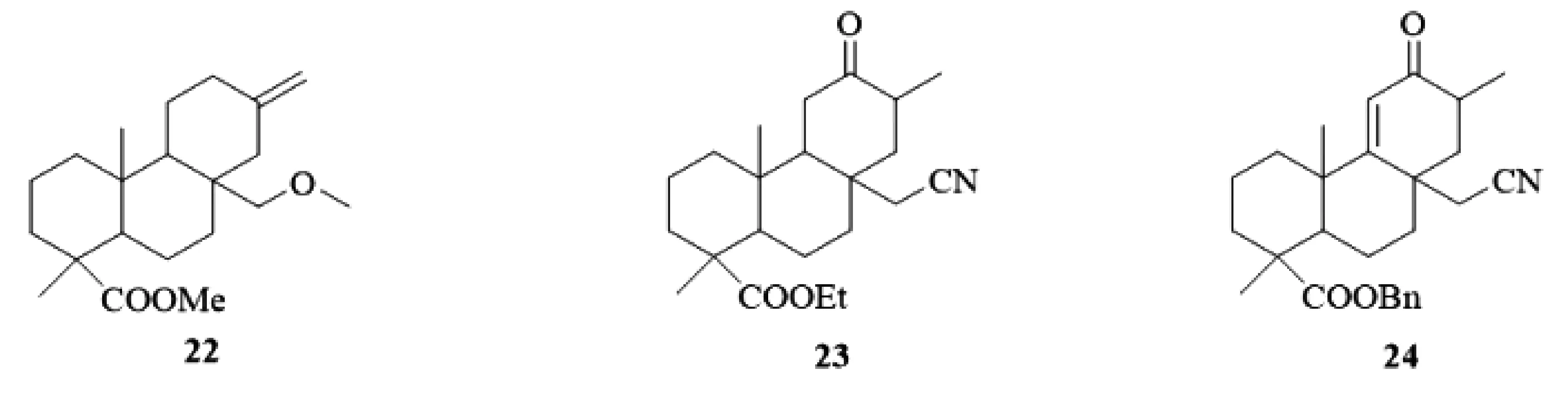
图9 D环开环的异斯特维醇衍生物22-24
2016年,刘燕[14]以异斯特维醇为原料,经酯化、肟化、开环、氧化、选择性还原、脱氢等反应,合成得到10余个异斯特维醇D环开环的衍生物,并评价其对HepG2,HCT116,Huh7,SW620四株肿瘤细胞的抑制活性,结果显示:化合物23(图9)对四株肿瘤细胞具有较好的抑制活性,IC50值均低于10 μM/L,化合物24(图9)选择性抑制HCT116细胞,其IC50值达3.57 μM/L。
2.2 19位羧基修饰的异斯特维醇衍生物抗肿瘤活性
异斯特维醇19位羧基处于A,B环组成的凹型区域,同时,20位甲基和D环的空间效应给19位羧基也带了一定的影响,致使19位羧基表现出一些特殊的性能,如19位羧基反应活性相对较低,与醇形成酯后结构比较稳定性,在强酸、强碱下均不宜水解等。这些因素导致早期的异斯特维醇结构修饰主要发生在其D环区域。然而,随着对异斯特维醇研究的深入,发现19位羧基的修饰在异斯特维醇生物活性中也扮演着非常重要的作用。
2013年,Ukiya[15]通过多步反应将19位羧基还原成羟基,与取代的羧酸反应合成了一系列19位羧基修饰的酯类化合物。对HL60,A549,AZ521和SK-BR-3肿瘤细胞研究结果显示:化合物25(图10)对四株肿瘤细胞抑制作用较为显著,IC50分别为(6.6±2.1),(5.7±1.6),(4.2±0.6),(25.2±0.5)μM/mL。2017年,Malki研究小组[16]利用相似的合成方法得到了系列酯类化合物,其中化合物26(图10)对肝癌细胞的抑制活性最优,作用机制研究发现,该化合物导致癌细胞凋亡的主要阶段发生在细胞分裂的G1期。2019年,郭永泰[17]保留19位处的羰基,将羧基酰氯化后与醇反应生成相应的酯,评价对Colo-16和A549的细胞毒活性,结果显示,化合物27(图10)对Colo-16细胞的活性最好,IC50为(53.03±0.0343)μM/L。
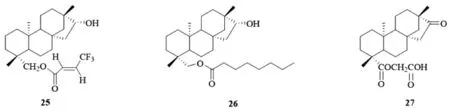
图10 19位羧基修饰的异斯特维醇酯衍生物25-27
2019年,Strobykina[18]重点对异斯特维醇19位羧基进行结构修饰引入酯基,随后进一步在酯基上引入磷/膦酸酯亚结构单元,通过调节磷原子与19位碳间的脂肪链长度,相继合成了2个系列19位羧基修饰的磷/膦酸酯骈异斯特维醇酯衍生物(图11)。抗肿瘤活性结果显示:抗肿瘤效果较好的化合物28对M-HeLa,MCF-7和WI-38细胞的IC50分别为(14.2±1.1),(37±3.1)和(37±3.2)μM/L;化合物29对M-Hela,MCF7和Chang liver细胞的IC50均为60 μM/L。

图11 19位羧基修饰的磷/膦酸酯骈异斯特维醇酯衍生物28,29
此外,该小组[19]利用相同的方法,合成了2个系列19位羧基修饰的糖骈异斯特维醇酯衍生物(图12)。抗肿瘤活性结果显示:化合物30对MCF-7,Hep G2,Panc-1,PC-3,Wi-38和Chang liver细胞具有中等的抑制能力,而化合物30和31对M-Hela细胞效果较为显著,IC50分别为(10.0±0.7)μM/L和(13.0±1.0)μM/L,均优于阳性对照他莫昔芬(28.0±2.5)μM/L。

图12 19位羧基修饰的糖骈异斯特维醇酯衍生物30,31
通过对19位羧基修饰,引入杂环亚结构单元,有利于提高异斯特维醇的抗肿瘤活性。2017年,Liu[20]通过19位羧基酰氯化、亲核取代、亲核加成、环合反应合成出23个19位羧基修饰的噁二唑骈异斯特维醇衍生物,抗肿瘤活性结果显示,化合物32(图13)对HCT-116和JEKO-1活性较好,IC50分别为(5.00±0.6)μM/mL和(3.73±0.3) μM/mL。进一步定量构效关系研究发现,噁二唑环对抑制HCT-116细胞活性具有积极的正贡献。
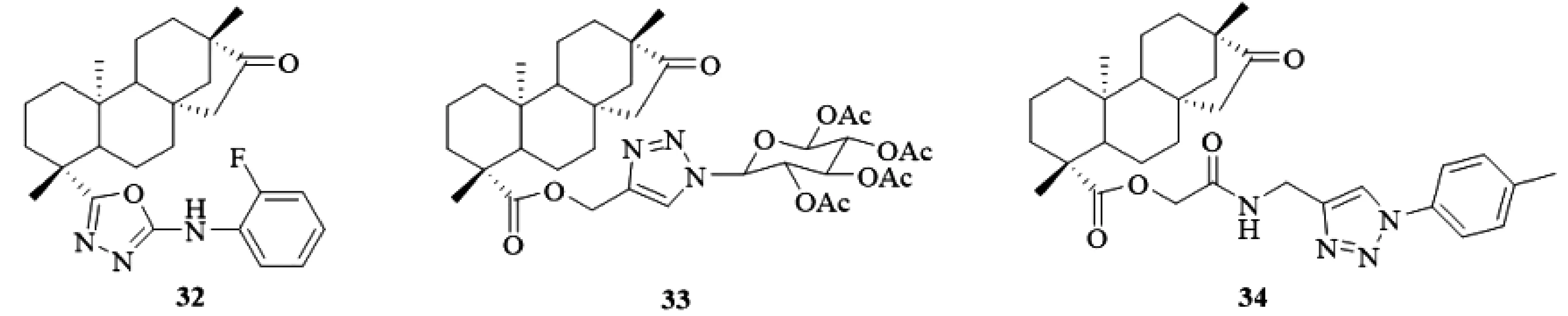
图13 19位羧基修饰的杂环骈异斯特维醇酯衍生物32-34
2016~2018年,Liu[10]和Luan等人[21]分别对异斯特维醇19位羧基修饰,将炔基引入到19位羧基上,然后通过“Huisgen click”反应分别合成出系列19位羧基修饰的1,2,3-三氮唑骈异斯特维醇衍生。肿瘤活性结果显示:化合物33(图13)对HCT-116细胞活性最佳,IC50=(19.310±0.818)μM/mL,而化合物34(图13)对HCT-116,BEL-7402和HepG2细胞均具有较好的抑制活性。
3 结论与展望
综上所述,异斯特维醇具有抗肿瘤作用,尤其是利用化学合成方法,对异斯特维醇D环和19位羧基进行结构修饰,引入羟基、氨基醇、硫脲、α,β-环外不饱和酮、磷/膦酸酯、糖基以及杂环等活性结构单元,得到的新型异斯特维醇衍生物表现出更为显著的抗肿瘤功效。此外,尽管目前合成了大量的衍生物,并进行了抗肿瘤活性试验,但结构修饰主要集中在异斯特维醇的D环和19位羧基处,A,B和C环区域改造涉及相对较少;抗肿瘤活性研究主要是体外细胞毒活性评价,相应化合物的临床试验研究依然缺乏。因此,在丰富异斯特维醇衍生物结构类型的基础上,后期重点开展构效关系、抗肿瘤作用机制以及临床试验研究,从而开发出高效低毒的异斯特维醇抗肿瘤新药。
