凤丹牡丹胚培养体系建立及初代畸形苗甲基化变异分析
2020-11-18廉小芳李昱莹张婉青郭丽丽张有福侯小改
廉小芳,李昱莹,张婉青,郭丽丽,张有福,侯小改
(1.河南科技大学 农学院/牡丹学院,河南 洛阳 471023; 2.河南省油用牡丹工程技术研究中心,河南 洛阳 471023)
油用牡丹凤丹(Paeoniaostii‘Fengdan’)具有良好的观赏、食用及药用价值,因其籽油品质高且具有很强的生态适应性而被广泛种植[1-2]。作为我国新兴木本油料作物,油用牡丹凤丹繁殖技术的研究具有极高的经济以及生态价值。目前针对牡丹的传统繁殖技术较为成熟,但传统技术繁殖效率低、生长周期长且受自然条件限制,难以满足凤丹牡丹产业化的市场需求[3-4],因此加强组织培养相关技术的研究将有利于凤丹牡丹高效繁殖及育种工作的推进。
目前,国内外针对牡丹组织培养已有一定研究成果。外植体种类繁多,主要有鳞芽、土芽、叶片、叶柄、花药等,其中以牡丹鳞芽为外植体进行培养的研究报道居多[5-8],但鳞芽适宜取材时间较短,花药、雄蕊、花丝等更是受取材时间所限,而以叶片、土芽等为外植体进行离体培养存在褐化率高、污染率高和易玻璃化等现象。以种胚为外植体进行离体培养可有效避免上述问题,且对提高种子萌发率、进行杂种胚挽救和提高育种效率均具有重要意义[9]。有研究表明,内部种胚器官分化完成的胚珠才可成功完成离体培养,早期胚珠则不行[10]。因此以凤丹牡丹成熟种胚建立胚培养体系可保障培养效率,为建立再生体系的研究提供充足可靠的无菌试材,同时有效提高凤丹牡丹组培技术在实践生产中的应用效率。
DNA甲基化是重要的表观遗传现象之一,在植物环境适应、生长发育、基因组进化等方面具有重要的作用[11]。在植物的正常生长过程中,DNA甲基化水平与模式的改变会对植物的器官发育、物质代谢、植株形态等产生重要影响[12]。植物组织培养过程中,培养材料DNA甲基化模式会连续发生不同程度的变化,这表明在组织培养过程中遗传物质发生了不同程度的表观遗传重编程现象[13]。植物组织培养过程会出现少量畸形苗,而关于组培畸形苗的发生及成因的研究尚不多见[14-15],对组培苗DNA甲基化变异的研究也鲜见报道[16-17]。因此,在建立凤丹牡丹胚培养体系的同时,运用甲基化敏感扩增多态性技术(MSAP)对相同培养条件下正常组培苗与畸形组培苗进行甲基化研究,分析不同发育形态组培材料甲基化水平及模式变异,为进一步探索凤丹牡丹最优无菌体系的建立提供理论依据,同时为凤丹牡丹组培苗表观遗传分析鉴定提供技术支持。
1 材料和方法
1.1 凤丹牡丹胚培养试验材料
建立凤丹牡丹胚培养体系所用试验材料为当年新采收凤丹牡丹成熟种胚。供试种子采自河南科技大学牡丹试验基地树龄9 a的健壮母株。挑选颗粒饱满、种皮色泽明亮无破裂的健康成熟种子剥取种胚进行离体培养。
组培室光照强度为2 000~3 000 lx(冷光灯),光照周期为16 h/d(6:30—22:30),室内温度为(25±1)℃。
1.2 凤丹牡丹胚培养体系的建立
1.2.1 不同光照及温度培养条件处理 试验共设置6个处理(表1),研究凤丹牡丹胚培养中不同光照及温度条件对成苗率的影响。各处理以改良MS培养基(Ca2+加倍)为基本培养基(1.2.2同)。重复3次,每个重复10瓶,每瓶接种3个成熟种胚(1.2.2、1.2.3、1.2.4同)。

表1 凤丹牡丹胚培养温度及光照培养条件Tab.1 P.ostii ‘Fengdan’ embryo culture temperature and light culture conditions
1.2.2 不同大小凤丹牡丹成熟种胚处理 研究不同大小成熟种胚(<3 mm、3~4 mm、>4 mm)对污染率、存活率及成苗率的影响。培养光照条件为暗培养7 d后光照培养,温度为(25±1)℃(1.2.3和1.2.4同)。
1.2.3 不同配比植物生长调节剂处理 以改良MS培养基(Ca2+加倍)为基本培养基,植物生长调节剂种类及其质量浓度配比如表2所示,共设置20个处理,研究凤丹牡丹胚培养中不同植物生长调节剂配比对污染率、存活率及成苗率的影响。

表2 凤丹牡丹胚培养不同植物生长调节剂配比Tab.2 P.ostii ‘Fengdan’ embryo culture with different plant growth regulators mg/L
1.2.4 不同质量浓度外源添加物处理 以改良MS培养基(Ca2+加倍)加0.8 mg/L NAA、1.0 mg/L 6-BA为培养基,分别添加不同质量浓度外源添加物,试验共计21个处理,分别为添加马铃薯(A1—A5):0、50、75、100、150 g/L,添加香蕉(B1—B5):0、50、75、100、150 g/L,添加凤丹牡丹胚乳(C1—C5):0、50、75、100、150 g/L,添加椰汁(D1—D5):0、50、75、100、150 mL/L,添加活性炭(E1—E5):0、0.5、1.0、1.5、2.0 g/L。研究凤丹牡丹胚培养中不同外源添加物对存活率与成苗率的影响。
1.3 凤丹牡丹胚培养畸形苗甲基化分析
1.3.1 DNA提取及纯化 以相同培养条件下初代培养正常组培苗与畸形组培苗(图1)为材料,使用改良版CTAB法提取基因组DNA。纯化后的DNA用1%琼脂糖凝胶电泳检测完整性。用Nano Photometer(IMPLEN,德国)分光光度计检测DNA样品纯度及浓度。其中畸形组培苗判断标准为:畸形苗两子叶间不长真叶,反而从子叶边缘或背面长出触手状组织,该组织不再发育成苗,最终发黄枯萎。
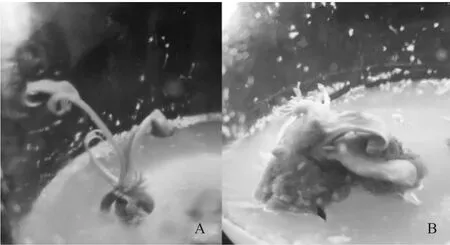
图1 凤丹牡丹胚培养正常组培苗(A)和畸形组培苗(B)Fig.1 Normal embryo culture seedling(A) and malformed embryo culture seedling(B) of P.ostii ‘Fengdan’
1.3.2 MSAP体系建立 将限制性内切酶EcoRⅠ分别与HpaⅡ、MspⅠ组合对样品进行双酶切,酶切完成后进行人工接头连接反应,建立预扩增体系及选择性扩增体系。试验中所用接头及引物信息如表3所示。最后用聚丙烯酰胺凝胶电泳检测,得到相关聚丙烯酰胺凝胶电泳图,统计电泳条带,对组培苗进行甲基化水平及变异分析。

表3 MSAP体系建立的接头和引物信息Tab.3 MSAP system established adapter and primer information
1.4 数据统计分析
1.4.1 凤丹牡丹胚培养数据统计 培养30 d后观察组培苗生长状况,统计相关指标。成苗率、污染率及存活率计算公式如下,成苗率=诱导发育成苗外植体数/存活外植体总数×100%,污染率=污染外植体数/接种外植体总数×100%,存活率=存活外植体数/接种外植体总数×100%。
数据采用Excel 2010和SPSS 17.0进行统计和分析,选用邓肯法进行单因素方差分析(P<0.05)。
1.4.2 MSAP体系建立数据统计 甲基化条带数据采用Quantity One和Excel 2010进行统计和分析,统计显影后的聚丙烯酰胺凝胶电泳图版,将条带清晰显示的记为“1”,无条带显示处记为“0”,记录所有选择性扩增引物组合的MSAP图谱,组成二次元矩阵,统计DNA甲基化4种带型,包括非甲基化(Ⅰ)、半甲基化(Ⅱ)、全甲基化(Ⅲ)、超甲基化(Ⅳ)带型,分析甲基化水平。总扩增位点数=Ⅰ+Ⅱ+Ⅲ,总甲基化位点数=Ⅱ+Ⅲ+Ⅳ,总甲基化率=(Ⅱ+Ⅲ+Ⅳ)/(Ⅰ+Ⅱ+Ⅲ+Ⅳ)×100%,全甲基化率=(Ⅲ+Ⅳ)/(Ⅰ+Ⅱ+Ⅲ+Ⅳ)×100%,半甲基化率=Ⅱ/(Ⅰ+Ⅱ+Ⅲ+Ⅳ)×100%。
2 结果与分析
2.1 凤丹牡丹胚培养中不同光照、温度培养条件对成苗率的影响
由表4可知,不同光照及温度培养条件对成苗率具有显著影响;相同培养温度(25±1)℃下,T2处理成苗率最高,为60.57%,分别是T1、T3、T4处理的1.58、1.21、1.40倍,故暗培养7 d后光照培养有利于凤丹牡丹胚发育成苗;而对比T2、T5、T6处理,同为暗培养7 d后光照培养,T5、T6处理因温度下降成苗率显著降低。综上所述,最适培养条件为(25±1)℃下暗培养7 d后进行光照培养。
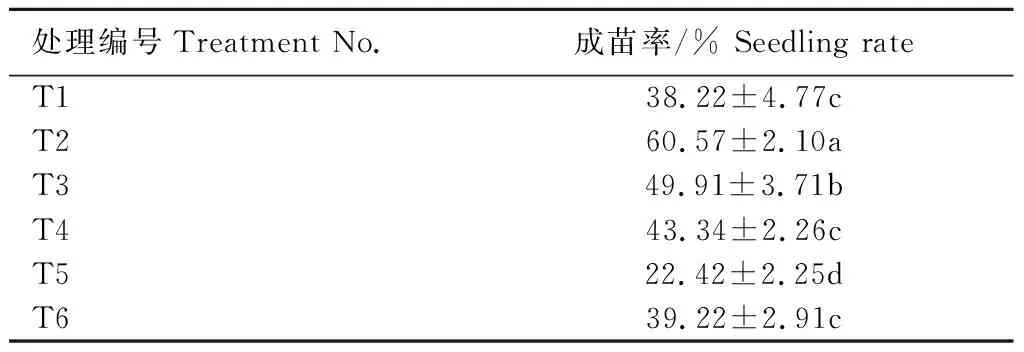
表4 凤丹牡丹胚培养中不同培养条件对成苗率的影响Tab.4 Effect of different culture conditions on the seedling rate of P.ostii ‘Fengdan’ embryo culture
2.2 凤丹牡丹胚培养中不同大小成熟种胚对污染率、存活率及成苗率的影响
由表5可知,不同大小成熟种胚均能发育成苗,但成苗率无显著差异。与其他处理相比,成熟种胚长度<3 mm时,污染率最高(12.22%),存活率最低(77.78%),差异显著。成熟种胚长度为3~4 mm时,

表5 凤丹牡丹胚培养中不同大小成熟种胚对成苗率等的影响
其污染率最低(5.56%),存活率最高(87.78%),与>4 mm成熟种胚培养效果无显著差异。因此,凤丹牡丹胚培养最佳外植体为≥3 mm的成熟种胚。
2.3 凤丹牡丹胚培养中不同植物生长调节剂配比对污染率、存活率及成苗率的影响
由表6可知,对比含NAA的Z1—Z10各处理组,污染率最高只有6.67%,含IAA的Z11—Z20各处理组,污染率最低至8.89%,说明凤丹牡丹胚培养过程中添加IAA处理污染率整体高于NAA处理。Z10处理下存活率最高,为91.11%,其次是Z5(90.00%)和Z6(90.00%)处理。Z6处理组成苗率为81.42%,显著高于其他各处理。因此,综合3项指标,Z6处理为凤丹牡丹胚培养最适生长调节剂配比,即0.8 mg/L NAA+1.0 mg/L 6-BA。

表6 不同植物生长调节剂配比对凤丹牡丹胚培养成苗率等的影响
2.4 凤丹牡丹胚培养中不同质量浓度外源添加物对存活率与成苗率的影响
由表7可知,A、B、D各处理组存活率及成苗率无显著差异,而D组长势最好,其中D组中最佳处理为D3,其存活率为92.22%,成苗率为85.66%;与C1相比,凤丹牡丹胚乳的添加显著抑制存活率及成苗率,且高浓度胚乳的添加直接导致存活率降为0,种胚无生命现象;与E1相比,E3处理显著提高成苗率,但活性炭的添加对成熟种胚存活率无显著影响。综合分析,D3处理,即改良MS培养基(Ca2+加倍)+0.8 mg/L NAA+1.0 mg/L 6-BA+75 mL/L椰汁,成苗率较高,上胚轴长势最佳;E3处理,即改良MS培养基(Ca2+加倍)+0.8 mg/L NAA+1.0 mg/L 6-BA+1.0 g/L活性炭,成苗率最高,下胚轴长势最好。

表7 凤丹牡丹胚培养中不同质量浓度外源添加物对存活率和成苗率的影响Tab.7 Effect of different concentrations of additives on survival and seedling rate of P.ostii ‘Fengdan’ peony embryos
图2A为空白对照组,即基础MS培养基中凤丹牡丹成熟种胚培养效果,可以看出,子叶舒展真叶纤细弱小;图2B为Z6处理,即添加0.8 mg/L NAA+1.0 mg/L 6-BA处理组培养效果,可以看出,该组试管苗苗体稍壮,叶柄叶片较细;图2C为D3处理,即添加75 mL/L椰汁处理组培养效果,该组试管苗叶片厚实,苗体茁壮;图2D为E3处理,即添加1.0 g/L活性炭处理组培养效果,可以看出,活性炭的添加显著促进胚根的伸长,真叶与子叶生长相对停滞,但苗体分化完全。

A—D分别为MS空白培养基、最适植物生长调节剂(Z6)、最适椰汁(D3)、最适活性炭(E3)处理培养效果 A—D are the culture effects of MS blank medium,optimal plant growth regulator(Z6), optimal coconut milk(D3) and optimal activated carbon(E3) respectively
2.5 凤丹牡丹胚培养畸形苗甲基化水平分析结果
选用30对特异性引物进行筛选,最终确定使用26对引物进行畸形组培苗DNA甲基化水平分析,得到相关聚丙烯酰胺凝胶电泳图(图3)。根据显影结果可知,泳道内共呈现4种条带类型,分别为Ⅰ 型、Ⅱ型、Ⅲ型、Ⅳ型,分别代表4种DNA甲基化模式,依次为非甲基化、半甲基化、全甲基化和超甲基化。
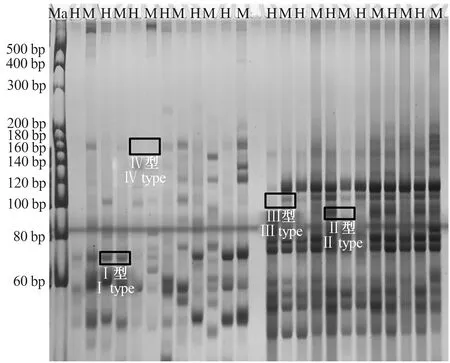
Ma:DNA marker DL20;H:HpaⅡ酶切片段,M:MspⅠ酶切片段,表9同 Ma:DNA marker DL20;H:HpaⅡdigestion fragment,M:MspⅠdigestion fragment,the same as Tab.9
由表8可知,正常组培苗中共检测到599个扩增位点,平均每对引物扩增23.04个位点,畸形组培苗中共检测到726个扩增位点(比正常组培苗增多21.20%),平均每对引物扩增27.92个位点。正常组培苗和畸形组培苗DNA发生甲基化均以全甲基化为主,全甲基化率分别为59.89%和48.28%。以正常组培苗为对照,分析畸形组培苗甲基化水平变化发现,畸形组培苗总甲基化水平较低,仅有74.30%,较正常组培苗(85.38%)减少了11.08个百分点,且畸形组培苗全甲基化率较低(48.28%),减少了11.61个百分点,但其半甲基化率较高(26.02%)。

表8 凤丹牡丹正常组培苗与畸形组培苗甲基化水平Tab.8 Methylation levels of P.ostii ‘Fengdan’ normal embryo culture seedling and malformed embryo culture seedling
2.6 凤丹牡丹组培畸形苗甲基化模式变异分析结果
由表9可知,凤丹牡丹畸形组培苗共出现4类15亚类变异模式,其中DNA甲基化模式变异A类为单态型变异,3种亚类扩增位点数分别为67、49、48个,且单态型变异占总扩增位点的17.63%。多态型变异类型中,B1—B5为去甲基化变异,扩增位点数变幅为47~130个,且去甲基化变异高达46.45%,占比最多,C1—C5为超甲基化变异,其占比仅有26.67%。因此,在凤丹牡丹畸形组培苗中DNA甲基化模式变异以去甲基化变异为主导。
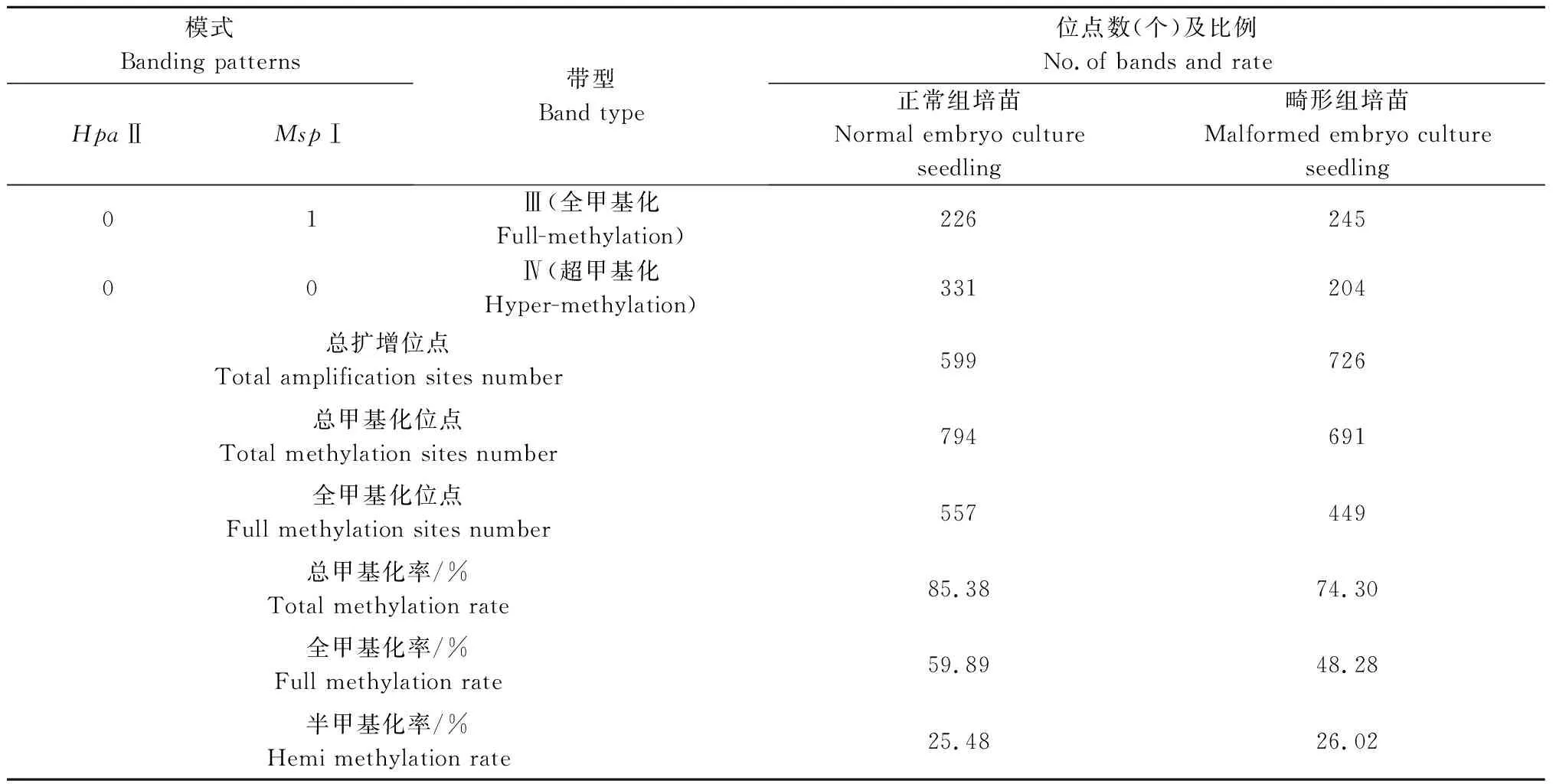
续表8 凤丹牡丹正常组培苗与畸形组培苗甲基化水平Tab.8(Continued) Methylation levels of P.ostii ‘Fengdan’ normal embryo culture seedling and malformed embryo culture seedling
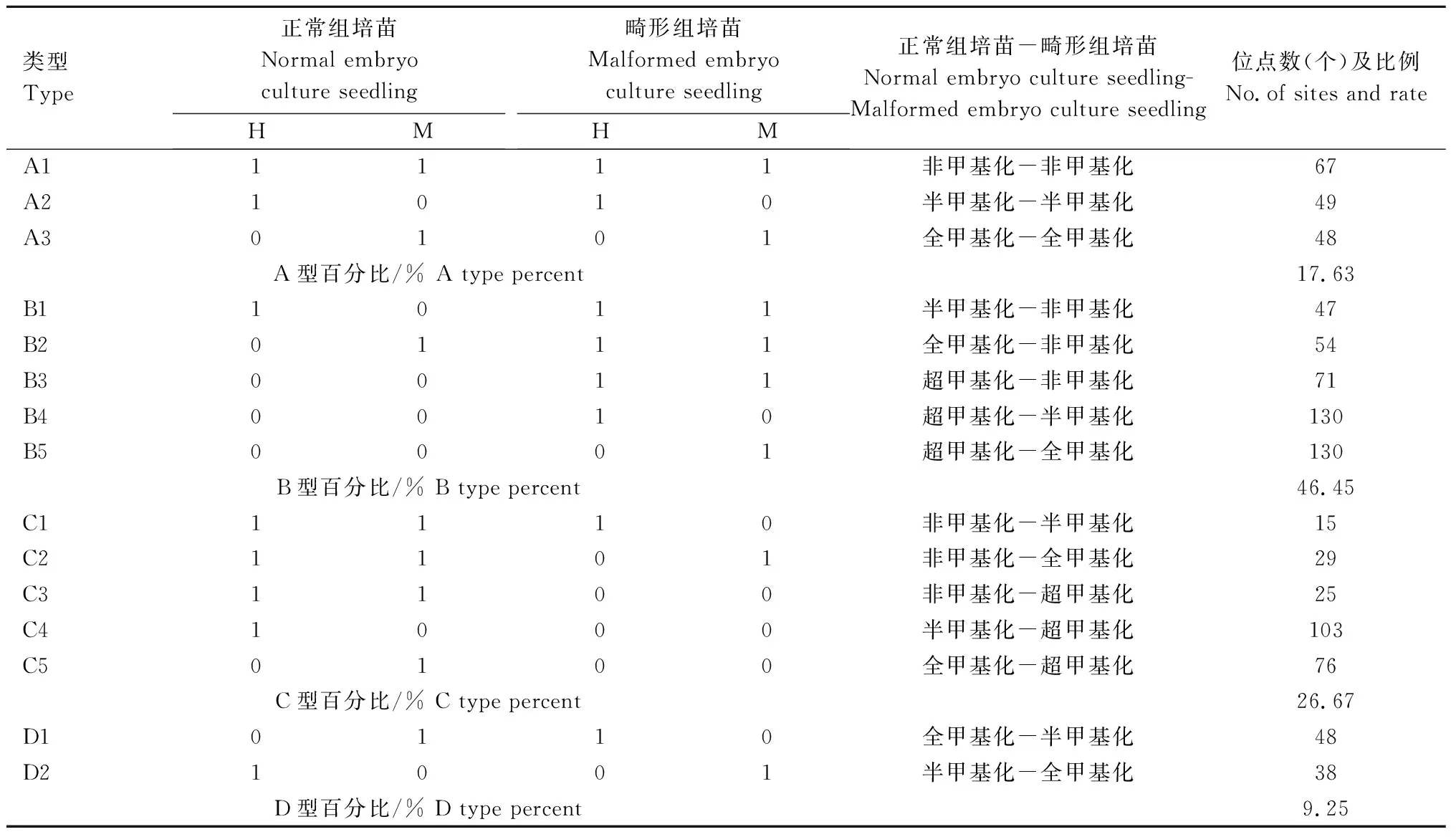
表9 凤丹牡丹组培畸形苗甲基化模式变异Tab.9 Variations in methylation patterns in P.ostii ‘Fengdan’ embryo culture seedling
3 结论与讨论
3.1 凤丹牡丹胚培养体系的建立
组织培养技术可以在很大程度上打破传统牡丹育种技术固有的局限性,但现如今牡丹组培体系尚未成熟,多数工作仍集中在外植体选择、培养基优化、褐化及玻璃化现象的改善等方面[18-21]。由于以种胚为外植体可以合理避开外植体取材时间的限制,越来越多的研究学者开始致力于牡丹种胚诱导体系的建立和完善。多数研究表明,牡丹胚培养时已打破休眠后的种子成苗率最高[10,20],且本试验发现,胚培养时不同大小成熟种胚的成苗率虽无显著差异,但≥3 mm的成熟种胚存活率显著高于小种胚(<3 mm),推测在前期种子预处理中较小成熟种胚在浸泡时种胚易回缩,使胚乳在相应位置产生环状缝隙从而提升了污染的可能性,进而削弱了后期接种前试剂消毒的效力从而提升了污染率,尽管如此,成熟种胚外植体还是以其低污染零褐化优于其他外植体选用方案,因此后续试验可优先选择≥3 mm的成熟种胚作为外植体,从而优化凤丹牡丹组培体系。杨红超等[22]在牡丹种子胚培养研究中发现,需要先进行暗培养,而光照条件下培养45 d牡丹种胚只增大不萌发,暗培养和先进行7 d暗培养再进行12 h/d光照培养种胚萌发率均较高,且两者之间无明显差异。本研究发现,接种后直接光照确实会显著降低种胚成苗率,但不至于完全不萌发,且与前人不同的是,经暗培养7 d后光照培养的种胚成苗率显著高于完全暗培养,成苗率增加了17.23个百分点,这可能与试验材料差异以及前人设定光照周期较短有关。安阿莉[23]研究表明,低温预处理能够促进紫斑牡丹种胚萌发,4 ℃低温沙藏15 d后接种培养,可显著提高萌发率。本研究结果显示,4 ℃低温培养凤丹牡丹成熟种胚时,成苗率显著低于正常温度,成苗率为22.42%,猜想低温处理的介质会对种胚的诱导产生不同的效应。
关于不同质量浓度植物生长调节剂配比对牡丹成熟种胚培养的影响已有大量报道,植物生长调节剂种类多为NAA、6-BA、IAA、GA3等。大量研究表明,6-BA和NAA共同作用有助于提高凤丹牡丹种胚培养的成苗率[24-26]。本试验同样证实了该观点,研究发现改良MS培养基(Ca2+加倍)+0.8 mg/L NAA+1.0 mg/L 6-BA显著提高凤丹牡丹种胚培养效率,种胚成苗率高达81.42%。除了生长调节剂的配比,在植物组培过程中还会添加各种外源物质对培养基营养成分进行进一步补充。徐德林等[27]发现,加入适宜浓度外源添加物(香蕉、椰汁等)能不同程度上促进白及离体培养时各组织的生长。王英姿等[28]结果表明,除香蕉外,椰汁、土豆等其他果蔬添加物均可提高铁皮石斛丛生芽生长率。王爱勤等[29]添加活性炭离体培养芦荟发现,3.0 g/L的活性炭可抑制芦荟组培苗玻璃化,且促进芦荟苗增殖、生长和生根。本试验发现,适宜质量浓度椰汁和活性炭的添加有助于提高凤丹牡丹成熟种胚培养效率,采用改良MS培养基(Ca2+加倍)+0.8 mg/L NAA+1.0 mg/L 6-BA+75 mL/L椰汁培养成熟种胚时成苗率达85.66%,该组试管苗叶片厚实,苗体茁壮;采用改良MS培养基(Ca2+加倍)+0.8 mg/L NAA+1.0 mg/L 6-BA+1.0 g/L活性炭时成苗率为90.46%,促进胚根伸长。另外本试验结果表明,培养基中胚乳的添加直接阻碍凤丹牡丹成熟种胚的生长发育,所得结果与WANG等[30]的研究结果一致。
3.2 凤丹牡丹畸形组培苗DNA甲基化水平及模式变异
在植物生长发育过程中,体细胞遗传变异或表观遗传变异现象的出现会直接导致其优良性状的丢失,该现象将严重影响植物自身的经济价值[31]。在植物组织培养的过程中,由于离体培养时间、培养条件及继代次数等原因,体细胞无性系变异为常见现象,且变异率高达30%~40%[32-34],因此对组培苗进行遗传变异的检测十分重要。CARNEROS等[35]研究表明,胚胎发生过程中冷胚发生环境(18 ℃)及温暖胚胎发生环境(28 ℃)的表观遗传记忆会影响挪威云杉表型中的胚芽物候和芽萌发相关基因的表达。苗徐静[36]研究草莓离体快繁技术及草莓离体材料遗传变异时发现,随继代次数的增加,草莓组培苗甲基化率也有所变化。LI等[37]研究认为,在植物体胚发生过程中,DNA甲基化的发生能够调控植物体胚发生相关基因WUS等的表达,进而调控下游转录因子和相关功能基因的表达。关于牡丹组织培养体系中离体植株遗传变异的研究尚未见报道,本试验选择胚培养中畸形组培苗为材料,对畸形苗的表观遗传现象进行初步探索,发现畸形组培苗总甲基化率较低,且主要以全甲基化(48.28%)形式存在,该结果与其他高等植物组织培养中组培苗总甲基化率较低且全甲基化发生形式占比较多相一致[17,37-38],同时,凤丹牡丹畸形组培苗DNA甲基化模式变异共有四大类,主要以多态型去甲基化变异为主,说明凤丹牡丹组培苗在无性系繁殖过程中,表观遗传变异的存在导致一定程度上部分基因表达发生改变。
对凤丹牡丹畸形苗DNA甲基化的初步研究,不仅可以在表观遗传学角度为畸形苗的发生机制提供新的研究思路,而且有助于对凤丹牡丹离体后的种质资源遗传稳定性进行评估,为其快速繁殖及高品质保存提供理论依据。
