1例子宫内膜癌术后孤立性脾转移癌的诊断及治疗
2020-11-13郑巍顾玉青杨晓俊李亚男张彬钱祝银
郑巍,顾玉青,杨晓俊,李亚男,张彬,钱祝银
南京医科大学第二附属医院,南京210011
研究[1]显示,脾转移癌临床极其少见,仅占恶性肿瘤转移患者的0.96%。子宫内膜癌的孤立性脾转移癌更是罕见,国内外文献仅有少量报道。大多数脾转移癌患者早期无症状,因此很难早期发现。国内目前仅有2例对子宫内膜癌孤立性脾转移癌的报道,对患者的诊治缺乏成熟的经验。本研究回顾性分析了1例子宫内膜癌术后孤立性脾转移癌患者的临床资料,探讨子宫内膜癌术后孤立性脾转移癌的有效诊断及治疗方法。
1 资料分析
患者,女,69岁,2019年6月4日因“子宫内膜癌术后2年余,左上腹疼痛不适10余天”入院。患者于2016年9月因子宫内膜癌行腹腔镜子宫+双侧附件+盆腔淋巴结+主动脉旁淋巴结+大网膜切除术,术后病理提示:子宫体腺癌,Ⅱ~Ⅲ级,为高级别浆液性腺癌,肿块大小4.5×2.5×0.7 cm,侵犯子宫肌壁小于1/2全层,癌组织未累及子宫颈黏膜;淋巴结(左盆腔、右盆腔、主动脉旁、髂骨)无转移;P16(++++)、P53(++++)、ER(10%)、PR(-)、Ki-67(80%+)、vimentin(-)、PTEN(++)、Pax-8(focus+)。术后因患者拒绝而未行放化疗。患者于2019年5月22日劳作后开始出现左侧腰腹部疼痛,呈持续性钝痛,疼痛数字评分法(NRS)评分3分,至滨海县人民医院进行肿瘤指标筛查,其中糖类抗原CA-125水平为466.52 U/mL,明显升高,其余结果正常;同时CT检查提示:①腹腔镜子宫+双侧附件+盆腔淋巴结+主动脉旁淋巴结+大网膜切除术后变化(盆腔内未见子宫及其附件);②脾脏占位性病变(囊性)。遂转至我院就诊,入院查腹主动脉CT+门静脉血管CT(CTA+CTV)提示:脾脏体积增大,脾内见多发类圆形低密度影,大小约7.6×5.0 cm,边界欠清,其内多见分隔,增强病灶囊壁及分隔可见轻中度强化,周围见低密度影,呈“双环征”表现,病灶部分突出于脾脏轮廓(见图1),考虑脾脏脓肿或者恶性肿瘤转移可能。由于患者没有发烧、呕吐或白细胞上升这些脾脏脓肿的特征,排除脾脏脓肿可能。结合病史,初步诊断为子宫内膜癌术后孤立性脾转移癌。
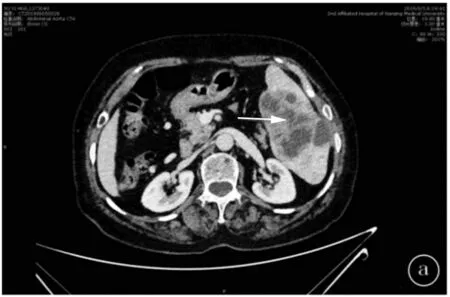
注:箭头处为病灶图1 患者的CTA+CTV检查图像
患者于2019年6月10日接受脾切除术治疗。术中探查腹腔、盆腔未见明显占位性病灶,网膜已切除;可见脾脏增大,表面可及多处肿块,肿块质地硬,局部侵犯侧腹膜。手术切除病变侵犯的脾脏、部分腹膜及腹膜外脂肪组织(见图2)。术后病理见:切除脾脏一个,大小14.5×9×5 cm,肿块大小9×7.5×4.5 cm,部分为囊性,囊性组织壁厚约0.3 cm,实部断面呈灰白色,局部为灰红色,易碎。免疫组化结果显示:ER(-)、PR(-)、Vimentin(-)、P53(+++)、CA125(+)、WT1()、PTEN()、P16(+++)、CK7(+)、CK20(-)、Villin(-)、Ki-67(80%)、Pax-8(+)。结合术后病理,明确诊断为子宫内膜癌术后孤立性脾转移癌。患者手术治疗1周后恢复良好,拒绝行后续化疗治疗。
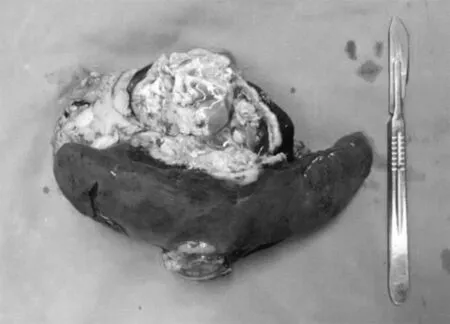
注:中心灰白部分为癌灶。图2 患者切除的脾脏、部分腹膜及腹膜外脂肪组织标本
2 讨论
本例患者原为子宫内膜高级别浆液性腺癌,恶性程度高,且因患者拒绝而术后未行放化疗。术后32个月,患者因明显左下腹痛就诊,入院CT检查发现脾脏占位性病变,根据美国子宫内膜癌的诊断指南[2],结合体征、病史和CT检查等结果,初步诊断为子宫内膜癌术后孤立性脾转移癌,后行脾切除术治疗,术后病理和免疫组化均证实为子宫内膜癌术后孤立性脾转移癌。
研究[3, 4]显示,由于脾动脉与腹主动脉呈锐角、脾传入淋巴管少、脾包膜的节律性收缩以及脾脏的抗肿瘤免疫活性等特殊的解剖结构和微环境,脾脏并不是一个常见的癌细胞转移部位;Peters[5]提出的理论指出: 脾脏在粒细胞的生理性破坏过程中具有很高的活性,其促细胞凋亡环境可以诱发肿瘤细胞的凋亡,抑制肿瘤细胞存活,因此肿瘤转移累及脾脏的患者比较少见,主要是乳腺癌、肺癌、结直肠癌和黑色素瘤,其中孤立性脾转移最常见的来源是结直肠癌和卵巢癌,这些肿瘤转移灶通常位于脾脏包膜上,预示着播散性转移,预后不良。国外统计的近100例孤立性脾转移患者中,有一半以上来源于女性生殖道,其中最常见的是卵巢恶性肿瘤(30例),其余包括子宫内膜癌(13例)、宫颈癌(6例)和输卵管癌(1例)[6]。子宫内膜癌的脾转移一般是孤立性的,预后良好,临床上非常罕见,迄今为止,国内外文献[6~10]共报道了17例,国内仅有2例。
脾转移癌一般是癌细胞通过血行转移到脾实质内发生的,通常形成孤立的转移灶[11~13]。由于早期是血行转移,脾脏的抗肿瘤免疫活性导致转移的癌组织生长受限,因此子宫内膜癌孤立性脾转移通常会有一段临床潜伏期。在已报道[6~10]的17例子宫内膜癌孤立性脾转移癌患者中,复发时间从11个月到120个月不等,平均潜伏期为33.48个月。本例患者在术后32个月出现症状,与相关研究结果一致。脾转移癌多侵犯脾脏的上极、下极或门部,少数浸润包膜[14~16]。研究[8]显示,脾转移癌主要有4种类型:结节型、弥漫型、粟粒型和膜型。本例患者为结节型,与国内2例报道一致。
子宫内膜癌孤立性脾转移癌的临床表现不典型,且脾区疼痛、脾脏肿大等典型阳性症状体征少见,故临床易出现漏诊、误诊,早期发现多依赖于肿瘤病史以及影像学检查。子宫内膜癌孤立性脾转移癌的首选诊断方法为常规超声、CT和MRI检查,脾切除术后的组织病理学检查可以确诊肿瘤类型。La Fianza等[17]在对肿瘤切除术后脾转移检测的研究中发现,超声和CT对病灶的诊断均表现出较高的敏感性和特异性,但对于微结节转移灶和脾肿大的早期检测,CT更有优势。近十年来,正是由于这些影像学检查手段被规律运用于肿瘤患者的随访过程中,才增加了孤立性脾转移癌的发现率,相关的病例报告在不断增加。
在肿瘤患者的随访过程中发现孤立的脾脏占位时,应优先考虑肿瘤转移的可能,但在临床实际中,仅依靠影像学表现,很难将转移性脾癌与原发性脾脏病变(例如淋巴瘤,血管瘤或传染性疾病)相鉴别。研究显示,血清癌胚抗原和糖类抗原19-9等肿瘤标志物的水平,对于转移性脾癌的早期诊断有一定的价值[18];18F-FDG正电子发射断层扫描有助于区分脾脏占位性病变的良恶性[19],但确诊仍需行组织学诊断。脾脏作为一个高度血管化的器官,其潜在的出血风险较大,因此通常被认为不适合进行细针穿刺(FNA),但Cavanna等[20]研究显示,该技术安全有效(160例行FNA脾脏活检的患者,结果总准确率为98.1%,无1例发生并发症)。子宫内膜腺癌的病理免疫组化结果具有较高的诊断价值,原发性肿瘤及其转移多为CK7、CA-125阳性和CK20阴性,可作为判断脾脏转移来源是否为子宫内膜癌的依据。
脾切除术作为治疗良性脾肿瘤和恶性血液病的标准治疗手段,为孤立性脾转移癌患者提供了根治的机会,脾切除术不仅能减轻脾肿大的疼痛、预防脾破裂、脾静脉血栓形成等严重并发症,还减少了肿瘤从脾脏向远处扩散的机会,并提供了治愈或延长生存期的可能性[21]。Makrin等[22]报告了他们使用脾切除术治疗28例孤立的脾脏肿瘤的成功经验,患者无1例术后死亡,并提倡将其用于大多数脾脏肿瘤的治疗。研究[2]显示,脾切除术已成为治疗子宫内膜癌孤立性脾转移癌的首选方法。
综上所述,子宫内膜癌术后孤立性脾转移癌较为罕见,存在临床潜伏期,临床表现无特异性,CT检查有一定的诊断价值,确诊需病理学检查。子宫内膜癌患者术后需定期复查,一旦确诊有脾转移癌,需尽早行脾脏切除术治疗,并可追加术后辅助化疗,以最大程度延长患者的生存期。尽管子宫内膜腺癌引起的脾脏转移很少,但脾脏作为潜在转移区域,需引起临床重视。
