伊马替尼联合CCLG ALL-2008方案对Ph阳性急性淋巴细胞白血病儿童无病生存期及不良反应的影响探究
2020-11-12曹文娟李彩霞郭书芳
贾 雯,曹文娟,李彩霞,郭书芳
(郑州大学附属儿童医院/郑州儿童医院血液肿瘤科,郑州 450000)
急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)是临床常见的血液恶性肿瘤疾病,而Ph阳性(Ph-positive,Ph+)ALL为ALL分组中的高危组,约占儿童ALL的5%[1]。目前Ph+ALL患儿仅通过单纯的化疗疗效不佳、缓解率低、预后差,因此亟待提出更好的临床治疗方法。近年来,酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)广泛应用于临床[2],有文献报道[3]伊马替尼联合化疗在Ph+ALL成人患者的治疗中临床疗效较好,但关于其在Ph+ALL儿童中的应用报道较少,是否能进一步延长患儿的长期无病生存期以及相关的不良反应需要更多的临床研究加以验证。本研究笔者就伊马替尼联合CCLG ALL-2008方案对Ph+ALL儿童无病生存期及不良反应的影响展开报道,旨在为临床提供数据支持和参考,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2012年1月~2013年6月本院治疗的86例儿童Ph+ALL患儿。根据治疗方法的不同,将进行伊马替尼联合CCLG ALL-2008方案治疗的47例患儿作为观察组,仅进行CCLG ALL-2008方案治疗的39例患儿作为对照组。对照组:男性28例,女性19,平均年龄(8.14±4.11)岁;观察组:男性24例,女性15例,平均年龄(8.36±3.89)岁;两组患儿性别、年龄等一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经本院伦理学会批准进行。
纳入标准:① 入院经临床确诊为Ph+ALL的患儿,诊断标准参考《NCCN临床实践指南:急性淋巴细胞白血病(2012.V1)》[4]。② 患儿年龄≤14岁者。③ 患儿为初次诊断Ph+ALL,未接受过治疗者。④ 患儿监护人知情本研究内容并签署知情同意书。
排除标准:① 诊断为其他类型的血液肿瘤疾病患儿。② 对本次研究使用的药物过敏的患儿。③ 合并严重的心、脑血管系统疾病以及肝、肾、肺等实质性脏器组织疾病的患儿。④ 合并精神类疾病或无法配合治疗的患儿。
1.2 方法
两组患儿在明确诊断后,先给予醋酸地塞米松片(天津力生制药股份有限公司,国药准字H12020122,规格:0.75 mg)10 mg/m2·d分3次口服进行预治疗,待评估疗效后制定给药方案。对照组患儿依据CCLG ALL-2008方案化疗,观察组患儿给予甲磺酸伊马替尼片[(江苏豪森药业集团有限公司,国药准字H20133200,0.1 g(按C29H31N7O计)]联合CCLG ALL-2008方案化疗。具体方法如下:① 对照组:CCLG ALL-2008方案参照《中华儿科白血病专家共识》[5]。② 观察组:采用和对照组相同化疗方案治疗半月后,联合伊马替尼(260~340 mg/m2·d,分2次口服),给药至停药,之后随访观察。治疗过程中患儿若出现以下情况需停药调整:① 中性粒细胞减少伴发热。② 出现严重感染。③ 出现严重的不良反应并不能耐受治疗。
观察记录两组患儿的疗效,记录患儿不良反应发生情况。
1.3 观察指标
观察两组患儿的总诱导缓解率、两组患儿的无病生存期及3年无病生存率,同时观察两组患儿不良反应情况。
1.4 评价指标
1.4.1疗效标准
根据患儿诱导缓解化疗后的改善情况将疗效分为完全缓解(complete relief,CR)、部分缓解(partial relief,PR)、轻度缓解(mild relief,MR)、无效(none relief,NR)。总诱导缓解率(%)=(CR+PR)/总例数×100。
1.4.2安全性评价
根据《National Cancer Institute Common Toxicity Criteria,NCI-CTC(4.0)》标准对药物毒性进行评价[6],抗癌药物的不良反应可分5级。① 1级是轻度:无症状或有轻微的不良反应。② 2级是中度不良反应。③ 3级是重度不良反应,严重限制日常活动,非立即危及生命的严重不良反应或导致残疾。④ 4级是需紧急治疗,危及生命。⑤ 5级是不良事件相关的死亡。
1.5 统计学方法

2 结果
2.1 两组患儿的总诱导缓解率、无病生存期及3年无病生存率比较
观察组总诱导缓解率为95.74%,对照组总诱导缓解率为92.31%,差异无统计学意义(P>0.05);观察组患儿无病生存期为(82.48±4.36)个月,对照组患儿无病生存期为(59.06±8.13)个月,差异有统计学意义(P<0.05);观察组患儿3年无病生存率(85.11%)高于对照组(66.67%),差异有统计学意义(P<0.05),见表1。

表1 两组患儿总诱导缓解率、患儿的无病生存期及3年无病生存率比较
2.2 两组患儿不良反应情况比较
观察两组患儿在治疗期间的不良反应主要有:消化道反应(如恶心、呕吐、腹痛、腹泻、便秘等)、骨髓抑制、血液系统毒性以及感染等。比较两组患儿其余不良反应发生率相当,差异无统计学意义(P>0.05),见表2。
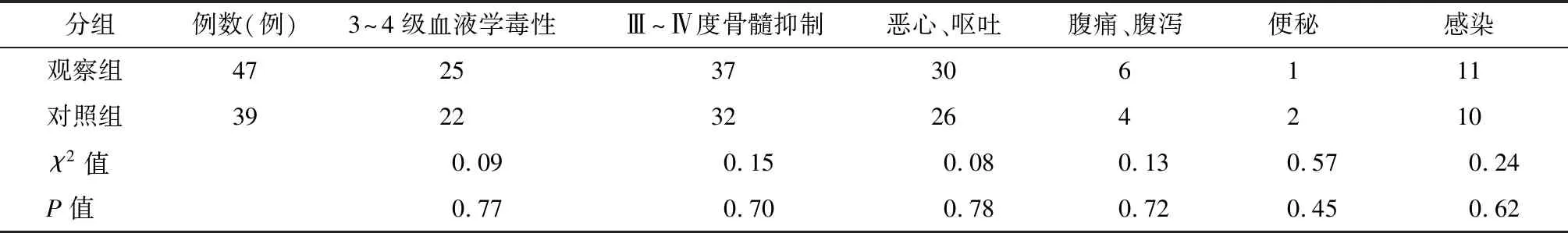
表2 两组患儿不良反应的比较
3 讨论
Ph+ALL的患儿费城染色体显带分析为t(9;22)(q34;q11),即9号染色体长臂上C-ABL原癌基因易位至22号染色体长臂的断裂点簇集区(BCR)形成BCR-ABL融合基因[7],其编码的蛋白主要为P120,该蛋白具有酪氨酸激酶活性,下游的MAPK和JAK-STAT信号转导途径被激活,生长因子的表达增强,加速白细胞的增殖。因此Ph+ALL患儿发病时通常白细胞数高,发病的概率随年龄升高,仅20%~30%的治愈率[8],预后极差。随着TKI的出现,为Ph+ALL患儿带来了新的治疗选择。
甲磺酸伊马替尼(imatinib mesylate,IM)是第1代TKI,是一种2-苯胺嘧啶衍生物,能特异性阻断ATP在abl激酶上的结合位置,使酪氨酸残基不能磷酸化,从而抑制BCR-ABL阳性细胞的增殖[9]。IM也能抑制另外2种酪氨酸激酶,即血小板衍生的生长因子受体c-kit和PDGF-R的活性。IM的平均绝对生物利用度为98%,其特点是吸收快,约有95%IM可与血浆蛋白结合,消除半衰期为18 h,在人体内主要以N-去甲基哌嗪衍生物为循环代谢产物[10],约8%的药物剂量7天内可排除(主要从粪便中排泄)。在临床报道中[11],IM极少产生耐药,若Bcr-Abl酪氨酸激酶在疾病进程中增加,提示耐药产生。因此IM联合化疗能否进一步改善Ph+ALL患儿的临床疗效和预后受到临床广泛关注。
为验证IM与化疗联合的疗效,本研究就伊马替尼联合CCLG ALL-2008方案对Ph阳性急性淋巴细胞白血病儿童无病生存期及不良反应的影响进行了对照研究。研究结果显示,就总诱导缓解率而言,两组患儿的总诱导缓解率无较大差异。比较两组患儿的无病生存期及3年无病生存率发现,联合用药组患儿无病生存期及3年无病生存率高于单纯化疗组,比较差异有统计学意义,说明了联合方案可延长患儿的无病生存期,提高患儿的生存率。观察两组患儿的不良反应发生情况,消化道反应、骨髓抑制、血液系统毒性以及感染等不良反应明显,两组患儿的不良反应发生率相差不大,说明IM的使用并不会增加对患儿的不良反应,联合用药有较大的安全性。
综上所述,伊马替尼联合CCLG ALL-2008方案对Ph+ALL儿童的治疗具有良好的安全性,可延长患儿的无病生存期、可改善预后,值得临床推广。
