2 株H7N9 亚型重组禽流感病毒的生物学特性和免疫原性研究
2020-11-10陈晓涵吴姣姣潘舒心刘艳晶施建忠邓国华包红梅陈化兰曾显营田国彬
陈晓涵,吴姣姣,潘舒心,刘艳晶,施建忠,邓国华,包红梅,陈化兰,曾显营,田国彬
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室,黑龙江 哈尔滨 150069)
2013 年春季,我国首次出现人感染H7N9 流感病毒并死亡的公共卫生事件[1]。流行病学调查结果显示,感染病例多与活禽市场暴露有关,活禽市场家禽中也分离到H7N9 亚型禽流感病毒(AIV),其基因组与人源H7N9 流感病毒高度同源[2];但该病毒对家禽呈低致病力,家禽感染后无临床症状,难以被发现,极易在家禽中传播[3]。2013 年5 月~2017 年1月,我国已有17 个省份的活禽市场或家禽养殖场中分离到H7N9 亚型AIV[4]。同时,2013 年~2017 年的冬春季节我国连续出现5 波人H7N9 流感疫情,引起社会广泛关注。世界卫生组织(WHO)数据显示,截止2017 年9 月,我国共有1 564 人感染H7N9 流感病毒病例,其中615 人死亡,疫情也同时给家禽养殖业造成严重经济损失。2017 年初,H7N9 亚型AIV由低致病力突变为高致病力[4],并在多个省份家禽中引起疫情。同时,对家禽呈高致病力的H7N9 亚型AIV 容易在哺乳动物体内发生适应性突变,提高了其致病力及在哺乳动物间的传播能力,对人类健康蕴藏更大威胁[5]。因此,控制家禽H7N9 亚型禽流感疫情和清除家禽中H7N9 亚型AIV 迫在眉睫。
疫苗免疫是禽流感防控的重要措施和关键环节。国家禽流感参考实验室利用反向遗传操作技术研制的一系列H5N1 亚型重组AI 灭活疫苗已在家禽中大量使用,控制了我国2004 年以来的H5N1 亚型禽流感疫情[6]。针对H7N9 亚型AIV 对家禽养殖业和人类健康的严重危害,国家禽流感参考实验室利用反向遗传操作技术,先后构建出以H7N9 亚型AIV HA 和NA 基因为重组病毒表面供体基因,以H1N1/PR8 病毒的M、NP、NS、PA、PB1、PB2 基因为内部基因供体的重组AIV:H7-Re1 株和H7-Re2 株。本研究对这2 株重组AIV 的生物学特性和免疫原性进行评估,以期为H7N9 亚型禽流感疫苗的研制和应用提供实验依据。
1 材料与方法
1.1 主要实验材料 3 株H7 亚型AIV:A/Pigeon/Shanghai/S1069/2013(简 称PG/SHH/S1069/13)、 A/Chicken/Guangxi/SD098/2017(简 称CK/GX/SD098/17)和A/Duck/Fujian/SE0195/2018(简称DK/FJ/SE0195/18),均为中国农业科学院哈尔滨兽医研究所国家禽流感参考实验室纯化、鉴定和保存,病毒含量分别依次为107.83EID50/0.1 mL、108.50EID50/0.1 mL、108.38EID50/0.1 mL。H7N9 亚型重组AIV H7-Re1 株和H7-Re2 株均由国家禽流感参考实验室构建,重组AIVH7-Re1 株的HA 和NA 基因来源于H7N9 亚型AIV(PG/SHH/S1069/13)株;重组AIV H7-Re2 株的HA 和NA 基因分别来源于H7N9 亚型AIV CK/GX/SD098/17株和PG/SHH/S1069/13 株,2 株重组病毒的6 个内部基因均来源于高度适应鸡胚的H1N1 亚型A/Puerto Rico/8/34 株(简称为H1N1/PR8)病毒。SPF 鸡胚和SPF 雏鸡由依托中国农业科学院哈尔滨兽医研究所的国家禽类实验动物资源库提供。白油、吐温由哈尔滨维科生物技术有限公司提供。所有涉及H7 亚型AIV 操作的试验均在生物安全三级实验室(ABSL-3)进行。
1.2 重组AIV H7-Re1 株和H7-Re2 株鸡胚内增殖和遗传稳定性测定 取重组AIV H7-Re1 株及其HA基因供体株病毒(PG/SHH/S1069/13 株)、重组病毒H7-Re2 株及其HA 基因供体株病毒(CK/GX/SD098/17株),将4 种病毒分别以104倍稀释后各接种20 枚10日龄SPF 鸡胚,0.1 mL/枚,36 ℃培养至96 h,每间隔24 h 照胚一次,观察鸡胚存活情况,同时收获5枚接种鸡胚进行HA 效价检测。收获的HA 效价最高时的鸡胚尿囊液,按常规方法分别测定两株病毒的鸡胚半数感染量(EID50),分装后于-70 ℃以下保存;同时,根据兽用生物制品菌/毒种研究要求,将收获的H7-Re1 株和H7-Re2 株在鸡胚中连续传代13次后,检测其对鸡胚的致病性、HA 效价和HA 基因裂解位点氨基酸序列。
1.3 重组AIV H7-Re1株和H7-Re2株的致病性试验
1.3.1 静脉内接种致病指数(IVPI)测定 将1.2 中收获的重组AIV H7-Re1 株和H7-Re2 株鸡胚尿囊液(HA 效价为9 log2)分别10 倍稀释后,分别0.1 mL/只静脉内接种6 周龄SPF 鸡10 只,记录接种后10 d 内的临床情况,评定其IVPI。
1.3.2 对雏鸡的致病性试验 取重组AIV H7-Re1 株及亲本H7N9 亚型AIV(PG/SHH/S1069/13 株)、重组AIV H7-Re2 株及亲本H7N9 亚型AIV(CK/GX/SD098/17 株),分别以106.0EID50鼻腔接种5 周龄SPF 鸡,每组10 只,连续14 d 观察各组鸡临床症状;同时于接种后第3 d 和第5 d 采集喉头和泄殖腔拭子,按常规方法检测其排毒情况。
1.4 重组H7N9 亚型AIV H7-Re1 株灭活疫苗的免疫效力试验
1.4.1 针对H7N9 亚型低致病力AIV 的免疫效力攻毒试验 将重组AIV H7-Re1 株按照常规方法制成油乳剂灭活疫苗(制备疫苗前病毒液HA 价为9 log2),以0.3 mL/只的剂量接种3 周龄SPF 鸡10 只,设10 只3 周龄SPF 鸡接种相同剂量的PBS,作为对照组。接种疫苗后第3 周采血,经HI 试验检测血清中针对重组H7N9 亚型AIV H7-Re1 株及攻毒病毒株的HI 抗体效价。免疫后3 周时,用低致病力H7N9 亚型AIV(PG/SHH/S1069/13 株)经鼻腔感染途径进行攻毒,攻毒剂量为每只106EID50/0.1 mL,攻毒后连续观察14 d,并于攻毒后第3 d 和第5 d 采集喉头和泄殖腔拭子,按常规方法检测排毒情况。
1.4.2 针对H7N9 亚型高致病力AIV 的免疫效力试验 按照1.4.1 方法,10 只SPF 鸡接种疫苗后3 周时,将高致病力H7N9 亚型AIV(CK/GX/SD098/17)株以105EID50/0.1 mL/只的剂量经鼻腔感染途径进行攻毒,攻毒后连续观察14 d,并于攻毒后第3 d 和第5 d 采集喉头和泄殖腔拭子,同法进行排毒检测。
1.5 重组H7N9 亚型AIV H7-Re2 株灭活疫苗的免疫效力试验 将重组AIV H7-Re2 株按照常规方法制成油乳剂灭活疫苗(制备疫苗前病毒液HA 价为9 log2),按照1.4.1方法免疫SPF鸡21 d后,以105EID50/0.1 mL/只的剂量,分别利用H7 亚型AIV CK/GX/SD098/17(H7N9)株和DK/FJ/SE0195/18(H7N2)株进行攻毒,参照1.4 进行检测。
1.6 重组AIV H7-Re1 株和H7-Re2 株疫苗免疫后血清与攻毒用病毒株的反应性比较 收集重组AIV H7-Re1 株和H7-Re2 株疫苗免疫后各组鸡血清,分别与攻毒病毒株及相关病毒株进行HI 试验,比较2个疫苗株血清与相关病毒株的反应性。
2 结 果
2.1 2 株重组病毒鸡胚内增殖和遗传稳定性检测结果 重组AIV H7-Re1 株和H7-Re2 株及PG/SHH/S1069/13(H7N9)株接种鸡胚,结果显示,96 h内鸡胚全部存活;CK/GX/SD098/17(H7N9)株接种鸡胚48 h内鸡胚全部死亡。重组AIV H7-Re1株和H7-Re2株接种鸡胚后的HA 效价检测,结果显示,两株病毒接种72 h 后鸡胚尿囊液血凝(HA)效价均达到9 log2,不同时间点两株病毒HA 效价均明显高于HA 基因供体病毒(图1)。测定收获的H7-Re1 株和H7-Re2 株病毒的EID50,结果显示其分别为108.14EID50/0.1 mL 和108.31EID50/0.1 mL。使用SPF 鸡胚将2 株重组病毒各进行13 代次传代,结果显示,各代次病毒接种鸡胚后全部存活,接种72 h 时HA 效价均稳定在9 log2。HA 基因裂解位点氨基酸序列均为-PKGR↓GLF-,符合低致病力H7 亚型AIV HA 基因分子特征。以上结果表明,重组AIV H7-Re1 株和H7-Re2 株在鸡胚中具有良好的生长特性,保持鸡胚无致病力特征,并具有良好的遗传稳定性。
2.2 致病力试验结果
2.2.1 IVPI 测定 2 株重组病毒的IVPI 测定结果显示,接种重组AIV H7-Re1 株和H7-Re2 株的SPF鸡,在10 d 观察期内均无任何不良症状,经计算2株重组病毒的IVPI 值均为0。表明重组AIV H7-Re1株和H7-Re2 株均为低致病力病毒株。
2.2.2 对雏鸡的致病性试验 将4 株病毒以106EID50的剂量鼻腔内接种SPF 鸡后,结果显示,CK/GX/SD098/17(H7N9)株接种组鸡在接种后5 d 内全部发病死亡,重组AIV H7-Re1 株、H7-Re2 株以及PG/SHH/S1069/13(H7N9)株接种组鸡在接种后14 d 内均无临床症状。通过HA 试验检测接种后第3 d 和第5 d 拭子样品,结果显示,PG/SHH/S1069/13(H7N9)和CK/GX/SD098/17(H7N9)接种组鸡所有喉头拭子样品和部分泄殖腔拭子样品中均检测到病毒;而重组AIV H7-Re1 株和H7-Re2 株接种鸡的喉头和泄殖腔样品均未检测到排毒(表1)。上述结果表明,重组病毒H7-Re1 株和H7-Re2 株均对鸡无致病力,而且感染鸡不排毒,具有高度的生物安全性。
2.3 重组AIV H7-Re1 株灭活疫苗的免疫效力试验结果
2.3.1 HI 抗体检测 SPF 鸡接种重组AIV H7-Re1 株灭活疫苗后3 周,进行HI 抗体效价检测。结果显示,2 组疫苗免疫鸡针对H7-Re1 株的HI 平均抗体效价分别为8.5 log2 和8.0 log2,针对攻毒病毒株PG/SHH/S1069/13(H7N9)和CK/GX/SD098/17(H7N9)的HI 平均抗体效价分别为8.2 log2 和7.2 log2;而对照组鸡针对重组AIV H7-Re1 株和攻毒病毒株的HI 抗体均为阴性。表明重组AIV H7-Re1 株灭活疫苗免疫鸡后可诱导良好的HI 抗体效价,具有良好的免疫原性。
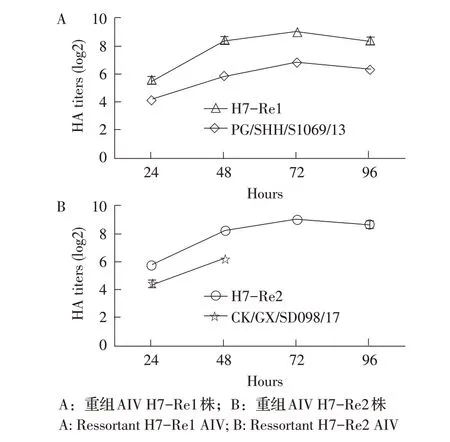
图1 2 株重组H7N9 亚型AIV 接种鸡胚后不同时间收获病毒的HA 效价测定结果Fig.1 HA titers of two ressortant H7N9 AIV harvested at different timepointspost inoculation in SPF eggs
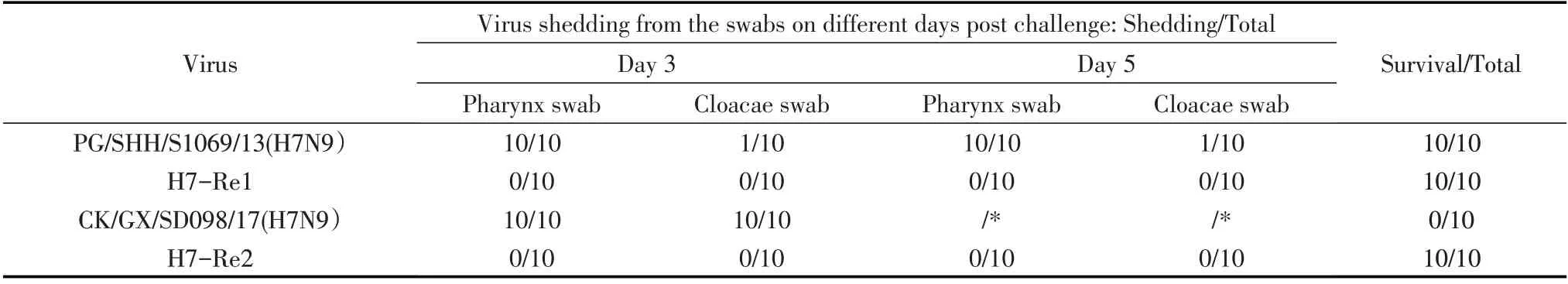
表1 H7N9 亚型AIV 分离株和重组病毒株对SPF 鸡的致病力Table 1 Pathogenicity of H7N9 avian influenza viruses isolates and reassortant strains in SPF chickens
2.3.2 攻毒保护性试验 在14 d 观察期内,观察试验鸡发病死亡情况,并检测其排毒结果。结果显示,攻击PG/SHH/S1069/13(H7N9)株对照组鸡全部存活,但10/10 排毒,攻击CK/GX/SD098/17(H7N9)株的对照组鸡在攻毒后4 d 内全部发病、死亡,喉头拭子和泄殖腔拭子样品病毒分离呈阳性;免疫鸡均全部存活,无任何临床症状,并且攻毒后第3 d和第5 d 喉头及泄殖腔病毒分离均为阴性(表2)。表明重组AIV H7-Re1 株制备的灭活疫苗能够抵御不同致病力H7N9 亚型AIV 的攻击。
2.4 重组AIV H7-Re2 株灭活疫苗免疫效力检测结果
2.4.1 HI 抗体检测 SPF 鸡接种重组AIV H7-Re2 株灭活疫苗后3 周时,进行HI 抗体效价检测。结果显示,2 组疫苗免疫鸡针对重组AIV H7-Re2 株的HI 平均抗体效价分别为8.0 log2 和8.3 log2,针对攻毒用病毒株CK/GX/SD098/17(H7N9)和DK/FJ/SE0195/18(H7N2)的HI 平均抗体效价分别为7.8 log2 和7.5 log2;而对照组鸡针对重组病毒株和攻毒病毒株的HI 抗体均为阴性。表明重组AIV H7-Re2 株疫苗免疫鸡后可诱导良好的HI 抗体效价,具有良好的免疫原性。
2.4.2 攻毒保护性试验 攻击H7 亚型AIV CK/GX/SD098/17(H7N9)株 和DK/FJ/SE0195/18(H7N2)株后,观察试验鸡发病死亡情况,并检测其排毒结果。结果显示14 d 观察期内,2 组对照鸡全部发病、死亡,而2 组疫苗免疫组鸡均无任何临床症状,全部存活。各组鸡免疫后第3 d 和第5 d 喉头拭子和泄殖腔拭子样品检测结果显示,对照组鸡病毒分离均呈阳性,2 组疫苗免疫组鸡病毒分离均为阴性(表3)。表明重组AIV H7-Re2 株制备的灭活疫苗能够抵御H7N9 亚型和H7N2 亚型AIV 的攻击。
表2 重组AIV H7-Re1 株灭活疫苗对2 株H7N9 亚型AIV 的免疫保护性试验Table 2 Protective efficacy of the H7-Re1 inactivated vaccine against two H7N9 AIVs in SPF chickens

表3 重组AIV H7-Re2 株灭活疫苗对H7N9 亚型和H7N2 亚型AIV 的免疫保护性试验Table 3 Protective efficacy of the H7-Re2 inactivated vaccine against H7N9 and H7N2 AIVs in SPF chickens
2.5 重组AIV H7-Re1 株和H7-Re2 株疫苗免疫后血清与攻毒用病毒株的反应性比较结果 采用HI 试验检测重组AIV H7-Re1 株和H7-Re2 株疫苗免疫后血清与攻毒病毒株的反应性,结果显示,重组AIV H7-Re1 和H7-Re2 株免疫后血清用重组病毒株抗原检测HI 抗体效价均为8 log2,2 种血清与PG/SHH/S1069/13(H7N9)株、CK/GX/SD098/17(H7N9)株 和DK/FJ/SE0195/18(H7N2)株均有较好的HI 抗体反应(≥6 log2),而重组AIV H7-Re2 株血清与流行病学监测中分离到的3 株H7 亚型AIV 的HI 抗体反应相对更高(≥7 log2)(表4)。表明H7-Re2 株病毒与2017 年~2018 年分 离的H7 亚 型AIV 抗原性更接 近。

表4 重组AIV 免疫血清与不同H7 亚型AIV 的反应性Table 4 HI cross reaction titers to different H7 AIVs
3 讨 论
理想的禽流感灭活疫苗种毒株应具备高滴度鸡胚适应性、抗原针对性和高度生物安全性。满足这3 个必要条件的种毒才能保证生产的疫苗安全、有效、成本经济。
H1N1/PR8 病毒是高度适应鸡胚的流感病毒,以H1N1/PR8 病毒为内部基因,经反向遗传学构建的疫苗株均具有良好的鸡胚适应性。WHO 推荐的季节性人用流感疫苗株内部基因均来自H1N1/PR8,适合接种鸡胚来生产流感疫苗。H5N1 亚型重组病毒Re-1株是以我国最早分离的高致病力H5N1 亚型AIV(GS/GD/1/96)为HA 和NA 基因供体,并删除HA 裂解位点中决定病毒致病力的多个碱性氨基酸,以H1N1(PR8 株)病毒作为内部基因供体而构建的重组病毒,接种鸡胚后不致死鸡胚,抗原含量高,解决了高致病力AIV 无法作为种毒生产疫苗的技术瓶颈[7]。H5 亚型AIV 在自然界进化为多个HA 分支(0~9),其抗原性也发生了变异。国家禽流感参考实验室根据我国不同时期流行病毒的抗原性,先后研制出H5亚型重组病毒Re-4 株(7.2 分支)、Re-5 株(2.3.4 分支)、Re-6 株(2.3.2 分支)、Re-7 株(7.2 分支变异株)、Re-8 株(2.3.4.4 分支)、Re-10 株(2.3.2.1e 分支)、Re-11 株(2.3.4.4d 分支)、Re-12 株(2.3.2.1d 分支)作为灭活疫苗种毒株,用于预防不同时期危害家禽养殖业的H5亚型AIV。这些疫苗株内部基因均来自H1N1/PR8 病毒,在鸡胚中的HA 效价均≥9 log2。除Re-10 株病毒外,这些疫苗株均已推向生产应用[6]。本研究评估的重组AIV H7-Re1 株和H7-Re2 株的内部基因仍然来自流感病毒H1N1/PR8 株,其接种鸡胚后,HA 效价均达到9 log2,并在鸡胚中稳定遗传,具有良好的鸡胚适应性,适合作为疫苗种毒株,H1N1/PR8 株病毒可作为重组AIV 灭活疫苗种毒的通用内部基因供体株。
生物安全性是禽流感疫苗种毒应具备的另一特质。H7N9 临床分离毒株包括低病致力和高致病力病毒株。自然分离的H7N9 低致病力病毒对鸡胚和雏鸡均无致病性,但其可以在鸡体内复制和在鸡群中有效传播,因此将其作为疫苗株存在散毒风险。本研究结果显示,重组AIV H7-Re1 株和H7-Re2 株对鸡胚和鸡均无致病性,雏鸡感染后无排毒现象。因此,2 株重组病毒均具有良好的生物安全性,适合作为疫苗种毒。
HA 蛋白是AIV 的主要抗原蛋白,含有特定HA基因的疫苗株产生的免疫反应均具有良好的抗原针对性。国家禽流感参考实验室每年均进行全国性的禽流感病原学监测,以充分掌握我国H5、H7 和H9等重要亚型AIV 的流行情况,从分离到的大量病毒株中筛选出优势代表病毒株作为疫苗株的HA 基因供体,进行重组疫苗株的构建。已应用的H5N1 亚型系列重组病毒研制的疫苗对于特定HA 基因供体株所在分支病毒的感染均可提供良好的免疫保护作用[7]。例如,重组AIV H5N1 亚型Re-8 株疫苗可以对H5 亚型2.3.4.4 分支中不同NA 亚型的AIV 感染提供完全免疫保护[8-9]。本研究中的重组AIV H7-Re1株的HA 基因来源于2013 年的低致病力H7N9 亚型AIV(PG/SHH/S1069/13 株),该病毒株制备的疫苗可有效预防低致病力H7N9 亚型AIV 的感染,以该种毒研制的灭活疫苗于2014 年9 月通过农业部新兽药评价,作为储备疫苗。2017 年初,我国出现高致病力H7N9 亚型AIV 后,本研究团队及时对重组AIV H7-Re1 株灭活疫苗进行免疫效力检测,发现该疫苗也可以对高致病力H7N9 亚型AIV 攻击均具有良好的预防效果,以重组AIV H7-Re1 株为种毒研制的重组AIV(H5+H7)二价灭活疫苗(H5N1 Re-8 株+H7N9 H7-Re1 株)于2017 年9 月开始紧急在我国家禽中大规模应用,显著降低了家禽中H7N9 亚型AIV的分离率,并快速阻断了H7N9 亚型AIV 由禽向人的传播[5,10-11]。2017 年,国家禽流感参考实验室又构建出以2017 年分离的高致病力H7N9 亚型AIV(CK/GX/SD098/17)为HA 基因供体的H7-Re2 株疫苗株(HA 裂解位点进行删除修饰)。与重组AIV H7-Re1株相比,该重组病毒与2017 年~2018 年分离到的H7N9、H7N2 病毒具有更好的抗原匹配性,以重组AIV H7-Re2 株为基础研制的重组AIV(H5+H7)三价灭活疫苗(H5N1 Re-11 株+Re-12 株,H7N9 H7-Re2株)替代H7-Re1 株为基础的重组AIV(H5+H7)二价灭活疫苗,于2019 年初开始在我国家禽中广泛应用。这些具有抗原针对性的H7N9 亚型禽流感系列疫苗在家禽中应用至今,我国已超过2 年未再出现人的H7N9 疫情。
本研究对构建的重组AIV H7-Re1 株和H7-Re2株的生物学特性和免疫原性进行了系统研究,表明2 株病毒适合作为我国H7N9 防控的疫苗种毒株,为我国H7N9 亚型禽流感灭活疫苗的研制和应用提供实验依据。
