肠小体感染猪传染性胃肠炎病毒模型的建立
2020-11-10尹灵丹郭珊珊刘平黄
尹灵丹,张 鑫,薛 美,李 亮,郭珊珊,罗 毅,冯 力,刘平黄
(中国农业科学院哈尔滨兽医研究所,黑龙江 哈尔滨 150069)
猪传染性胃肠炎病毒(Transmissible gastroenteri⁃tis virus,TGEV)是一种有囊膜的单股正链RNA 病毒,病毒基因组大小约28.5 kb[1]。TGEV 感染主要引起新生仔猪腹泻,对两周龄以下仔猪的致死率高达100%[2],临床感染主要表现为呕吐,严重腹泻、脱水等急性肠炎症状[3],给养猪业造成了严重的经济损失。
肠上皮是一个复杂的系统,主要由隐窝区和绒毛区两个区域构成,包含多种肠上皮细胞类型(肠细胞、杯状细胞、潘氏细胞、肠内分泌细胞和簇绒细胞)[4],是TGEV 感染的主要部位。目前对TGEV的基础研究主要利用猪睾丸细胞(Swine testicular,ST)、猪肾细胞(Porcine kidney-15 cells,PK-15)和猪空肠上皮细胞(Porcine small intestinal epithelial cell line-jejunum,IPEC-J2)进行。然而,ST 细胞和PK-15 细胞并非来源于猪肠上皮,并不能准确反映肠上皮的生理特性;IPEC-J2 细胞,是一种来自仔猪的非转化空肠上皮细胞系[5],虽具有某些肠上皮的特性,但缺乏肠上皮复杂的空间结构和多样化的细胞类型,因此极大地限制了TGEV 感染与宿主肠上皮之间相互作用的研究。
随着干细胞技术的快速发展,Sato 等建立了能模拟体内肠上皮复杂生理结构的细胞模型—肠小体(Enteroids)[6]。肠小体不仅可在体外长期、稳定的培养,还能形成隐窝-绒毛样区域的结构,并且包含分化成熟的各种肠上皮细胞类型,同时还能保留宿主的遗传特性[7],因此,肠小体比传统的传代细胞更具优势。目前,肠小体已经广泛应用于许多肠道病原的基础研究,比如应用于人的诺如病毒[8],轮状病毒[9],腺病毒[10]等致病机制的研究,并取得了突破性进展。参考Sato 等报道的肠小体培养方法[6],本实验室建立了猪肠小体模型,并应用于猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)的相关研究[11],但猪肠小体是否可以作为TGEV 的感染模型目前尚不清楚。
为探究TGEV 是否可以感染猪肠小体,本研究从2 日龄仔猪的回肠组织分离培养了肠小体,并进行TGEV 感染实验,为TGEV 基础研究提供了一个良好的体外细胞模型,同时为阐明TGEV 与宿主肠上皮之间相互作用的分子机制奠定了基础。
1 材料与方法
1.1 主要实验材料 TGEV AHHF 株(KX499468.1)由本实验室保存。2 日龄SPF 猪购自哈尔滨兽医研究所实验动物中心。本实验中关于动物实验的所有方案均符合哈尔滨兽医研究所动物护理和使用委员会机构批准准则。
细胞培养成分F12 DMEM、胎牛血清(FBS)、0.25%Trypsin-EDTA 购自Gibco 公司;肠小体培养液、温和细胞解离试剂购自Stem cell 公司;基质胶Matri⁃gel®、脱脂乳购自BD Biosciences 公司;牛血清白蛋白(BSA)购自BioFroxx 公司;细胞总RNA 提取试剂盒购自博日公司;反转录试剂盒购自TaKaRa 公司;荧光定量试剂盒购自Roche 公司;DAPI、Triton X-100购自Sigma 公司;TGEV N 蛋白单克隆抗体(MAb)由本实验室制备保存[12];抗Lgr5 抗体购自Novus Biologi⁃cals 公司;抗villin 抗体、mucin2 抗 体、Ki-67 抗体购自Abcam公司;Alexa Fluor 488驴抗兔IgG和Alexa Flu⁃or 546 山羊抗鼠IgG 购自Thermo Fisher Scientific 公司。
1.2 猪3D 肠小体的分离培养及2D 肠小体的培养参考Sato 及本实验室报道的培养方法[6,11],从仔猪的回肠组织分离培养猪3D 回肠小体。当肠小体细胞长至第7 d 分化形成具有隐窝-绒毛样结构的3D 状态后,用0.25% Trypsin-EDTA 消化成单细胞后以50个/孔加入96 孔细胞培养板,37 ℃培养2 d~3 d 即可形成单层的肠小体。
1.3 不同剂量TGEV 感染肠小体的荧光定量PCR(qPCR)检测 当2D 的回肠小体密度长至90%左右时分别采用MOI 1、0.1 和0.01 TGEV 感染细胞,对照组加入等体积的F12 DMEM,37 ℃吸附2 h 后,F12 DMEM 洗涤细胞3 次,然后加入肠小体培养液于37 ℃培养,分别于感染后2 h 和24 h 收集细胞,提取细胞总RNA 并反转录成cDNA,按照本实验室以前报道的qPCR方法检测TGEV的mRNA 转录水平[13]。
1.4 TGEV 感染肠小体的病毒复制曲线测定 当2D的回肠小体密度长至90%左右时利用MOI 1 TGEV 感染细胞,并设立细胞对照,37 ℃吸附2 h 后,用F12 DMEM 洗涤细胞3 次后加入肠小体培养液,分别于感染后2 h、12 h、24 h、36 h 和48 h 收集细胞,同1.3 方法检测TGEV 的mRNA 转录水平。
1.5 TGEV 感染肠小体的间接免疫荧光(IFA)检测 用MOI 1 TGEV 感染2D 的回肠小体,感染24 h后弃掉细胞上清液,经PBS 洗涤细胞3 次后,用4%的多聚甲醛室温固定细胞30 min,经0.2% Triton X-100 通透15 min,5%的脱脂乳在37 ℃封闭2 h 后,用抗TGEV N 蛋白MAb(1 1 000)为一抗,以Alexa Fluor 546 山羊抗鼠IgG(1 500)为二抗,DAPI 染色10 min 后,利用IFA 检测TGEV N 蛋白 的表达[12]。
1.6 TGEV 感染肠上皮细胞类型的双荧光标记IFA检测 为探究TGEV 感染肠上皮细胞的类型,本研究采用MOI 1 TGEV 感染2D 的回肠小体,感染24 h后弃掉细胞上清,经PBS 洗涤细胞3 次后,用4%的多聚甲醛室温固定细胞30 min,经0.2% Triton X-100 通透15 min,5%的脱脂乳37 ℃封闭2 h 后,分别以检测肠细胞的抗villin 多抗(1 100)、检测干细胞的抗Lgr5 多抗(1 50)、检测杯状细胞的抗Mucin2多抗(1 50)、检测增殖细胞的抗Ki-67 多抗(1 600)和检测TGEV N 蛋白的MAb(1 1 000)为一抗,分别以Alexa Fluor 488 驴抗兔IgG(1 1 000)和Alexa Fluor 546 山羊抗鼠IgG(1 500)为二抗,DAPI 染色后利用IFA 检测TGEV 感染的肠上皮细胞类型。
1.7 TGEV 感染肠小体诱导IFN 产生的qPCR 检测 已有研究表明TGEV 感染能够激发天然免疫应答并诱导产生大量的干扰素[14-15]。为探究肠小体是否可作为一个良好的体外模型研究TGEV 感染的天然免疫应答,本研究培养2D 回肠小体密度长至90%左右时分别用MOI 1、0.1 和0.01 TGEV 感染细胞,并设立细胞对照,37 ℃吸附2 h 后,用F12 DMEM 洗涤细胞3次,加入肠小体培养液在37 ℃培养,分别于感染后2 h 和24 h 收集细胞,提取细胞总RNA 并反转录成cDNA,按照本实验室报道的qPCR 方法检测TGEV感染后IFN-β和IFN-L1的mRNA转录水平[11,13]。
1.8 数据统计 所有数据均采用数据均值±标准平均误差(SEM)计算,来自3~4 个独立的平行实验,并且使用GraphPad Prism 7.0 进行分析。统计学意义采用t 检验。*:p<0.05 为 差异显著,**:p<0.01 为差异显著,***:p<0.001,****:p<0.0001为差异极显著。
2 结 果
2.1 猪肠小体的分离与培养 参考Sato 及本实验室报道的肠小体培养方法[6,11],从仔猪的回肠分离肠隐窝干细胞,并在含有基质胶Matrigel 和肠小体培养液中培养,3 d 后观察可见,肠道干细胞增殖并分化,形成具有囊腔样的球状体结构,培养7 d 后,萌芽形成含有隐窝-绒毛样结构的3D 回肠小体(图1)。由于TGEV 感染的肠上皮顶端部分主要位于3D 肠小体内部结构区域,所以3D 的肠小体不适于进行病毒感染实验。有研究表明,解离3D 的鼠肠小体可以铺成2D 肠小体单层细胞,且其具有适当的顶端和基底极性,该结果极大地概括了3D 肠小体和体内肠上皮的许多特性[16]。因此,本研究将3D 肠小体铺成2D 的肠小体单层细胞用于TGEV 感染的研究。
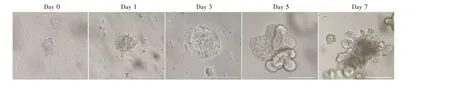
图1 猪肠小体的分离与培养Fig. 1 The isolation and culture of porcine enteroids
2.2 TGEV感染肠小体的病毒复制检测结果 将不同剂量的TGEV 感染2D 回肠小体,在感染后24 h(hpi)收集细胞,通过qPCR 检测病毒的mRNA 转录水平。结果显示,与2 hpi相比,各组24 hpi病毒的mRNA转录水平均显著增加,且呈剂量依赖性(图2A)。
采用MOI 1 TGEV 感染2D 回肠小体检测并绘制病毒复制曲线。qPCR 结果显示,与2 hpi 相比,在12 hpi 病毒的mRNA 转录水平增加了321 倍,在24 hpi 病毒复制达到峰值(图2B)。
将MOI 1 TGEV 感染2D 回肠小体,在24 hpi 通过IFA 检测TGEV N 蛋白的表达情况,结果显示,TGEV 感染回肠小体能检测到较多N 蛋白表达的荧光,与上述mRNA 检测结果相符(图2C)。
以上结果表明,肠小体能够支持TGEV 进行有效地复制。

图2 TGEV 感染肠小体的病毒复制检测结果Fig. 2 Detection of the replication of TGEV in enteroids
2.3 双荧光标记IFA 检测TGEV 感染肠上皮细胞类型的结果 将MOI 1 TGEV 感染2D 回肠小体,在24 hpi 固定细胞,通过双荧光标记IFA 方法检测TGEV 感染肠上皮细胞类型。结果显示,在表达vil⁃lin 的肠细胞检测到TGEV N 蛋白的表达。此外,TGEV N 蛋白与干细胞的标志物Lgr5、杯状细胞的标志物Mucin2 以及增殖细胞的标志物Ki-67 存在共定位现象(图3)。该结果表明TGEV 可感染多种肠上皮细胞类型,包括肠细胞、干细胞和杯状细胞。

图3 双荧光标记IFA 检测TGEV 感染的肠上皮细胞类型Fig.3 Detection of TGEV in intestinal epithelial types by double immunofluorescent labeling
2.4 TGEV 感染肠小体诱导IFN 产生的检测结果用不同剂量的TGEV 感染2D 的回肠小体,在2 hpi 和24 hpi 收集细胞,通过qPCR 检测Ⅰ型IFN(IFN-β)和Ⅲ型IFN(IFN-L1)的mRNA 转录水平。结果显示,在24 hpi TGEV 感染显著上调肠小体中IFN-β 和IFN-L1的mRNA 转录水平,且呈剂量依赖性(图4A 和4B)。该结果表明TGEV 感染肠小体能够诱导宿主产生先天免疫应答,提示肠小体可以作为研究TGEV 感染对宿主先天免疫应答影响的良好细胞模型。
3 讨 论
TGEV 主要感染猪小肠绒毛上皮细胞,目前,用于TGEV 体外研究的细胞模型并不能模拟体内肠上皮复杂的空间结构和多样化的细胞类型,因此并不能准确客观地反映出TGEV 体内感染的发生发展过程。肠小体模型的建立,使在体外培养能重现体内肠上皮生理特性的细胞模型成为现实,弥补了传统细胞模型的不足,为体外研究肠道病原提供了一个全新的平台。
本研究从仔猪的回肠组织分离肠隐窝干细胞来源的肠小体,建立TGEV 的肠小体感染模型。研究结果显示,肠小体能够支持TGEV 进行有效地复制,表明肠小体可作为TGEV 感染的良好体外细胞模型,将有助于深入探究TGEV 的分子生物学特性。肠小体模型包含体内多种肠上皮细胞类型[6,11],利用肠小体这一优势,本研究通过双荧光标记IFA检测发现TGEV 能够感染杯状细胞,这与已有研究报道TGEV 体内感染能以唾液酸依赖的方式与杯状细胞相互作用的现象相符[17],表明肠小体能模拟TGEV 体内感染的情况。Jung 等人研究表明干细胞的数量和增殖可能与PEDV 感染的易感性相关[18],尽管本研究发现TGEV 也能感染大量的干细胞,但这是否能够影响其易感性还需深入探究。同时,本研究发现TGEV 也可以感染肠细胞、增殖细胞等多种肠上皮细胞类型,表明TGEV 感染具有多种细胞嗜性。不同的肠上皮细胞类型具有不同的生理作用[19],TGEV 感染不同的肠上皮细胞类型是否与病毒的致病性相关仍需进一步探究,而肠小体为将来探索这一问题提供了理想的体外模型。

图4 TGEV 感染肠小体对IFN 表达的影响Fig.4 Effect of TGEV in enteroids on IFN expression
此外,本研究发现TGEV 感染肠小体能够显著诱导Ⅰ型IFN(IFN-β)和Ⅲ型IFN(IFN-L1)的产生,表明肠小体在TGEV 感染时能产生抗病毒免疫应答,为将来研究TGEV 感染与宿主天然免疫应答相互作用的分子机制奠定了基础。有研究报道尽管TGEV 感染后能诱导大量内源性IFN 产生,但TGEV 仍能进行有效复制[14-15],提示TGEV 可能利用了一些潜在的机制来逃逸IFN 诱导的抗病毒反应,但IFN 是否能抑制TGEV 在肠小体中的复制仍需进一步的研究。
综上所述,肠小体可作为TGEV 致病机制研究的良好模型,为进一步阐明TGEV 与宿主肠上皮之间相互作用的分子机制奠定了基础。
