基于网络药理学探究三物白散治疗胃癌的机制
2020-11-02楚毓博濮文渊杨青青唐存祥周春祥
楚毓博 濮文渊 杨青青 唐存祥 周春祥∗
(1.南京中医药大学中医学院·中西医结合学院,江苏 南京210000; 2.长兴县中医院, 浙江 湖州313100)
胃癌是我国最常见的消化道恶性肿瘤之一,虽然实施根除幽门螺杆菌等预防措施使得胃癌的发病率和死亡率呈下降趋势[1],但其仍是引起生活负担的重要疾病,因此,早期诊断、明确机制、积极治疗当为重中之重。除了手术及化疗外,中医药的多成分、多靶点、多通路特色使其在胃癌治疗中的价值越来越显著[2]。
三物白散出自《伤寒论》,由巴豆、贝母、桔梗三味中药组成,主治寒实结胸证;现代药理学研究表明巴豆有抗多种肿瘤作用[3],贝母有抗炎、耐缺氧、抗肿瘤、抗溃疡等作用[4],桔梗有抗肿瘤、抗氧化活性、免疫调节等作用[5];本课题组前期致力于其作用机制研究,发现该方能有效抑制胃癌细胞增殖,阻滞胃癌细胞周期以诱导凋亡,下调胃癌细胞释放相关免疫抑制因子,诱导免疫细胞活化增殖,释放相关细胞免疫正相调节因子,拮抗胃癌细胞多药耐药,防止肿瘤的复发转移等[6]。基于本课题组前期研究及相关药理学研究,三物白散抗肿瘤的作用已明确,但具体的分子作用机制仍须深入研究。因此,本文运用网络药理学探讨三物白散治疗胃癌的分子作用机制,以利于之后的系统性研究。
1 方法
1.1 三物白散活性成分及靶标蛋白筛选 利用TCMSP 数据库平 台(http:/ /ibts.hkbu.edu.hk/LSP/tcmsp.php)[7],分别以“巴豆” “贝母” “桔梗” 为关键词检索药物的活性成分及靶标蛋白。口服生物利用度(OB)是药物吸收、分布、代谢、排泄(ADME)中最重要的药动学参数之一,它表示口服药物的有效成分或活性基被吸收到达体循环并被吸收的速度与程度,OB 值越高通常表示药物的生物活性分子的类药性(DL)越好[8]。因此,以OB≥30%、DL≥0.18 的过滤条件筛选出三物白散的活性成分。利用UniProt(https:/ /www.uniprot.org/)数据库查询靶标蛋白对应的基因名。以往的研究表明许多药物活性成分的OB 值是小于30% 的,因此,结合BATMAN⁃TCM 数据库(http:/ /bionet.ncpsb.org/batman⁃tcm/)[9],以P<0.05、Score cutoff≥48 的条件筛选三物白散活性成分。结合文献中虽未纳入以上标准但已报道有显著药理作用的活性成分,将三者结果合并,建立三物白散活性成分⁃靶点数据库。
1.2 构建活性成分⁃靶点网络 将活性成分⁃靶基因导入Cytoscape 软件,构建活性成分⁃靶点网络。
1.3 胃癌靶点及复方⁃疾病靶点的获取 利用GEO 数据库(GSE118916)、OMIM 数据库(https:/ /www.omim.org/)、Genecards 数据库(https:/ /www.genecards.org/),获得胃癌相关靶基因,韦恩图取交集,得到三物白散作用于胃癌的靶基因。
1.4 蛋白相互作用网络(PPI)的构建 将靶基因导入String 网站(https:/ /string⁃db.org/),设置物种为“Homo spanies”,获得PPI 网络图,并利用R 软件获得网络中的关键基因。
1.5 分子对接 配体选择三物白散中巴豆苷、佛波醇、β⁃谷甾醇、贝母乙素、贝母甲素、桔梗皂苷、远志皂苷、桔梗酸等15 个主要成分,受体选择上一步得到的前30 个关键靶点中有较多实验研究基础的12 个靶点,进行分子对接。所有受体由PDB 官网下载,所有的配体小分子由chemdraw 及chem3d 产生。首先对受体进行预处理,包括氨基酸残基的修复、加氢加电荷、选择力场、删除不必要的水分子以及能量最小化,然后对配体进行能量最小化处理,选择基于配体⁃受体结合能力的打分函数ASE 进行评估,得到每个化合物与受体的对接打分值,对接打分值越小,配体与受体的结合越牢固。
1.6 靶基因的GO、KEGG 通路、蛋白互作网络及模块分析 将靶基因导入Metascape 在线分析工具(http:/ /metascape.org/gp/index.html#/main/step1),设置物种为人,进行GO、KEGG 分析、蛋白互作网络及模块分析,保存分析结果。
2 结果
2.1 三物白散活性成分及活性成分⁃靶点网络 经TCMSP、BATMAN⁃TCM 结合文献中已报道具有明确药理活性的药物,筛选并去除重复值后,获得三物白散活性成分46 个(表1),其中巴豆14 个,主要包括巴豆苷、巴豆酸、佛波醇及酯类等;桔梗21 个,主要包括桔梗皂苷、远志皂苷、桔梗酸、远志酸等;贝母14 个,主要包括贝母甲素、贝母乙素、贝母新碱、浙贝素等。巴豆中的佛波醇、12⁃O⁃癸基佛波醇⁃13⁃(2⁃甲基丁酸酯)虽未入选标准,但大量研究表明其具有明显的药理活性,因此被纳入候选成分,桔梗中的远志酸,桔梗酸A、B、C,槲皮素⁃7⁃O⁃葡萄糖苷,槲皮素⁃7⁃O⁃芸香糖苷,五没食子酰葡萄糖,槲皮素⁃7⁃O⁃葡萄糖苷,槲皮素⁃7⁃O⁃芸香糖苷易被氧化成槲皮素,五没食子酰葡萄糖易被氧化成没食子酸;浙贝母中的贝母甲素、贝母乙素也被纳入候选成分。相关靶点387 个(去重前454个),其中巴豆194 个,贝母128 个,桔梗132 个(三药合并去重后387 个)。将上述成分、靶点导入Cytoscape3.7.1软件构建活性成分⁃靶点网络图(图1),共有433 个节点,46 个红色节点为活性成分,387 个绿色节点为靶点,667条边代表活性成分对靶点的作用,体现了三物白散多成分、多靶点的特点。
2.2 胃癌靶点及复方⁃疾病靶点 多疾病靶点数据库筛选获得胃癌相关靶基因9 536 个,与387 个药物靶基因取交集,共得三物白散作用于胃癌的靶基因289 个(图2)。
2.3 PPI 网络及Hub 基因 将289 个靶基因导入String 网站,置信度设置为大于0.4,结果如图3,共289 个节点,3 761 条边,说明靶基因之间互作关系密切。将.tsv 文件保存,利用R 软件获取网络中的关键基因,绘制度值最大的前30 个靶点的柱状图(图4,横坐标代表基因的度值),这些基因在三物白散发挥作用过程中起着核心作用,保存结果以用于后续的分子对接分析。
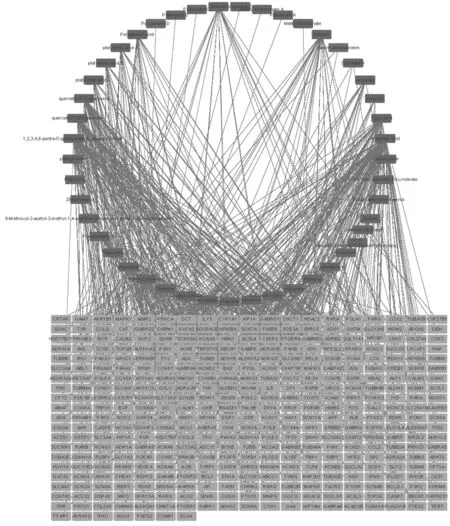
图1 活性成分⁃靶点网络
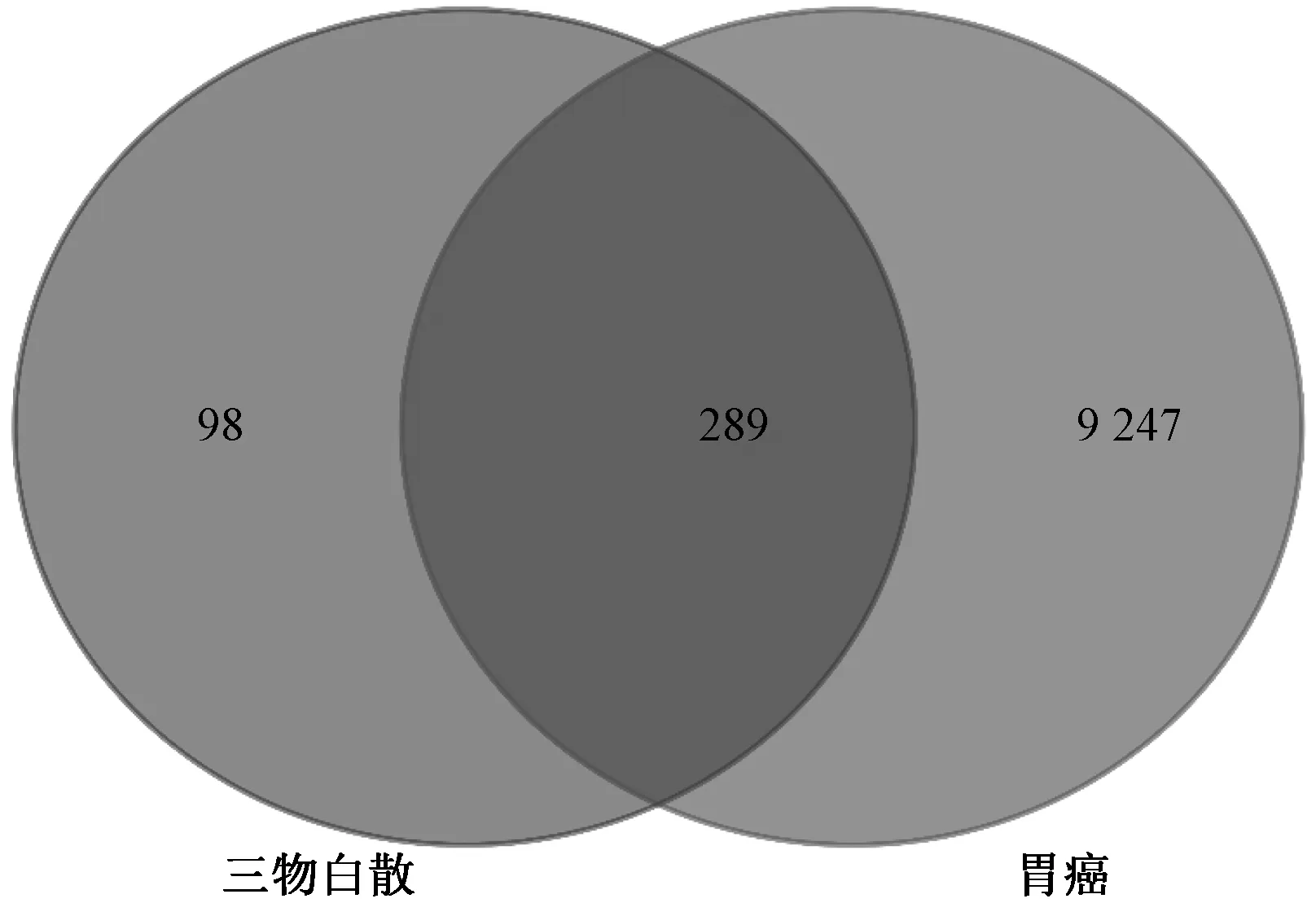
图2 三物白散作用于胃癌的靶基因

图3 蛋白互作网络

表1 三物白散活性成分信息
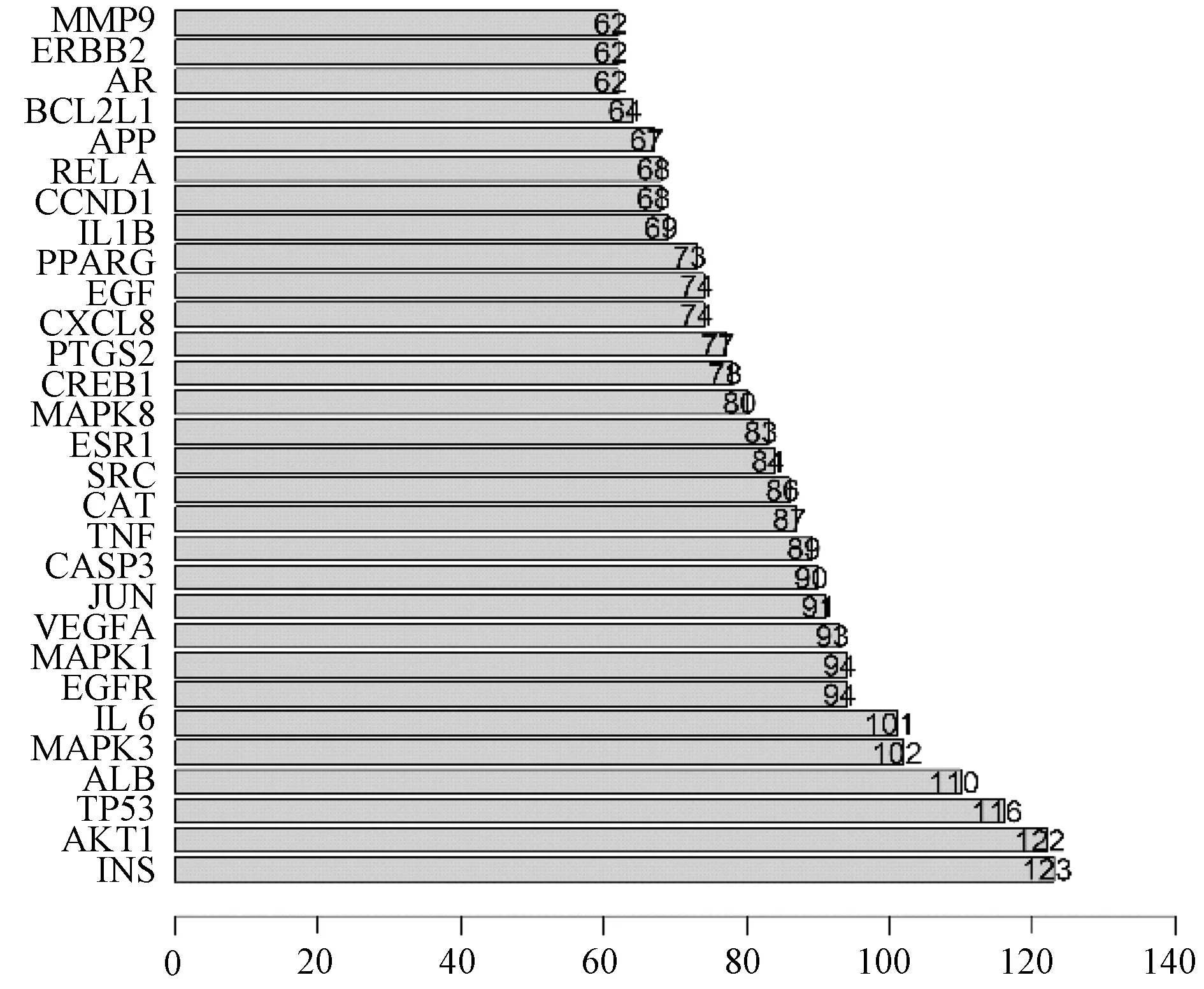
图4 关键基因
2.4 分子对接 分子对接结果打分值越小,配体与受体的结合越牢固。由表2 数据可以看出,三物白散主要成分与关键靶点的结合程度均较好,其中TNF、PPARG、CASP3、VEGFA、MMP9 的结合程度最为牢固,为后续的网络分析奠定了基础。
2.5 靶基因GO、KEGG 通路分析 靶基因GO、KEGG 通路分析结果如图5。GO 分析结果(图5A)表明激素水平调节、血液循环的调节、脂质代谢调节、对脂多糖、有毒物质、酸性化学物质、氮化合物等的反应、细胞凋亡等过程均在三物白散治疗胃癌的过程中发挥着重要的作用;KEGG 通路分析结果(图5B)表明癌症通路、凋亡、TNF信号通路、铂耐药、脂肪细胞因子信号通路、HIF⁃1 信号通路、PPAR 信号通路、cAMP 信号通路、JAK⁃STAT 信号通路、自噬等均在三物白散治疗胃癌的过程中发挥重要作用,其中,富集最为显著的是癌症通路(表3、图6)。上述结果表明三物白散活性成分靶点分布于不同的生物过程和通路,可干预不同的过程及通路协调发挥作用,体现了中药复方多成分、多靶点、多途径的作用特点。
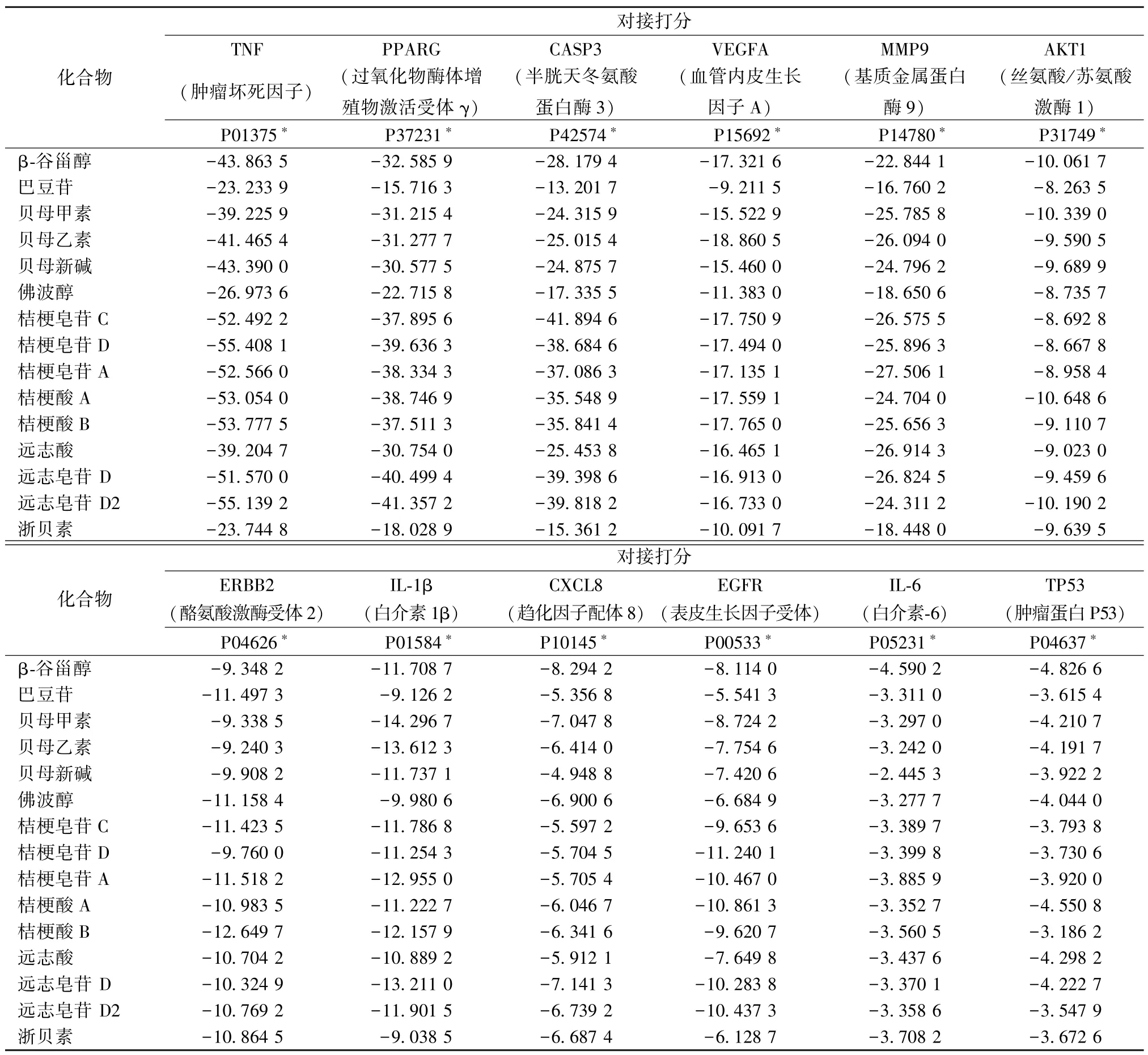
表2 分子对接结果

图5 GO、KEGG 通路分析

表3 KEGG 通路富集信息

图6 癌症通路
2.6 靶基因蛋白互作及模块分析 Metascape[10]中的蛋白互作及模块分析结果见图7。该网络通过BioGrid6,InWeb_ IM7,OmniPath8 数据库的蛋白互作富集分析所得,网络包含与靶基因列表中至少一个其他成员形成物理相互作用的蛋白质子集,如果网络包含3~500 种蛋白质,则应用MCODE 算法9 来识别密集连接的网络组件。为靶基因列表确定的MCODE 网络共涉及8 个模块,这些模块中的基因可能在三物白散治疗中发挥更重要的作用。

图7 蛋白互作及模块分析可视化
模块1 主要与细胞对有机环状化合物的反应有关,涉及通路包括癌症通路、铂耐药;模块2 主要与腺苷酸环化酶调节性G 蛋白偶联受体有关,涉及通路包括神经活性配体⁃受体相互作用、cGMP⁃PKG 信号通路、钙信号通路;模块3 主要与细胞骨架的结构成分、氧化还原酶活性、醛脱氢酶(NAD)活性有关,涉及通路包括、间隙连接、吞噬体;模块5 主要与组蛋白脱乙酰基酶结合、染色质结合有关,涉及通路包括内分泌抵抗、癌症相关通路有关;模块6主要与腺苷酸环化酶激活G 蛋白偶联受体信号通路、cAMP介导的信号传导、环核苷酸介导的信号传导有关,涉及神经活性配体⁃受体相互作用等过程;模块7 主要与延迟的整流钾通道活动、电压门控钾通道复合物、电压门控钾通道活性有关;模块8 主要与醇脱氢酶活性,锌依赖性、酒精脱氢酶(NAD)活性、乙醇氧化有关,涉及酪氨酸代谢、脂肪酸降解、视黄醇代谢等过程。已有研究表明挥发性有机化合物[11]可导致组织内强烈的氧化应激反应,与正常组织相比,胃癌组织中的含量明显失调,氧化反应使体内各种自由基活性增加、细胞免疫力下降、细胞间隙联接交通受阻;G 蛋白偶联受体[12]与胃癌的发展、侵袭与转移等多种恶性生物学过程密切相关;组蛋白异常乙酰化[13]促进胃癌的发展,其抑制剂可在体外抑制癌细胞的生长、分化等;现有研究[14]证明胃癌细胞膜上确实存在延迟整流钾离子通道,并通过影响细胞膜电压、改变细胞体积等方式影响着肿瘤细胞的增殖和周期。cGMP⁃PKG 信号通路、钙信号通路、cAMP 信号通路等均为胃癌研究的明星通路,且cGMP⁃PKG 信号通路与铂耐药、内分泌抵抗均参与胃癌的多药耐药过程,提示三物白散在胃癌多药耐药的过程中可能发挥了重要的作用。
3 讨论
胃癌治疗对于放、化疗方法存在较强的耐药性和副作用,在给患者带来重大生活负担和精神折磨的同时,生存率并没有得到显著性提高[15]。中医药治疗胃癌已有上千年的历史,其多成分、多靶点的特色在胃癌治疗中的地位越来越显著,但是中医药治疗胃癌的具体机制尚有很多不明之处,长期运用配伍相似或相同的处方,极有可能出现中药耐药的现象[16]。因此,明确中药治疗胃癌的具体机制,既可达到精准医疗的要求以提高临床疗效,又可尽可能避免中药耐药现象,是为当前研究中医药治疗肿瘤的重中之重。
三物白散是《伤寒论》 温下逐邪之代表方,用于治疗寒实结胸证。伤寒大家陈亦人教授运用该方加味方康尔爱片治疗中晚期胃癌多例,效果显著。相关临床报道表明三物白散加味用于治疗肺癌并发胸水[17]。朱怀平等[18]运用三物白散加味方治疗进展期胃癌,结果表明其可提高瘤体稳定率,降低恶化率,提高患者生活质量。赵志英等[19]研究发现三物白散抑制肿瘤细胞分泌免疫抑制因子,改善机体免疫功能。徐力等[20]研究发现三物白散加味方通过影响细胞周期以影响细胞增殖。凌云等[21]研究发现三物白散可逆转胃癌耐药细胞株SGC7901 /DDP 多药耐药,其作用机制可能是通过抑制P⁃gp 功能而实现的。大量的临床及基础研究奠定了该方治疗癌症的地位。
通过网络药理学分析得出三物白散活性成分46 个,包括β⁃谷甾醇、巴豆苷、巴豆酸、花生四烯酸、刺槐素、木犀草素、桔梗皂苷、远志皂苷、桔梗酸、远志酸桦木醇、贝母甲素、贝母乙素、鬼臼毒素等。其中β⁃谷甾醇具有抗炎、抑制肿瘤、免疫调节、抗氧化等作用[22⁃24]。巴豆苷可抑制癌细胞生长且促进其凋亡,相关研究[25]表明其可抑制MV4⁃11 细胞内HDACs 信号通路和FLT3 信号通路的相关蛋白表达,从而产生抗白血病作用。巴豆酸和花生四烯酸属于不饱和脂肪酸,相关研究[26]指出其可抑制癌细胞增殖,同时促进凋亡。刺槐素能靶向RARγ,通过RARγ 调控P53⁃AKT 信号通路发挥抗肿瘤作用[27],亦可抑制p⁃NF⁃κB、下调COX⁃2 表达,继而上调促凋亡蛋白Bax 表达、下调抗凋亡蛋白Bcl⁃2 表达促进细胞凋亡[28]。木犀草素可抑制自噬以强化细胞对顺铂的敏感性[29]。桔梗皂苷具有祛痰、抗炎、抗氧化活性、抗肿瘤等[5]作用。远志皂苷可通过调节Caspase 家族因子活性诱导A549 细胞凋亡。桦木醇可诱导Caspase⁃3、Caspase⁃9 参与细胞凋亡[30]。贝母甲素、贝母乙素和鬼臼毒素均可发挥抗肿瘤作用,贝母甲素下调L⁃RP 蛋白(肺耐药相关蛋白)表达、抑制ERCC1mRNA 表达,逆转肿瘤多药耐药,贝母乙素主要与自噬、上皮间质转化相关[31⁃32]。综上,三物白散的活性成分在抗炎、抗肿瘤、免疫调节等方面均可发挥一定的作用,为其治疗癌症提供了物质基础。
基因富集结果表明三物白散治疗胃癌涉及激素水平调节、血循环的调节、脂质代谢、酶活性、自噬等过程,富集的通路主要集中在癌症、凋亡、缺氧、代谢与炎症相关通路。肿瘤微环境具有局部组织缺氧、免疫炎性反应等特点。缺氧微环境[33⁃34]可导致肿瘤的增殖、血管生成、转移及耐药性。HIF⁃1α 是缺氧诱导因子,在缺氧环境下表达上调,进而上调MMP⁃2、MMP⁃9 的表达,促进肿瘤血管生成;同时,HIF⁃1α 的异常表达调控免疫相关细胞向免疫抑制表型转化,促进肿瘤的免疫逃逸。三物白散作用于该通路的靶点有19 个(P<0.05),提示其可能通过该通路调控免疫细胞表型,发挥免疫调节作用。炎性微环境存在大量的炎性介质,可引起细胞基因突变,促进肿瘤发展与转移。TNF 信号通路与细胞增殖、炎症与免疫反应有关,激活后,可进一步激活NF⁃κB 信号通路和MAPK 信号通路,促进炎症因子TNF、IL⁃6 等的释放,炎症因子的释放又可促进炎症通路的激活,形成恶性循环[35]。本研究表明三物白散富集在该通路的靶点有23 个(P<0.05),说明其可能通过相关富集靶点调控TNF 通路以抑制炎症因子释放,从而抗肿瘤。代谢重塑在肿瘤发生中发挥重要作用,发生重塑的代谢物主要是糖、脂质、氨基酸等。脂肪细胞因子对代谢的影响主要是介导炎症、细胞增殖和血管生成,其可直接进入血循环影响癌症[36]。PPARs 为细胞内过氧化物酶体增殖物激活受体,在调节炎症反应、糖、脂代谢中均发挥重要作用。其亚型PPARα 可绑定Glut1 基因启动子区域直接抑制其转录,从而减少葡萄糖的摄取,最后,抑制mTOR 信号通路及肿瘤生长[37]。PPARγ 配体可抑制巨噬细胞炎症反应,抑制活化T 细胞的增殖,调控细胞分化周期,从而发挥调控炎症和免疫反应平衡、抑制肿瘤的作用[38]。PPARδ可通过降低氧化应激反应,增强生存信号(p⁃AKT)以延长癌细胞的生存率[39]。三物白散作用于胃癌的靶点富集在PPAR 通路上的主要有PPARδ、PPARγ 及相关配体,这提示三物白散可能通过调节该信号通路以调节炎症、糖脂代谢,从而发挥治疗胃癌的作用。
综上所述,三物白散可能作用于缺氧、炎症、代谢相关因子、通路,调控缺氧状态,抑制炎症反应,调节代谢过程,改善肿瘤微环境,抑制细胞增殖与血管生成,促进细胞凋亡,从而发挥治疗胃癌的作用,这为深入探讨三物白散治疗胃癌的作用机制提供了新的方向。
