芍药苷对氯化钴诱导PC12 细胞氧化应激损伤的保护作用
2020-11-02韵张秀丽孟盼邹蔓姝王宇红凌成利
雷 昌 黄 丹 向 韵张秀丽孟 盼邹蔓姝王宇红凌成利∗
(1.湖南中医药大学, 湖南省中药粉体与创新药物省部共建国家重点实验室培育基地, 湖南 长沙410208;2.湖南中医药大学科技创新中心, 湖南 长沙410208)
芍药苷来源于毛莨科种属,是从白芍和赤芍干燥根提取的主要活性成分,为一种单萜糖苷类化合物,具有抗氧化应激损伤、抗血栓、抗炎、抗高血压、镇痛、抗血小板聚集等作用[1⁃2]。有文献表明芍药苷对大鼠缺血性脑卒中引起的细胞氧化应激损伤有显著疗效,可通过Ca2+/CaMKⅡ/CREB 信号通路降低炎症因子表达[3],同时也有文献阐述了芍药苷能降低血液黏度、抗血小板聚集、扩张血管、改善微循环、抗氧化、抗惊厥等多种作用效果[4⁃5],故芍药苷在动物体内对不同病理条件诱导的神经细胞损伤有保护作用。温新丽等[6]揭示了芍药苷对过氧化氢诱导的SH⁃SY5Y 细胞氧化应激损伤有显著保护效果,但具体机制不明。因此,本研究在PC12 细胞存活率基础上,从活性氧自由基(ROS)、细胞凋亡、MMP 不同机制考察芍药苷对CoCl2诱导高PC12 细胞氧化损伤的保护作用,为后续进一步研发作铺垫。
1 材料
1.1 药物与试剂 芍药苷(纯度≥98%,批号17041401)购自成都普飞德生物科技有限公司。氯化钴(Cobalt chloride,CoCl2· 6H2O,批 号20180724)、ROS 试剂盒(DCFH⁃DA,编 号S0033)、细胞凋亡试剂盒(批号100918190307)、线粒体膜电位试剂盒(批号101118190416)均购自上海碧云天生物技术有限公司;二甲基亚砜(DMSO,批号20130417)购自湖南汇虹试剂有限公司;MTT [3⁃(4,5⁃二甲基噻唑⁃2)⁃2,5⁃二苯基四氮唑溴盐,批号1015D0510]购自北京索莱宝科技有限公司;改良高糖细胞培养基(DMEM)和胎牛血清(FBS)均购自四季青生物工程材料有限公司(杭州);其他试剂均购自国药集团化学试剂有限公司。
1.2 仪器 CO2培养箱(型号3131)、多功能酶标仪(型号3001⁃1758)均购自美国赛默飞世尔科技有限公司(上海);高内涵成像分析系统(型号operetta)购自美国珀金埃尔默股份有限公司。
2 方法
2.1 PC12 细胞培养 PC12 细胞购自中国科学院细胞库,采用含10% 胎牛血清(FBS)的DMEM培养基,置于5% CO2、37 ℃培养箱中进行培养。以1 ∶2 或1 ∶3 比例进行细胞传代,向培养皿中加入0.25% Trypsin⁃EDTA 1.5 mL,消化约1 min 后在显微镜下观察,发现PC12 细胞回缩、类圆形,开始脱落,立即加入2 mL 培养基终止消化,选择对数生长期细胞进行实验。在药物处理阶段,各组(包括正常组)细胞均用不含FBS 的DMEM 培养基培养。
2.2 MTT 检测
2.2.1 不同浓度CoCl2、芍药苷对PC12 细胞存活率的影响 将对数生长的PC12 细胞以3×103/孔的浓度接种于96 孔板上,每孔0.1 mL,置于培养箱中培养12 h,待贴壁后分别采用CoCl2(0.1、0.2、0.4、0.6、0.8、1.0、1.2、1.5、2.0、3.0 mmol/L)和芍药苷(10、100、200、300、400、500、600、700、800 μg/mL)孵育24 h,每孔加入0.5 mg/mL MTT 20 μL,37 ℃避光孵育4 h 后吸弃上清液,加200 μL DMSO,避光振摇10 min 使其充分溶解,在570 nm 波长处测定光密度(OD),细胞存活率= [(OD药物组-OD空白组)/(OD正常组-OD空白组)]×100%,平行6 个复孔。
2.2.2 芍药苷对CoCl2诱导的PC12 细胞存活率的影响 细胞分为正常组(正常PC12 细胞)、模型组(1.2 mmol/L CoCl2诱导PC12 细胞24 h)、芍药苷组(不同浓度芍药苷预先处理1 h,再加入1.2 mmol/L CoCl2共孵育24 h),按“2.2.1” 项下方法检测各组细胞存活率。
2.3 ROS 检测 根据ROS 试剂盒测定细胞内ROS水平,荧光探针DCFH⁃DA 按1 ∶1 000 比例用无血清培养基稀释至终浓度为10 μmol/L。按“2.2.2”项下方法分组接种于96 孔板内,培养24 h 后,将培养液换成已稀释好的DCFH⁃DA 探针溶液0.1 mL,37 ℃避光孵育30 min。PBS 洗涤2 次去除未进细胞内的荧光探针,采用高内涵成像分析系统检测平均荧光强度(激发波长488 nm,发射波长525 nm),各组随机选取6 个视野,平行3 个复孔。
2.4 细胞凋亡测定 利用Annexin V⁃FITC/PI 双染色法凋亡试剂盒检测PC12 细胞凋亡,按“2.2.2”项下方法分组接种于96 孔板内,以凋亡试剂盒操作步骤进行实验,采用高内涵成像分析系统在488、525 nm 波长下检测平均荧光强度。各组随机选取6 个视野,计数细胞总数和凋亡细胞数,平行3 个复孔,计算凋亡率[(同一视野下凋亡细胞数/同一视野下总细胞数)×100%]。
2.5 MMP 测定 取对数生长期PC12 细胞,按“2.2.2” 项下方法分组,按MMP 试剂盒说明书进行操作。高内涵成像系统检测细胞平均荧光强度(激发波长490 nm,发射波长530 nm),各组随机选取6 个视野,平行3 个复孔。
2.6 统计学分析 通过Graphpad Prsim 软件进行处理,数据以()表示,2 组间比较采用独立样本t检验,多组间比较采用单因素方差。以P<0.05 为差异具有统计学意义。
3 结果
3.1 不同浓度CoCl2对PC12 细胞存活率的影响0.1、0.2、0.4、0.6、0.8、1.0、1.2、1.5、2.0、3.0 mmol/L CoCl2对应细胞存活率分别为(92.9±5.7)%、(87.9±2.3)%、(82.1±4.5)%、(73.5±2.3)%、(66.3±4.8)%、(52.1±4.5)%、(47.3±5.0)%、(43.0±3.9)%、(40.1±4.6)%、(24.2±5.6)%。图1A 表明,与正常组(100%±3.2)%相比,CoCl2(0.6~3.0 mmol/L)可降低PC12 细胞存活率,减少细胞活性,其浓度为1.2 mmol/L 时,细胞存活率接近50%(P<0.05),即为半数抑制浓度(IC50)。因此,采用1.2 mmol/L CoCl2诱导PC12 细胞24 h,作为PC12 细胞氧化应激损伤的最佳条件。

图1 芍药苷对CoCl2 诱导PC12 细胞存活率的影响Fig.1 Effect of paeoniflorin on the survival rate of CoCl2⁃induced PC12 cells
3.2 不同浓度芍药苷对PC12 细胞存活率的影响由图1B 可 知,10、100、200、300、400、500、600、700、800 μg/mL 芍药苷处理PC12 细胞24 h,细胞存活率分别为(100.3±2.3)%、(99.7±3.6)%、(99.1±3.4)%、(97.9±2.8)%、(89.3±2.4)%、(83.5±3.5)%、(74.2±2.3)%、(59.6±2.6)%、(52.0±3.0)%,其浓度在600 μg/mL 以上时对PC12 细胞有强烈毒副作用,在400、500 μg/mL时可降低细胞存活率(P<0.05),有轻微毒性,故芍药苷毒性浓度应在400 μg/mL 以下。
3.3 不同浓度芍药苷对CoCl2诱导PC12 细胞存活率的影响 如图1C 所示,与模型组比较,100、200、300 μg/mL 芍药苷对CoCl2诱导的PC12 细胞存活率分别为(54.9±3.1)%、(63.0±2.7)%、(59.1±2.3)%,其浓度在10~500 μg/mL 范围内未呈浓度依赖性,而在200 μg/mL 时可增加CoCl2诱导的PC12 细胞存活率(P<0.05)。由此表明,200 μg/mL芍药苷对CoCl2诱导PC12 细胞所引起的氧化应激损伤有显著保护作用。
3.4 芍药苷对CoCl2诱导PC12 细胞内ROS 的影响 如图2 所示,与正常组(11.0±2.0)比较,模型组PC12 细胞内平均荧光值增加(52.0±2.1,P<0.05),表明细胞内ROS 增加;与模型组比较,200 μg/mL 芍药苷组PC12 细胞内平均荧光值降低(25.4±2.5,P<0.05),表明芍药苷可明显抑制CoCl2诱导PC12 细胞内ROS 的生成。
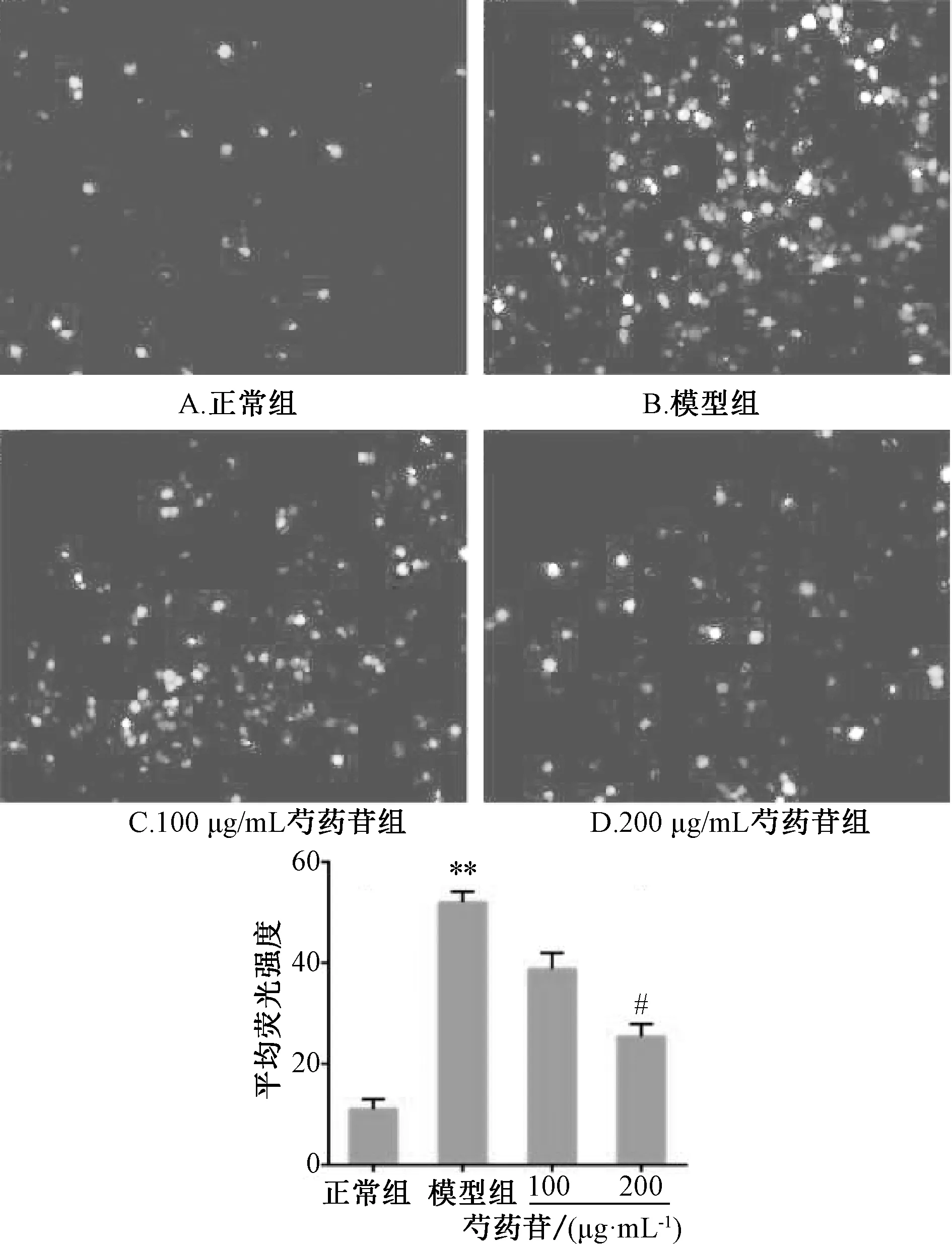
图2 芍药苷对CoCl2 诱导PC12 细胞生成ROS 的影响Fig.2 Effect of paeoniflorin on the ROS production of CoCl2⁃induced PC12 cells
3.5 芍药苷对CoCl2诱导PC12 细胞凋亡的影响 如图3 所示,正常组PC12 细胞早期和晚期凋亡分布有低强度绿色和红色荧光(绿色荧光代表凋亡早期,红色代表凋亡晚期和死亡细胞);经CoCl2诱导后,模型组出现高强度绿色和红色荧光,且胞核变小,浓缩,呈细胞凋亡的形态特征;加入芍药苷预处理后,绿色、红色荧光强度降低,细胞核逐渐恢复正常形态。与正常组[活细胞比例(93.2±2.6)%,凋亡细胞比例(6.8±1.7)%]比较,模型组活细胞比例[(20.3±3.0)%]降低,细胞凋亡比例[(79.7±2.8)%]增加(P<0.05),其中200 μg/mL 芍药苷组活细胞比例为(57.4±2.4)%,细胞凋亡比例为(42.6±3.3)%,与模型组比较差异具有统计学意义(P<0.05)。
3.6 芍药苷对CoCl2所诱导PC12 细胞MMP 的影响 如图4 所示,与正常组比较(平均荧光值为237.6±10.3),模型组PC12 细胞绿色平均荧光值为39.8±11.2,荧光强度降低(P<0.05),即线粒体膜电位下降。200 μg/mL 芍药苷组PC12 细胞绿色平均荧光值为221.7±9.5,荧光强度升高(P<0.01),说明芍药苷能提升MMP,保护PC12 细胞免受CoCl2诱导所致的损伤。
4 讨论
脑缺血病理机制主要包括能量代谢障碍与梗死灶周围缺氧去极化、兴奋性氨基酸(EAA)毒性、氧化应激损伤、炎症反应等[7],其中氧化应激损伤是其主要机制之一。氧化应激损伤(oxidative stress)是指有机体在遭受各种有害刺激或诱导时,细胞内产生的ROS 超过自身清除的ROS,导致ROS 细胞内蓄积及细胞凋亡与MMP 变化,细胞引发毒性损伤的过程[8]。目前大量研究认为,ROS、细胞凋亡及MMP 变化是氧化应激损伤的主要指标。
CoCl2是一种化学性氧化应激诱导模拟剂,可引起神经细胞氧化应激损伤和凋亡,其机制是钴通过细胞内离子置换使亚铁螯合酶失活,从而抑制细胞对氧的利用,最终达到常氧下诱导细胞缺氧导致氧化应激的效果[9],由于使用方便、理化性质稳定而成为诱导神经细胞氧化应激损伤的首选药物,但在体外细胞上研究较少。课题组首次采用CoCl2诱导PC12 细胞模型模拟神经细胞氧化应激损伤而出现的脑缺血病理状态,具有效果理想、可重复性好及操作简便的优势。

图3 芍药苷对CoCl2 诱导PC12 细胞凋亡的影响Fig.3 Effect of paeoniflorin on the apoptosis of CoCl2⁃induced PC12 cells
近年来,芍药苷在细胞损伤方面的作用受到越来越多的关注。芍药苷在白芍单萜类成分中含有量最高,也是最有效成分[10],具有抗神经细胞氧化、抗自由基损伤、抑制细胞内钙超载,抗细胞凋亡、促进神经生长等作用[11]。有文献研究发现,芍药苷通过NO(硝普钠)诱导PC12 细胞可直接发挥抗细胞凋亡作用[12]。理论上,芍药苷具有抗细胞氧化应激损伤作用,本实验结果表明,在CoCl2诱导PC12 细胞损伤模型中,100、200 μg/mL 芍药苷可清除细胞内ROS 产生、减少细胞凋亡和提高MMP,但 200 μg/mL 的细胞 保护作 用大于100 μg/mL,其原因可能是促线粒体凋亡蛋白的表达程度不同。Wang 等[13]研究发现,神经细胞损伤与凋亡蛋白的表达有关,凋亡相关基因表达促进p38 MAPK 磷酸化程度,加剧细胞凋亡损伤。除了线粒体凋亡通路之外,核因子转录蛋白(NF⁃κB)信号通路和促分裂素原活化蛋白激酶(MAPK)信号通路也在脑缺血神经细胞损伤中发挥着重要的作用[14⁃15],是否参与了芍药苷的神经保护机制有待于今后进一步的研究。
