基于非酒精性脂肪肝体外细胞模型对藏药 “松蒂” 基原植物中6 个多酚类化合物的活性评价
2020-11-02阿都莫子力魏荣锐秦伟瀚冯海青朱继孝万鑫浩金重先蒋钟国跃
阿都莫子力 魏荣锐 秦伟瀚 冯海青 任 刚 朱继孝 万鑫浩 金重先蒋 伟∗ 钟国跃∗
(1.江西中医药大学中药资源与民族药研究中心, 江西 南昌330004; 2.重庆市中药研究院, 重庆400065; 3.荆州市食品药品检验所, 湖北 荆州434000)
“松蒂” 是藏医临床用于治疗肝胆疾病的一类常用药材,其基原植物主要为多种藏区虎耳草属植物[1],具有清肝胆之热、排脓敛疮之效,多用于肝炎、胆囊炎等[2]。高原民族喜吃牛羊肉、糌粑、酥油茶、甜茶等高热量食物,较少食用蔬菜瓜果等膳食纤维,这种高脂、高糖、高蛋白、低膳食纤维的饮食结构以及经济生活水平提高带来的体力活动减少使藏族人群中脂肪肝患者比例较高[3⁃4],并呈逐年上升趋势。在藏医临床上,“松蒂” 类药材常作为组方药物用于治疗脂肪肝,如治疗肝胆类疾病的首选藏药二十五味松石丸[5⁃6]。
非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)是指无过量饮酒史,肝细胞发生脂肪病变,形成脂质堆积的一种临床病理综合征,发病趋势主要从单纯性脂肪病变、脂肪性肝炎、肝纤维化最终衍变为肝细胞癌[7]。目前,对NAFLD的研究通常采用的是动物模型,但存在个体差异大、研究周期长、实验条件不易控制等问题,而细胞模型很好地克服上述问题,同时能够有效缩短实验进程,适用于批量药物的筛选[8]。前期对“松蒂” 基原植物的药理研究表明,其提取物对动物或细胞化学性肝损伤具有一定的抵抗作用[9⁃10],另外相关化学文献显示其含有大量的黄酮类、酚酸类、二苯庚烷类等多酚类成分,而且抗各种类型肝损伤的研究报道较多。本实验复制了NAFLD 体外LO2 细胞模型模拟体内脂质堆积,然后给予单体成分对模型细胞进行干预,研究从“松蒂” 基原植物中发现的6 个多酚类成分对细胞内脂质形成的影响,从而探讨该类药材在治疗NAFLD 方面的药效成分基础及可能作用机制。
1 材料
1.1 细胞株 LO2 细胞株购自武汉普诺赛(Procell)生命科技有限公司,保存于江西中医药大学中药资源与民族药研究中心实验室。
1.2 试剂与药物 对照品芦丁(批号10000⁃201408)、金丝桃苷(批号11521⁃201205)、没食子酸(批号 110831⁃200803)、山柰酚(批 号110861⁃201310)均购自中国食品药品检定研究院;异槲皮苷(批号1330⁃101226)购自江西中药固体制剂制造技术国家工程研究中心。白桦林烯酮由本实验室自“松蒂” 基原植物篦齿虎耳草中分离得到。胎牛血清(上海双洳生物科技有限公司,批号OH12343);油酸OA(美国Sigma 公司,批号SLBZ5247);油 红O(美 国Sigma 公 司,批 号002420145);二甲亚砜DMSO(北京Solarbio 公司,批号1012D032);甘油三酯试剂盒TG(南京建成生物工程研究所,批号20191205);BCA 蛋白试剂盒(北京鼎国昌盛生物技术有限责任公司,批号98F00140);超氧化物歧化酶SOD 试剂盒(南京建成生物工程研究所,批号20190717);细胞丙二醛MDA 试剂盒(南京建成生物工程研究所,批号20190513);PBS 缓冲液(北京Solarbio 公司,批号P1020⁃500);Trypsln⁃EDTA(北京鼎国昌盛生物技术有限责任公司,批号910080101100);盖玻片、载玻片(江苏世泰实验器材有限公司,批号80312⁃2101)。
1.3 仪器 显微镜(日本Nikon 公司,型号DMI300);全波长酶标仪(美国Thermo 公司,型号Multiskan Go1510);台式高速冷冻离心机(德国Eppendorf 公司,型号5430);手持式匀浆机(美国Biodex 公司,型号Tissue⁃Tearor)。
2 方法
2.1 体外非酒精性脂肪肝细胞模型的复制 LO2细胞培养于含10%胎牛血清、1%双抗(青霉素和链霉素)的RPMI⁃1640 培养基中,置于37 ℃、5% CO2的培养箱中培养24 h,以5×104/孔密度接种于6 孔培养板中,取处于对数生长期的细胞进行试验,设置空白组与模型组。根据前期实验结果建立脂肪肝细胞模型所用油酸的最佳作用浓度和时间分别为200 μmol/L、24 h,并检测模型TG 水平,结合油红O 染色法观察细胞内脂滴变化,评价体外非酒精性脂肪肝细胞模型是否复制成功。
2.2 磺酰罗丹明B 比色法(sulfonyl rhodamine B colorimetry,SRB)检测化合物对LO2 细胞增殖的影响 将LO2 细胞按5×104/孔浓度接种于6 孔板中,于37 ℃、5%CO2恒温箱中培养24 h 后,各化合物设置3 个给药浓度(100、50、25 μmol/L),进行3 次平行实验。给药48 h 后,采用SRB 法检测细胞增殖,选择对细胞活性无明显影响的浓度进行实验。
2.3 细胞内TG、SOD、MDA 水平的测定 将LO2细胞按5×104/孔浓度接种于6 孔板中,于37 ℃、5% CO2恒温箱中培养24 h,分为空白组、模型组及山柰酚(50、25 μmol/L)、异槲皮 苷(100、50 μmol/L)、没食子酸(100、50 μmol/L)、金丝桃苷(100、50 μmol/L)、芦丁(100、50 μmol/L)、白桦林烯酮(100、50 μmol/L)组,除空白组外,各给药组给药24 h 后进行油酸造模,24 h 后收集细胞悬液于1.5 mL 离心管中,预冷PBS 清洗1~2 次,于4 ℃、1 000 r/min下离心10 min,弃上清液留细胞沉淀,加入裂解液200 μL/管,冰上裂解20 min后按照试剂盒说明书进行TG 水平检测。在检测SOD、MDA 时,于细胞沉淀中加入预冷的300 mL PBS 缓冲液进行手动匀浆破碎细胞,再按照试剂盒说明书进行测定,重复3 次。
2.4 油红O 染色观察细胞内脂滴的形成 将对数生长期的LO2 细胞接种于6 孔板中,于37 ℃、5%CO2恒温箱中培养24 h,按“2.3” 项下方法分组,除空白组外各组给药24 h 后进行油酸造模,24 h 后进行油红O 染色,甘油明胶封片,显微镜下观察,拍照,重复3 次。
2.5 统计学分析 采用graphpad prism 6.01 软件进行分析,数据以()表示,多组间比较采用单因素方差分析,组间两两比较采用LSD 分析。P<0.05表示差异具有统计学意义。
3 结果
3.1 体外非酒精性脂肪肝细胞模型复制 在前期实验基础上发现,造模剂油酸浓度为200 μmol/L时造模24 h 后,对LO2 细胞存活无影响,并且细胞内产生脂滴及甘油三酯相对较多,故以其为非酒精性脂肪肝细胞模型复制的条件。与空白组相比,模型组细胞内TG 水平增加(P<0.01,图1A),同时模型组细胞内呈现脂滴(图1B)。

图1 油酸对LO2 细胞中TG 水平及脂滴形成的影响Fig.1 Effects of oleic acid on TG level and lipid droplet formation in LO2 cells
3.2 各化合物实验给药浓度的选择 通过SRB 法检测不同浓度化合物对LO2 细胞的存活率,选择对细胞存活率无明显影响者作为实验浓度,每个化合物分别设置3 个浓度(25、50、100 μmol/L),结果见图2。其中,异槲皮苷、没食子酸,金丝桃苷、芦丁和白桦林烯酮浓度在50、100 μmol/L 时对细胞存活率无明显影响,而100 μmol/L 山柰酚对细胞生长有抑制作用(P<0.01),故选择25、50 μmol/L 进行下一步实验。
3.3 各化合物对LO2 细胞中TG 水平的影响 与空白组相比,模型组TG 水平升高(P<0.01);与模型组相比,山柰酚浓度在25、50 μmol/L 时均可降低TG 水平(P<0.01),而异槲皮苷、没食子酸、芦丁、白桦林烯酮浓度在100 μmol/L 时可降低TG 水平(P<0.05,P<0.01)。见图3。
3.4 各化合物对LO2 细胞中脂滴形成的影响 与空白组相比,模型组细胞中形成的红色脂滴数量增多,细胞外形成“连珠” 状红色脂滴环;与模型组相比,各给药组细胞外红色脂滴的数量以及脂滴堆积程度均有所下降,其中山柰酚、没食子酸及100 μmol/L异槲皮苷、芦丁、白桦林烯酮能减少红色脂滴形成,细胞外“连珠” 状脂滴尚未成环,而金丝桃苷组较其他组降低脂滴形成的趋势较弱。见图4。

图2 不同浓度单体成分对LO2 细胞存活率的影响Fig.2 Effects of different concentrations of monomer components on the survival rate of LO2 cells
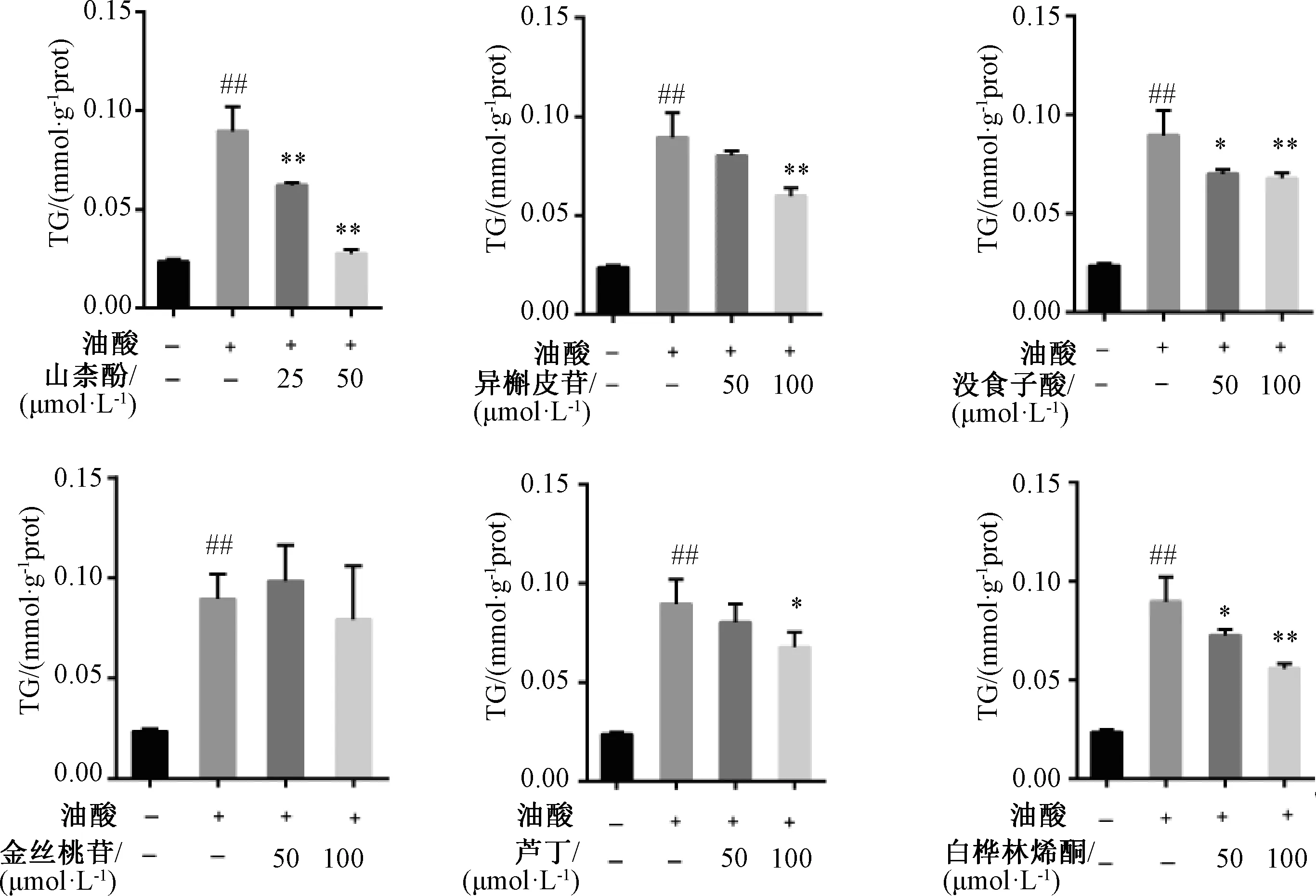
图3 单体成分对LO2 细胞中TG 水平的影响Fig.3 Effects of monomer components on TG level in LO2 cells
3.5 各化合物对LO2 细胞中SOD 水平的影响 与空白组相比,模型组SOD 水平降低(P<0.01);与模型组相比,50 μmol/L 山柰酚及100 μmol/L 没食子酸、金丝桃苷、芦丁、白桦林烯酮可升高SOD 水平(P<0.05,P<0.01),而各浓度异槲皮苷均可升高SOD 水平(P<0.05)。见图5。
3.6 各化合物对LO2 细胞中MDA 水平的影响 与空白组相比,模型组MDA 水平升高(P<0.01);与模型组相比,异槲皮苷、金丝桃苷、芦丁浓度在50、100 μmol/L 时能降低MDA 水平(P<0.05,P<0.01),而50 μmol/L 山柰酚 及100 μmol/L没食子酸、白桦林烯酮可降低MDA 水平(P<0.01)。见图6。
4 讨论
非酒精性脂肪肝是世界范围内最常见的慢性肝病,主要特征表现为脂质的积累和胰岛素抵抗[11]。其发病机制多样,“二次打击” 学说是目前最为广泛接受的学说,1988 年由Day 等首次提出[12]。“首次打击” 由胰岛素抵抗(insulin resistance,IR)引起,此时外周脂肪分解及合成脂肪增加,进入肝脏的游离脂肪酸增加,游离脂肪酸氧化加强,促进细胞内活性氧、肠源性内毒素、促炎性细胞因子的过度产生,引起激素敏感性脂肪酶的抑制作用下降,多余的游离脂肪酸蓄积在肝脏中,形成TG 在肝脏上的堆积[13],而油酸是一种不饱和脂肪酸,是细胞内游离脂肪酸的来源,可引起脂毒性,导致线粒体功能破坏抑制脂代谢相关酶的活性,引发氧化应激形成二次打击[14]。NAFLD 的氧化应激源于细胞内过量游离脂肪酸的氧化过程,这将导致活性氧ROS 的过度产生[15]。SOD 是生物体内最为重要的抗氧化酶之一,是清除ROS 的第一道防线[16],其活性降低将导致自由基在体内蓄积引发脂质过氧,而MDA 是一种稳定的脂质过氧化产物,常常作为判断脂质过氧化的指标[17]。

图4 单体成分对LO2 细胞中脂滴形成的影响(×400)Fig.4 Effects of monomer components on the formation of lipid droplets in LO2 cells(×400)
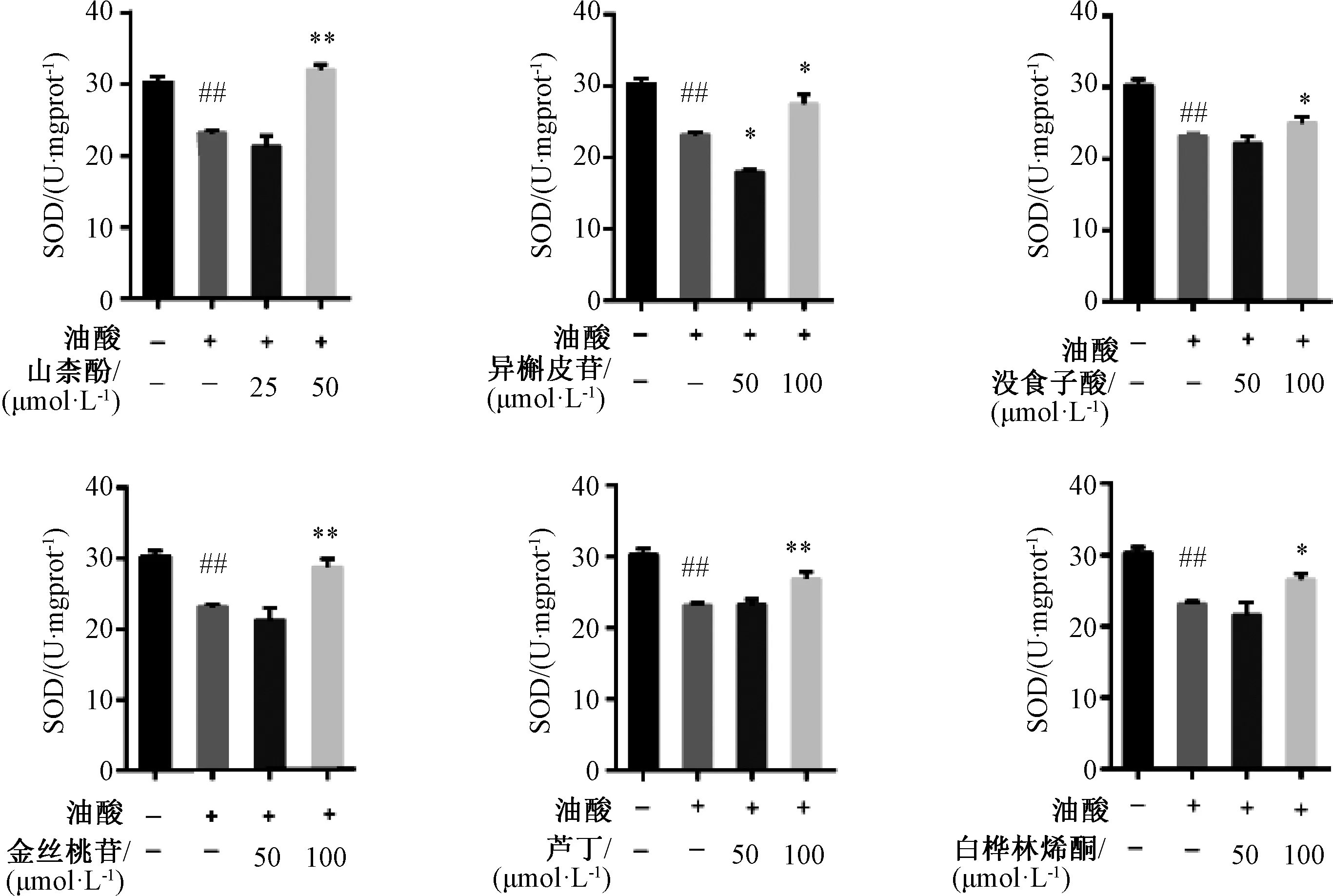
图5 单体成分对LO2 细胞中SOD 水平的影响Fig.5 Effects of monomer components on SOD level in LO2 cells

图6 各单体成分对LO2 细胞中MDA 水平的影响Fig.6 Effects of monomer components on MDA level in LO2 cells
在抗NAFLD 体外药效评价实验的文献报道中[11⁃16],均未见设立阳性对照组,原因可能是目前还没有针对本实验中所采用NAFLD 体外模型的合适阳性药物。本研究也未设立阳性对照组,而药物组相较于模型组的各项指标变化,也足以说明药物效果。
基于以上NAFLD 的发病机制及已有相关体外模型的国内外文献报道,本研究不断优化造模实验条件,最终选择200 μmol/L 油酸作用于LO2 细胞24 h,成功复制非酒精性脂肪肝细胞模型,显微镜下观察模型组相较于空白对照组,红色脂滴数量明显增多,细胞外形成“连珠” 状红色脂滴环,细胞内TG、氧化应激水平显著增加(MDA 水平显著升高,SOD 水平显著降低),与文献中模型建立成功的评价指标基本一致[8,14,18⁃19],说明本研究体外细胞模型复制成功,可用于抗NAFLD 药物的体外药效评价实验。
本研究中的多酚类化合物在藏区虎耳草属多种植物(“松蒂” 基原植物)的化学成分相关文献中均有报道[20⁃25],在“松蒂” 基原植物的化学成分组成中具有一定的代表性,而且在抗各种肝损伤活性方面有较多研究报道[26⁃29]。本研究利用NAFLD体外细胞模型对上述化合物进行药效评价研究,表明它们均可不同程度减少细胞内TG 水平,抑制MDA 水平,同时提高SOD 活性,并减少细胞内脂滴形成,从而一定程度上说明“松蒂” 类药材中所含具有一定代表性的多酚类成分可能是其抗NAFLD 的药效物质组成成分,其抑制体外脂肪肝细胞模型中脂质形成的机制可能与多酚类成分的抗氧化应激作用相关,值得继续深入研究。
