外周神经损伤后脊髓HDAC2 表达的增加对mu 阿片受体表达的影响*
2020-10-31高翊博任晋璇郁丽娜
孙 娜 谢 晨 高翊博 任晋璇 郁丽娜 严 敏,
(1 徐州医科大学江苏省麻醉学重点实验室,徐州221004;2 浙江大学医学院附属第二医院麻醉科,杭州310002)
神经病理性疼痛是由躯体感觉系统的损伤或疾病所引起的疼痛[1],大约影响到世界人口的7%[2,3],多表现为自发性疼痛、痛觉过敏或感觉异常为特征的严重疼痛,病人常常难以忍受。截至2017 年世界上约有4.25 亿的糖尿病病人[4],其中约有一半伴有糖尿病性周围神经病理性疼痛[5]。在一项大规模的国人调查中,2.6%的后背痛是由神经病变导致的[6]。目前对于神经病理性疼痛的治疗以抗惊厥药、抗抑郁药作为一线药物,阿片类药物对神经病理性疼痛效果较差,已经作为临床治疗疼痛的二线或三线用药[7~10]。这种现象的出现和疼痛传导通路上尤其是外周初级感觉神经元和中枢神经系统神经元在神经病理性疼痛状况下阿片受体表达降低有很大关系[11]。因此理解阿片受体表达降低的机制对增强吗啡对神经病理性疼痛镇痛效应的改善很有必要。
表观遗传学包括DNA 的甲基化、组蛋白的乙酰化、组蛋白的甲基化、LncRNA 等[12],不涉及DNA 序列改变的基因表达和调控的可逆、可遗传修饰,在疼痛的产生和维持,以及疼痛由急性期向慢性期转化的过程中扮演着重要的作用[13~16]。作为染色体的基本结构,组蛋白的乙酰化会使整条染色体的结构松散,有利于转录因子的接近而有利于转录,然而去乙酰化则会使其结构致密从而不利于转录[17,18]。最近Liang 等[19]发现大鼠在炎性痛或神经病理性疼痛模型下背根神经节或脊髓背角组蛋白的乙酰化明显降低。Hou 等[20]发现在骨癌痛模型下抑制乙酰化酶2 (histone deacetylase 2, HDAC2) 的表达增加,会降低痛觉高敏并且能增加KCC2 的表达。因此,在神经病理性疼痛情况下,脊髓背角阿片受体 (opioid receptor, MOR)的减少是否也与HDACs 导致的组蛋白乙酰化降低有关有待进一步探讨。本研究首次提出在神经病理性疼痛情况下,损伤节段脊髓HDAC2 存在一个稳定且明显的增加,MOR 表达明显降低。通过应用HDAC2 的抑制剂或应用一些干扰RNA 技术降低脊髓背角HDAC2 在神经病理性疼痛情况下的增高可以逆转MOR 表达的降低,提高吗啡的镇痛效应,为临床吗啡应用于神经病理性疼痛的治疗提供一个参考。
(3)对向美国或其他外国市场出口的产品实行补贴(或有补贴效果的措施),从而实质性影响了美国有竞争力的产品在美国市场或其他外国市场的销售。
方 法
1.主要试剂和仪器
辛二酰苯胺异羟肟酸(SAHA, S1047, Selleck公司),盐酸吗啡(沈阳制药有限公司),戊巴比妥钠(上海制药厂),Anti-MOR 抗体(ab10275, Abcam 公司),Anti-GAPDH 抗体(AF0006, Beyotime公司),Anti-HDAC1 抗体(ab19845, Abcam 公司),Anti-HDAC2 抗体(#2540, Cell Signaling Technology公司),Anti-HDAC4 抗体(#2072, Cell Signaling Technology 公司),Anti-HDAC5 抗体(#20458, Cell Signaling Technology 公司),Anti-acetyl-histone H3 抗体(#9649, Cell Signaling Technology 公司);Anti-Histone H3 抗体(#9715, Cell Signal Technology 公司),Anti-NeuN 抗体(ab104224, Abcam 公司),蛋白印迹膜再生液(Meilunbio),热痛刺激仪(中国医学科学院生物医学研究所)。
2.实验动物
C57BL/6J 小鼠,雄性,体重20~25 g,由浙江大学医学院动物实验中心提供。动物置于24±2℃室温下,12 h/12 h 昼夜节律,自由摄食摄水。所有实验动物适应环境2 天后进入实验。
3. 神经病理性疼痛模型
参照文献[21]坐骨神经慢性压迫性 (chronic constrictive injury, CCI) 神经病理性疼痛模型,腹腔注射戊巴比妥钠40 mg/kg 麻醉,于右侧股骨中部做纵向切口,分离股二头肌,暴露坐骨神经及其三个分支:腓肠神经、腓总神经和腓神经,用6-0 丝线自坐骨神经三叉分支处单向结扎4 道,松紧适度,以引起腿部肌肉刚出现肌颤触为佳,间距1 mm。假手术组和CCI 组相比,只暴露不结扎,其余步骤均相同。逐层缝合手术切口。
4. 热缩足反射潜伏期 (thermal withdrawal latency, TWL)
采用SPSS 13.0软件对实验数据进行统计分析,用Graphpad Prism 7.0 生成图表,ImageJ 2.0 处理图片。所有计量资料均用均数±标准误 (±SEM)表示。多组间比较采用重复测量的方差分析,两两比较采用t 检验。P < 0.05 认为差异有统计学意义。
5. 吗啡的镇痛效应
如Mao 等[16]所述,术后7 天腹腔注射吗啡1.5 mg/kg。在手术前(基线潜伏期)和吗啡注射后30 min(反应潜伏期)进行TWL 测量。截止时间定为20,最大可能镇痛效应的百分比 (% MPAE) = [(反应潜伏期-基线潜伏期) / (截止时间-基线潜伏期)]×100%。
采用Hylden 等[23]的方法,鞘内注射在L5和L6脊柱节段之间徒手进行。在针头进入蛛网膜下腔时,可以注意到小鼠尾巴快速轻弹动作。推药后针头停留5~10 s,然后拔出。
管线通过地带,有的地段灌木茂密,为防止清表偏离,应严格进行测量控制。根据选线位置,在管线通过位置每100 m设置红色视线标志,先进行第一道方向性清表。根据管道操作工作面宽度和施工便道宽度、现场堆土宽度的要求,确定清表宽度。沿清表方向每间距50 m设置清表红色边线桩且插标旗,专人指挥机械进行修整加宽并随时检查调整方向,确保清表线路正确。
6. 免疫荧光
HDAC2 siRNA由上海吉满生物科技公司合成。siRNA 由Entranster™ 在体转染液稀释,稀释浓度约为100 pmol/4 μl,每次鞘内给药体积4 μl,术前30 min 给药,连续1、2、3 共3 天。对照组为试剂商提供的阴性对照。稀释溶剂为Entranster™ 在体转染液。HDAC2 siRNA 的序列如下:5'-CCGTGAAGCTGAACCGTCA-3'。
7. Western blot 法
将小鼠断头处死,快速取出L3-4节段脊髓并放入液氮中冷冻,-80℃保存备用。总RNA 提取:冰上预冷研钵,将少量约50~100 mg 组织块置于研钵,加l ml Trizol 于研钵中,加入适量液氮,进行研磨。用移液器收集研磨液于1.5 ml EP 管中,加入0.2 ml 氯仿,盖紧离心管,剧烈震荡离心管,静置2~3 min。4℃下,12 000 g 离心15 min。取上层水相约400 μl于新的离心管,加入0.5 ml 异丙醇,颠倒混匀,15~30℃放置10 min,4℃下12 000 g 离心10 min。弃上清,加入l ml 75%的无水乙醇,漩涡混匀,4℃ 7500 g 离心5 min。弃上清,室温或真空干燥5~10 min,将RNA 溶于20~30 μl 水中。测浓度和RNA 质量:取2 μl 的RNA 于98 μl 的水中,测浓度和OD260/OD280(> 1.8)。用1%琼脂糖凝胶鉴定RNA 有无降解。逆转录cDNA:取一新的离心管,依次加入下列溶液:总RNA (0.1~5 μg)、随机引物3 μl、ddH2O 加至12 μl。70℃孵育5 min 后,冰上震荡2 min。在冰上依次加入下列试剂:5xReaction Buffer 5 μl、10mMdNTP 混 合 物2 μl、逆 转 录 酶l μl,42℃处理60~90 min,70℃处理10 min,停止反应,放置冰上。逆转录后的cDNA 可继续作为PCR 反应或保存于-20℃。PCR 反应:在冰上按下列顺序依次加入:ddH2O 6 μl、2xSYBR Premix Ex TaqTM II Reaction Buffer 10 μl、各蛋白引物0.8 μl、或GAPDH 引物0.8 μl 、cDNA2 μl 、50×ROX Reference Dye 0.4 μl。最终反应体系总体积为20 μl。温度循环:95℃30 s、95℃5 s、60℃30 s。重复步骤2~3,共40 循环、95℃15 s。经ABI 公司StepOnePlusV 2.1 软件分析处理。各引物见表1。
8.荧光定量实时PCR
将小鼠断头处死,快速取出L3-4节段脊髓并放入液氮中,冷冻-80℃保存备用。蛋白提取:冰上预冷研钵,将少量组织块置于研钵中,400 μl 裂解液(RIPA:PMSF = 100:1)加入研钵中,倒入适量液氮,研磨均匀,用移液器收集研磨液于1.5 ml EP 管中,冰上静置30 min 后,4℃13 000 rpm 10 min,取上清于新的1.5 ml EP 管中。按BCA 法测定样本蛋白浓度后加入5×上样缓冲液及裂解液调整到每一份样本浓度相同,100℃金属浴高温变性5 min。取50 μg蛋白样本在10%的SDS 预制胶上电泳,电压分别为浓缩胶80 V,分离胶120 V,湿法将蛋白转移至PVDF 膜上,5%脱脂奶粉封闭1 h 后分别与一抗抗μ 阿片受体(1:1000),一抗抗乙酰化的组蛋白H3 抗体(1:1000);一抗抗组蛋白H3 抗体(1:1000);一抗抗HDAC1 抗体 (1:1000), 一抗抗HDAC2 (1:1000),一抗抗HDAC4 抗体 (1:1000),以及一抗抗HDAC5抗体 (1:1000), 4℃孵育过夜;TBST 振荡清洗,3×5 min,加入辣根过氧化物酶酶标记二抗(1:5000),室温振荡孵育l h;TBST 振荡冲洗,3×5 min,使用ECLwestern blot 检测仪器检测。曝光之后条带采用蛋白印迹膜再生液振荡冲洗30 min,之后重复孵育其他抗体,进行PVDF 蛋白印迹膜的重复利用。所得条带经Bio-Rad 公司Quantity One 4.6.2 软件半定量分析处理。
9. 鞘内给药
采访中,我们还有一个很大的感触就是,对待做人做事,华岳人讲规则、讲规律。“我们卖的不仅仅是产品,也是服务、标准和诚信。既是物美价廉的产品,更是个性化、高品质的产品。”在他们看来,企业的发展,靠的不仅是高质的产品,更重要的是注重创新与研发,做到产品和服务一体化。
加强水利重大问题研究与应用。继续加强流域与行业共性重大问题的调研论证,组织凝练出一批流域与行业共性重大科技项目。加强水利重大基础研究,在行业科研专项经费中,设立重大基础研究专项。围绕南水北调西线工程建设前期论证中的重大关键技术问题,积极争取科技部设立重大科技支撑项目支持开展研究。围绕水旱灾害综合治理、节约用水、水资源保护、水土保持、工程建设与管理等方面加快科技成果的推广应用。
10. HDAC2 siRNA 给药
小鼠在深麻醉下,经升主动脉依次灌注生理盐水 (20 ml) 和4%多聚甲醛溶液 (20 ml)。取L3-L4节段脊髓,在4%多聚甲醛溶液中固定过夜后,转入15%蔗糖溶液,4℃过夜,脱水至组织沉底,再转入30%蔗糖溶液,4℃过夜,脱水至组织沉底。横向冰冻切片,厚10 μm,贴于防脱阳离子玻片上,免疫组化笔画圈,加入含有0.3% TritonX-100 的5%牛血清室温封闭1 h。1 h 后加入含有一抗抗NeuN (1:200),一抗抗μ 阿片受体(1:200),一抗抗乙酰化的组蛋白H3 抗体(1:200); 一抗抗HDAC1 抗体 (1:200), 一抗抗HDAC2 (1:200), 一抗抗HDAC4抗体 (1:200),以及一抗抗HDAC5 抗体 (1:200),4℃孵育过夜,PBS 冲洗,3×5 min,滴加二抗Alexa FluorTM 594 d 驴抗兔(H + L) (1:500), Alexa FluorTM488 驴抗鼠(H + L) (1:500),DAPI 染色液,甘油封片,置于激光共聚焦显微镜下观察。
11. AAV5-HDAC2 病毒的构建
为构建表达全长HDAC2 mRNA 的质粒,首先通过Trizol 方法从小鼠脊髓组织中提取总RNA,用DNase I 处理。然后扩增HDAC2 cDNA。扩增HDAC2引物序列如下:Forward:CCGCTCGAGGCCACCATGGCGTACAGTCAAGGAGGC;Reverse:GCTCTAGAAGGGTTGCTGAGTTGTTCTGACTTG。接下来,将HDAC2 cDNA 插入前病毒质粒 (pAAVMCS) 中。DNA 测序用于验证cDNA 序列和重组克隆。制备携带cDNA 的腺相关病毒颗粒。使用PEI转染方法,用表达HDAC2 或增强的绿色荧光蛋白 (EGFPr),pAAV-DJ-RC 和pHelper 的pAAV-MCS 转染DH5a 感受态细胞。3 天后,收集转染的细胞并悬浮在无血清DMEM 中。在4 次冻融循环后,以10 000 g 离心10 min 收集AAV 上清液,并使用AAV Puri fication Standard Kit (Cell Biolabs, Inc) 浓缩。
12. 统计学分析
采用热辐射刺激仪,测定小鼠损伤侧热辐射刺激,测定小鼠损伤侧足底TWL。将有机玻璃箱置于3 mm 厚的玻璃板上,按Hargreaves 法[22]用热辐射刺激仪照射小鼠足底,照射开始至小鼠出现抬腿回避时间为TWL。热刺激强度调整为基础值8~12 s,在整个实验过程中维持一致,自动切断时间为20 s,以免造成热辐射损伤。为避免或减少前一次刺激对随后刺激效应造成的影响,同一部位刺激的间隔时间为2 min,连续测定3 次,取3 次平均值为小鼠TWL 值。
在本实验中,小鼠分成CCI 手术组以及Sham手术组。在术后7 天取材小鼠脊髓进行Westernblot、qRTPCR 以及免疫荧光。Western blot 显示外周神经损伤后损伤侧L3-L4节段脊髓中MOR 蛋白表达降低(见图1A),HDAC2 蛋白表达增加(见图1C)。HDAC1、HDAC4 和HDAC5 蛋白表达变化不明显(见图1B、D 和E)。神经损伤后7 天组蛋白的乙酰化水平明显降低(见图1F)。qRTPCR 显示MOR 与HDAC2 mRNA 的变化水平和蛋白水平基本一致(见图G-K),而HDAC1, 4, 5mRNA 变化不明显。免疫荧光显示MOR 主要表达在脊髓背角浅层,HDAC2 主要表达在神经元的细胞核,而 AcH3 为广泛表达的核内蛋白(见图 2)。
结 果
1. 外周神经损伤后小鼠脊髓中MOR 和AcH3表达降低,HDAC2 表达增加
近年来,锂离子电池的应用已经逐渐扩展到汽车、家电、电动自行车、储能等领域。2014年,中国锂离子电池产量达52.87亿只,占全球总产量比重达到71.2%, 2018年预计全国锂电池产量达到121亿只,增速22.86%。国内锂离子电池产业进入快速成长阶段,成为全球主要的锂离子电池生产国和消费国。
朱熹曾说过:“无一事而不学,无一时而不学,无一处而不学。”终身学习是每一个人基本生存素质,“严谨笃学,与时俱进。”是新世纪教师应有的终身学习观。数学是一门不断在前进与发展的科学,教师只有树立终身学习观念,不断地学习与进步,才能提高自身的数学和数学史素养,并能更好地在数学课堂中,潜移默化地让学生理解、领悟数学史并合理利用数学史,从而发挥数学史真正的作用。

表1 q-PCR 中的引物序列Table 1 Primers and sequences used in q-PCR
2.降低脊髓HDAC2 的表达可增加MOR 的表达,增强吗啡的镇痛作用

图1 外周神经损伤导致小鼠脊髓中MOR 和AcH3 表达降低,HDAC2 表达增加(±SEM) (A-F) Western blot 显示神经损伤7 天后损伤侧L3-L4 节段脊髓各蛋白的表达量。MOR 和AcH3 表达降低,HDAC2表达增加,HDAC1, 4, 5 变化不明显,n = 6(表示做了6 次重复,每组用4 只);(G-K) qRTPCR 显示神经损伤后脊髓各蛋白的mRNA 的表达量,变化趋势和蛋白基本一致,n = 4(每组用3 只) *P < 0.05,CCI 组与Sham 组相比Fig. 1 The expression of MOR and AcH3 increased while the expression of HDAC2 decreased 7 days after peripheral nerve injury (±SEM) (A-F) Western blot showed the expression of proteins in segment L3-L4 of the injured spinal cord 7 days after surgery. An obvious decline was shown in the expression of MOR and AcH3 while an augmentation appeared in the expression of HDAC2. No obvious change was found in the expression of HDAC1, HDAC4 and HDAC5. n = 6 (means 6 repetitions, 4 mice in each group); (G-K) qRTPCR showed the level of mRNA after nerve injury, which was parallel with the tendency of the proteins change.n = 4 (3 mice/group). *P < 0.05, CCI group compared with group Sham.
将小鼠分为溶剂Sham 组 (Veh-Sham),溶剂CCI组 (Veh-CCI) 以及SAHA-CCI 组。在SAHA-CCI 组术前30 min 鞘内注射HDAC 的泛抑制剂SAHA,连续7 天,以降低HDAC2 表达。在术后第3 天腹腔注射吗啡1.5 mg/kg 后30 min 测量小鼠损伤侧热TWL 值计算吗啡的MPAE。结果表明与Veh-Sham组相比,Veh-CCI 组吗啡的MPAE 明显降低,说明在神经病理性疼痛情况下吗啡的镇痛效应降低。而鞘内注射SAHA3 天后与Veh-CCI 组相比,吗啡的镇痛效应显著增加(见图3A)。Western blot 和qRTPCR 显示术后7 天损伤节段HDAC2 蛋白的表达降低,HDAC2 mRNA 水平降低(见图3C、F)。同时SAHA 可以增加损伤侧MOR 的蛋白表达量以及促进MOR 基因的转录(见图3B、E),增加组蛋白H3 的乙酰化水平(见图3D)。因此,SAHA对HDAC2 表达的抑制也许能促进MOR 的表达,从而增强吗啡的镇痛效应。
3.降低脊髓HDAC2 的表达可增加损伤侧脊髓中的MOR 和AcH3 的表达
将小鼠分为溶剂CCI 组(Veh-CCI),阴性对照CCI 组(NC-CCI)以及HDAC2 siRNA-CCI 组(Si-CCI)。通过鞘内注射HDAC2 siRNA 降低神经病理性疼痛情况下脊髓HDAC2 的表达来确定脊髓背角中HDAC2 对MOR 是否有调节作用。设置Veh-CCI组,以排除溶剂的影响。在术前30 min 鞘内注入HDAC2 siRNA 或NC siRNA,连续3 天。术后第7天腹腔给吗啡1.5 mg/kg,30 min 后测量小鼠损伤侧TWL。发现在Si-CCI 组小鼠中吗啡的镇痛作用显著增加(见图4)。Western blot 与qRTPCR 显示,与NC-HDAC2 处理的小鼠相比,在第7 天,siRNA处理组脊髓背角中HDAC2 蛋白和mRNA 水平显著降低(见图4C、F),AcH3 的水平显著增加(见图4D),MOR的蛋白水平和mRNA水平明显增加(见图4B、E)。免疫荧光也显示应用HDAC2 siRNA在降低HDAC2 表达的同时可以明显增加损伤侧脊髓MOR 和AcH3 的表达。以上结果表明脊髓背角中HDAC2 的减少可能通过增加MOR 基因启动子等部位的乙酰化导致MOR 表达的增加。
4. HDAC2 过表达降低正常小鼠脊髓背角中的MOR 表达
将小鼠分为AAV5-HDAC2 和AAV5-EGFP 组。通过鞘内注射AAV5-HDAC2 过表达脊髓内HDAC2,以此模拟HDAC2 在神经病理性疼痛表达增加的过程。在脊髓L5-6椎间隙鞘内注射重组腺相关病毒5 (AAV5) 来实现在该节段脊髓背角表达全长HDAC2 (AAV5-HDAC2)。注射后第28 天,和对照组相比,测量小鼠的TWL,计算吗啡的MPAE,脊髓过表达HDAC2 后吗啡的镇痛效能降低(见图5A),同时,Western blot 和qRTPCR 显示HDAC2的过表达降低了MOR 和AcH3 的表达水平。单独应用AAV5-EGFP 不会改变MOR 蛋白水平(见图5B-D)。qRT-PCR 显示过表达HDAC2 对MOR 的转录有抑制作用(见图5E、F)。综上所述,MOR在神经损伤后表达的降低很有可能是由脊髓背角HDAC2 表达增加所导致的。
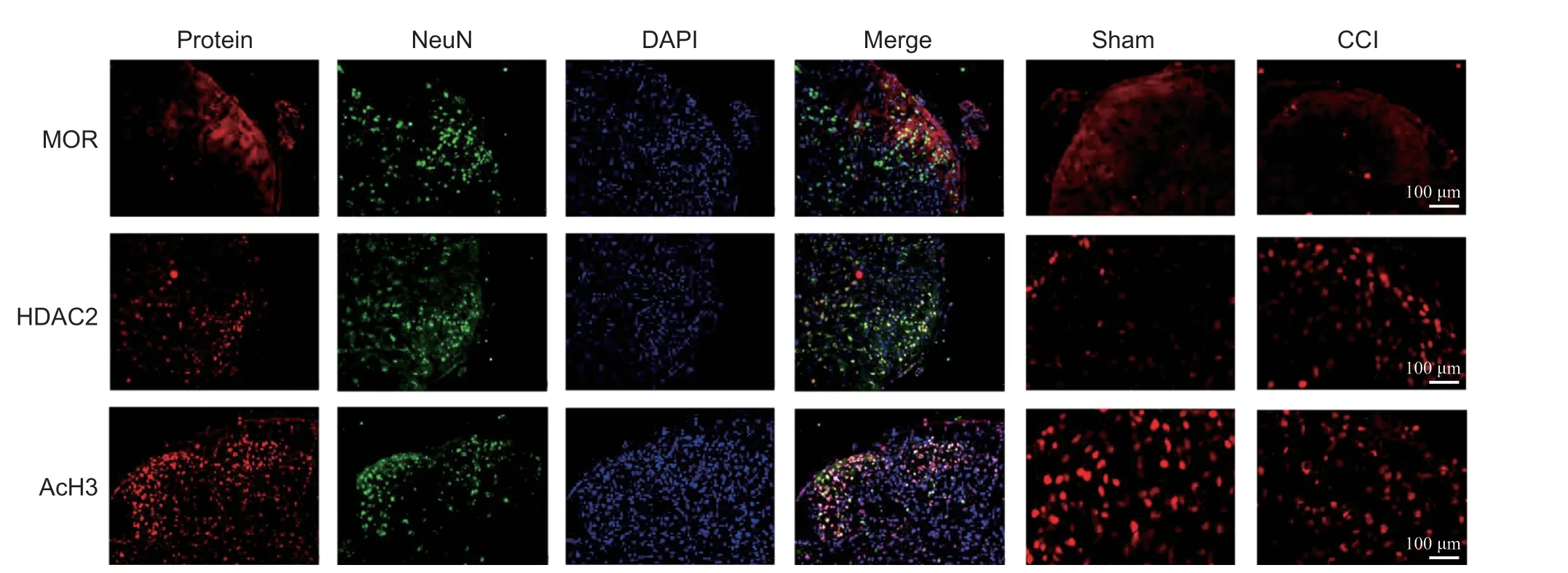
图2 免疫荧光显示MOR 主要表达在脊髓背角浅层I-II,损伤组较对照组表达降低;HDAC2 在脊髓与神经元共标,神经损伤侧表达较对照组增加;AcH3 在脊髓广泛表达,与细胞核共标,神经损伤组较对照组表达降低。红色:目标蛋白;绿色:神经元;蓝色:细胞核 标尺= 100 μmFig. 2 IF showed MOR located mainly in the I-II layers of the spinal cord while HDAC2 and AcH3 expressed widely in the spinal cord. Both of them merged well with nucleus. An obvious decrease was shown in the expression of the MOR and AcH3 and the expression of HDAC2 increased in the CCI group 7 days after surgery. red: target protein; green: neurons; blue: nucleus. Scale bar = 100 μm

图3 降低HDAC2 的表达可增加MOR 的表达,增强吗啡的镇痛作用(±SEM) (A)与Veh-Sham 组相比,Veh-CCI 组在术后3 天吗啡的最大可能镇痛效应明显降低,而在鞘内连续给SAHA 后吗啡的镇痛效应明显增加,n = 6(每组用6 只)。(B, E) 鞘内给SAHA 后7 天脊髓损伤节段MOR 蛋白的表达增加,MOR mRNA 的水平增加;(C, F) 鞘内给SAHA 后7 天,脊髓HDAC2 在蛋白水平和基因转录水平表达均有明显下降;(D) SAHA 促进组蛋白的乙酰化水平,n = 6(每组用4 只);(G) 免疫荧光进一步证实各蛋白在鞘内注射SAHA7 天后在脊髓的表达改变情况。给SAHA 后7 天,MOR 的表达增加,HDAC2 表达降低,AH3 表达增加,n = 4(每组用3 只) 标尺 = 100 μm *P < 0.05, SAHA-CCI 组与Veh-CCI 组相比;##P < 0.01, Veh-CCI 组与Veh-Sham 组相比Fig. 3 Decreased HDAC expression is associated with increased expression of MOR and enhanced analgesic effect of morphine (±SEM) (A) Compared with the Veh-Sham group, the MPAE of morphine is significantly reduced in the Veh-CCI group 3 days after surgery, n = 6 mice/group; (B, E) The expression of MOR protein increased and the level of MOR mRNA increased on the injury side of the spinal cord 7 days after intrathecal administration of SAHA; (C, F) 7 days after intrathecal administration of SAHA, the expression of HDAC2 in the spinal cord is decreased at both protein level and transcription level; (D) SAHA promote acetylation levels of histones, n = 6 (4 mice/group); (G) Immunofluorescence further confirme the expression change of each protein in the spinal cord 7 days after intrathecal injection of SAHA. 7 days after SAHA, the expression of MOR and AcH3 increased, while the expression of HDAC2 decreased, n = 4 (3 mice/group). Scale bar = 100 μm *P < 0.05, group SAHA-CCI compared with group Veh-CCI; ##P < 0.01, group Veh-CCI compared with group Veh-Sham.

图4 脊髓HDAC2 下调增加损伤侧脊髓中的MOR 和AcH3 表达±SEM) (A) 鞘内注射HDAC2 siRNA 后7 天Si-CCI 组吗啡的MPAE 明显高于NC-CCI 组,差异有统计学意义,n = 6(每组用4 只); (B-D) Western blot 显示鞘内给HDAC2 siRNA7 天后,MOR 蛋白水平增加,HDAC2 蛋白水平降低,AcH3 蛋白水平增加,n = 6(每组用4 只);(E, F) qRTPCR 显示鞘内给HDAC2 siRNA 7 天后,MOR mRNA 水平增加,HDAC2 mRNA 水平降低,n = 4(每组用3 只);(G) 免疫荧光显示在给HDAC2 siRNA 后各蛋白水平的改变,与对照组相比,给HDAC2 siRNA 后MOR 的表达增加,HDAC2 表达降低,AcH3 表达增加,n = 4(每组用3 只) 标尺 = 100 μm *P < 0.05,Si-CCI 组与NC-CCI 组相比Fig. 4 Down-regulation of spinal cord HDAC2 increases MOR and AcH3 expression in the injured side of the spinal cord (±SEM) (A) The MPAE of morphine is significantly higher in the Si-CCI group than in the NC-CCI group, 7 days after intrathecal injection of HDAC2-siRNA. n = 6 mice/group; (B-D) 7 days after intrathecal administration of HDAC2 siRNA, western blot shows the expression of MOR and AcH3 protein levels increase, while HDAC2 protein decrease. n = 6 (4 mice/group); (E, F) qRTPCR shows an increase of MOR mRNA levels and a decrease of HDAC2 mRNA levels 7 days after intrathecal administration of HDAC2 siRNA. n = 4 (3 mice/group); (G) Immunofluorescence shows the changes in the levels of each protein after HDAC2 siRNA administration, the expression of MOR and AcH3 protein levels increase, while HDAC2 protein decrease. compared with the Veh-Sham group. n = 4 (3 mice/group). Scale bar = 100 μm *P < 0.05, group Si-CCI compared with group NC-CCI.
讨 论
根据去乙酰化酶的初级结构和二级结构,人类HDACs可分为4类共18型。I类包括HDAC1, 2, 3, 8,主要分布在细胞核内。II类包括II a (HDAC4, 5, 7, 9),II b (HDAC6, 10),主要根据所受刺激在胞质和胞核中穿梭。III 类包括SIRT1-7,是一群依赖NAD 的酶,主要分布于细胞核、细胞质和线粒体内。IV 类只有HDAC11,作用兼具I 和II 类[24,25]。本实验主要研究了几种在神经系统表达丰富的亚型HDAC1, 2, 4, 5。通过Western blot 和qRTPCR 发现,在CCI 模型中,与对照组相比,脊髓HDAC2 稳定且明显的升高,神经元和胶质细胞都有表达。同时HDAC1 也有升高的趋势,这和之前的多项研究一致[20,26~28]。与对照组相比,MOR 的表达在术后7 天明显的下降。考虑到HDAC2 的表观遗传作用,提出HDAC2 对MOR 有调节作用。通过鞘内注射HDACs 的泛抑制剂SAHA,以及HDAC2 siRNA 降低神经病理性疼痛情况下升高的HDAC2,与对照组相比,MOR 的表达有所提高,且差异有统计学差异。通过鞘内注射AAV5-HDAC2 过表达正常小鼠脊髓的HDAC2,HDAC2 表达增加后MOR 的表达降低。充分证实了HDAC2 对MOR 表达的调节作用,并且这种调节可能是通过MOR 基因启动子区的组蛋白的去乙酰化实现的。
组蛋白乙酰化和去乙酰化是生物过程中的两种主要组蛋白修饰。已有多项研究表明神经损伤上调组蛋白去乙酰化酶,导致组蛋白去乙酰化增加并引起慢性疼痛[29,30]。组蛋白去乙酰化酶抑制剂可以通过使神经损伤诱导的代谢型谷氨酸受体[31]、谷氨酸转运蛋白、谷氨酸脱羧酶65[30]、肿瘤坏死因子α[32]、神经元限制性沉默因子[2]和血清和糖皮质激素诱导激酶1[33]的下调正常化来减轻疼痛。另一方面,有研究发现神经损伤导致组蛋白的乙酰酶的表达,促进组蛋白乙酰化导致疼痛[34,35]。之前有研究表明,组蛋白乙酰转移酶抑制剂可以通过阻断趋化因子和环氧合酶-2 的上调来缓解慢性疼痛[36,37],趋化因子和环氧合酶-2 是与组蛋白乙酰化诱导疼痛的关键因素。本实验在对CCI 小鼠的研究中发现神经损伤组中损伤侧脊髓HDAC2的水平有明显且稳定的升高,组蛋白H3 的乙酰化明显低于假手术组,正如Liang等的发现[19]。HDAC2 可能通过降低MOR 基因启动子乙酰化从而抑制MOR 的基因转录,降低MOR的表达。然而,在神经病理性疼痛模型的术后7 天,组蛋白乙酰化存在全面降低,而应用HDAC2 siRNA敲减脊髓HDAC2 后,组蛋白H3 的乙酰化全面增高,说明HDAC2 调节基因转录的选择性不强,这也限制了HDAC2 抑制剂在吗啡镇痛方面的应用。本研究也存在一些不足之处,结果提示外周神经损伤后脊髓HDAC2 通过降低组蛋白H3 的乙酰化水平降低MOR 在脊髓背角的表达,但并没有检测MOR基因启动子区的组蛋白H3 的乙酰化水平,因此还需要进行下一步的研究来具体说明。
综上所述,脊髓背角HDAC2 表达增加可能是导致神经病理性疼痛情况下MOR 表达降低的一个因素。但由于其会广泛影响组蛋白H3 的乙酰化,所以HDAC 抑制剂在临床上的应用受到限制,需要更有针对性的药物出现来辅助吗啡在神经病理性疼痛的治疗。
