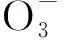一维噻吩羧酸基铜配位聚合物的晶体结构及其电化学性质
2020-10-30刘国成刘湘湘
刘国成, 刘湘湘, 赵 静, 唐 爽, 高 越
(渤海大学 化学化工学院, 辽宁 锦州 121013)
随着人类日益增长的物质需求和工业的快速发展,环境污染问题日趋明显[1-2].其中,亚硝酸盐、溴酸盐等污染物给环境带来了严重危害[3-4].如何对上述物质进行有效合理的检测是目前亟待解决的问题.对亚硝酸盐的检测方法包括分光光度法、色谱法以及电化学法[5-7];对溴酸盐的检测方法包括离子色谱法、毛细管电泳法以及高效液相色谱法等[8-10].上述方法各有优点,但也存在着不同方面的局限性.因此,开发一种新型有效的多功能分析材料用于对上述污染物的检测具有重要意义.吡啶衍生物基金属-有机配合物的结构多样,物理和化学性质独特[11-13],因其在电化学传感、荧光传感等分析领域的应用而得到了研究者的关注[14-15].在众多的功能配合物中,铜基配合物表现出了出色的电分析化学性能,铜离子不仅可作为良好的电化学活性中心,而且其优秀的配位能力还可以与氮/氧等多种类型有机配体配位[16].吡啶酰胺衍生物成为构筑铜基配合物的优秀配体,灵活的构像及良好的配位能力使其具有新颖的构筑结构和优异的电催化性能[17].另一方面,芳香二羧酸可以有效的平衡铜离子的电荷,并将其拓展成高维度结构[18-20],而N—/S—杂型羧酸较好的亲水性更有助于电催化性能的实现[21-22].将具有电化学活性的铜离子、出色配位能力的吡啶酰胺以及亲水性较好的S—杂型羧酸进行合理的组装,制备出新型电催化性能优异的配合物材料,对亚硝酸根等污染物的检测具有重要意义[23-24].
1 材料与方法
1.1 试剂和仪器
双吡啶双酰胺配体(L)参考文献[28]中方法合成.其余分析纯试剂均购于国药集团沈阳有限公司.元素分析和红外光谱实验分别采用美国Perkin公司的240型元素分析仪和美国Varian公司的640型红外光谱仪;相纯度和单晶结构分别采用日本理学的Rigaku Ultima Ⅳ型粉末-X射线衍射仪和德国Bruker公司的APEX-Ⅱ型单晶-X射线衍射仪;热稳定性和电化学性能分别采用美国PE公司的Pyris型热重分析仪和上海辰华公司的CHI-760E电化学工作站.
1.2 配合物的合成
将Cu(NO3)2(0.18 mmol),L(0.12 mmol),3,4-噻吩二甲酸(0.12 mmol),H2O(6 mL),乙醇(质量分数95%, 1 mL)和DMF(2 mL)封装在反应釜中,在90 ℃温度下反应7 d,得到蓝色块状晶体[Cu(L)2(3,4-HTDC)2](CCDC号:1940520).显微镜下手动分离后自然干燥,产率约为14%(以L计算),化学式为C24H18Cu0.50N4O6S,元素分析质量分数实测值(计算值):C,55.20(55.22)%;H,3.47(3.45)%;N,10.73(10.75)%.红外(KBr, cm-1):3 369 m,2 357 m,1 670 s,1 599 s,1 539 s,1 440 s,1 329 s,1 238 m,817 w,702 w,621 w.配合物[Cu(L)2(3,4-HTDC)2]的晶体数据见表1.

表1 配合物[Cu(L)2(3,4-HTDC)2]的晶体数据Table 1 Crystal data of complex [Cu(L)2(3,4-HTDC)2]
2 结果与讨论
2.1 晶体结构
图1为配合物[Cu(L)2(3,4-HTDC)2]的配位环境图, 结构分析表明, 配合物[Cu(L)2(3,4-HTDC)2]的结构单元包括半个正二价的Cu2+、一个负一价3,4-HTDC-和一个中性L配体. 铜离子的6个配位点分别被4个吡啶N和2个羧基O占据. 4个吡啶N处于赤道位的4个顶点,由于整个铜离子体现中心对称配位特性,因此Cu—N键分别为2.035(2) Å和2.046(2) Å,两个羧基O位于轴向位置,Cu—O键长为2.634(23) Å(见表2).从键长数值可见,轴向的配位键明显长于赤道位的配位键,上述配位特征体现出明显的Jahn-Teller效应.

图1 配合物[Cu(L)2(3,4-HTDC)2]的配位环境图Fig.1 Coordination environment of complex [Cu(L)2(3,4-HTDC)2]

表2 配合物[Cu(L)2(3,4-HTDC)2]的主要键长Table 2 The main bond length of complex [Cu(L)2(3,4-HTDC)2]
在配合物[Cu(L)2(3,4-HTDC)2]的结构中,噻吩二羧酸的一个羧基以单齿形式与铜离子配位,另一个羧基没有发生去质子化.基团(3,4-HTDC-)为负一价阴离子.在单胞结构中,Cu2+与3,4-HTDC-物质的量之比为1∶2,致使整个配合物呈电中性.L配体中,由于2个酰胺基团的存在,致使其上的2个吡啶环发生了不同程度的扭转,其二面角为89.37°.2个铜离子利用2个L配体的4个吡啶N原子连接成双金属环状结构,同一个L配体的2个吡啶N原子距离约为12.18 Å.图2为配合物[Cu(L)2(3,4-HTDC)2]的一维结构图,相邻的双金属环通过共用的铜离子拓展成一维配位聚合物(Cu…Cu距离约为13.08 Å).3,4-HTDC-配位于一维结构的两侧. 通常,有机二羧酸容易以双齿配位模式与金属配位,起到桥连配体的作用. 例如,文献[16]利用2,5-噻吩二羧酸(H2NDC)、N,N′-双(3-吡啶基)噻吩-2,5-二甲酰胺(La)以及镍离子构筑了一个二维格子状配位聚合物[Ni(La)(NDC)(H2O)2]. 在该配合物中,NDC2-展现的是桥连配位模式. 本文中的3,4-噻吩二羧酸采取单齿配位模式来构筑配合物比较少见.此外,由于传统的吡嗪、4,4′-联吡啶等桥连含氮配体具有极强的刚性和固定的配位趋向, 因此,配位模式比较单一. 本文中的L配体中间成功引入2个酰胺基团, 其一定的扭转能力促使L配体展现出半刚性的配位特性, 并最终导致了一维柱状配合物的形成.
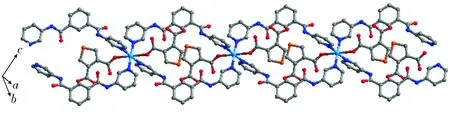
图2 配合物[Cu(L)2(3,4-HTDC)2]的一维结构图Fig.2 1D structure of the complex [Cu(L)2(3,4-HTDC)2]
2.2 红外光谱(IR)分析
配合物[Cu(L)2(3,4-HTDC)2]的红外光谱如图3所示.其中,吡啶环的特征吸收峰大约为1 539 cm-1[21].C—S键的吸收峰大致在1 238 cm-1处,在1 670 cm-1处的吸收峰可归因于3,4-HTDC-中羧基的不对称和对称振动吸收[22].L配体中酰胺基的振动吸收出现在621 cm-1处[24].上述IR表征表明含氮酰胺配体L和噻吩羧酸均有效地参与了配位转化到配合物中.

图3 配合物[Cu(L)2(3,4-HTDC)2]的红外光谱Fig.3 IR spectrum of [Cu(L)2(3,4-HTDC)2]
2.3 纯度分析
配合物[Cu(L)2(3,4-HTDC)2]的粉末-X射线衍射图谱(PXRD)如图4所示.主要的衍射峰出现在8.82°、11.80°、14.92°、17.34°.体相样品实验值和理论值衍射峰位置较好的吻合度证明了样品较好的纯度[23].
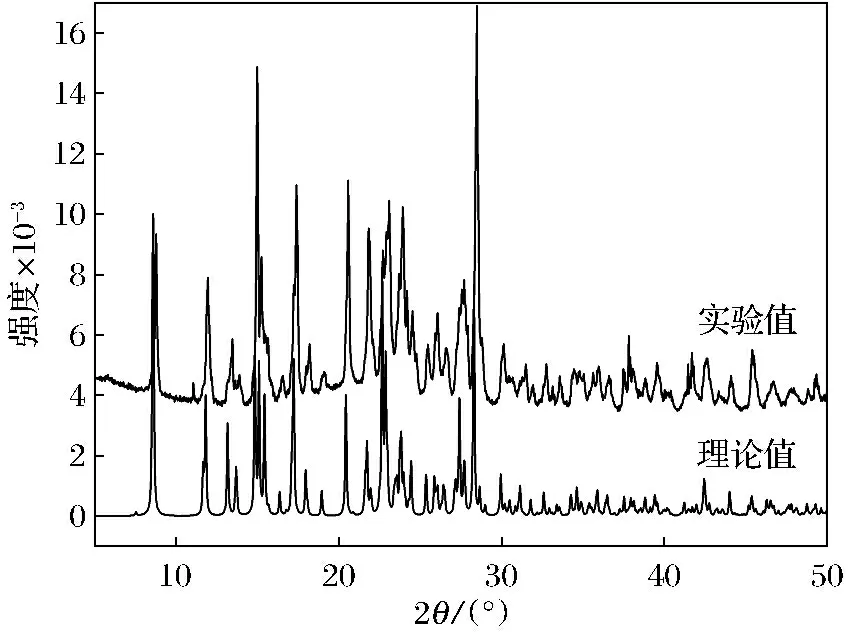
图4 配合物[Cu(L)2(3,4-HTDC)2]的粉末-X射线衍射谱Fig.4 Powder X-ray diffraction patterns of [Cu(L)2(3,4-HTDC)2]
2.4 热稳定性(TG)分析
图5为配合物[Cu(L)2(3,4-HTDC)2]的热重曲线,w为失重率, 从图中可以看到,从室温到225 ℃,配合物几乎没有失重,从225~245 ℃,配合物发生了一次明显且快速失重,从大约250 ℃开始继续发生相对前一次较慢的失重,连续的两种类型的失重可归因于L配体和3,4-HTDC-的流失,即配位骨架的塌陷.
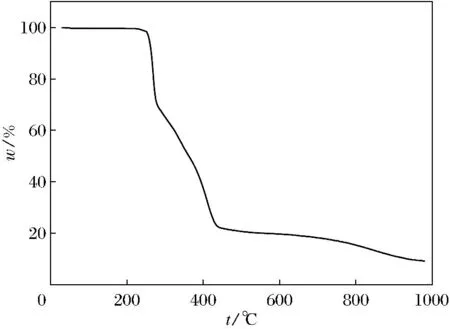
图5 配合物[Cu(L)2(3,4-HTDC)2]的热重曲线Fig.5 TG curve of complex [Cu(L)2(3,4-HTDC)2]
2.5 电化学性质
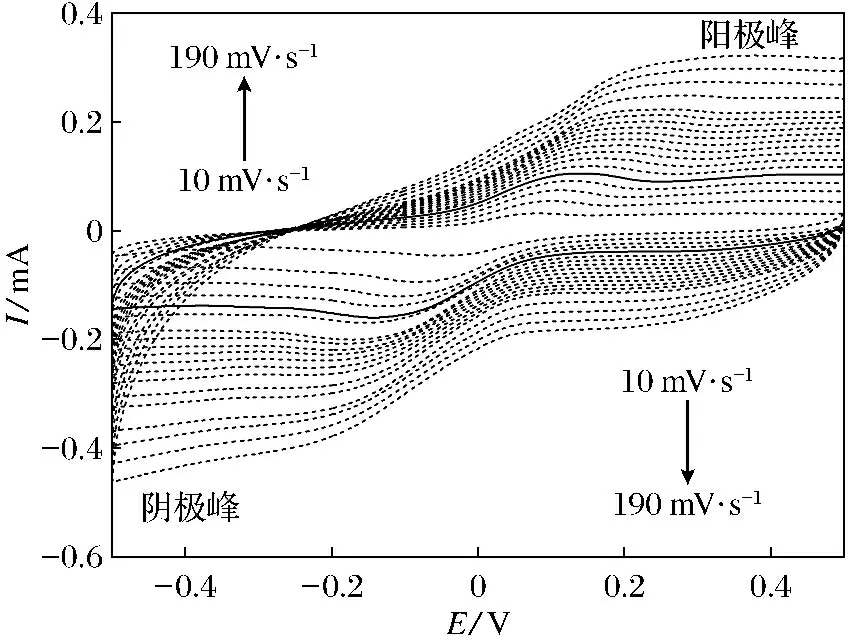
图6 10~190 mV·s-1扫速下[Cu(L)2(3,4-HTDC)2]-CPE的循环伏安图Fig.6 Cyclic voltammogram of [Cu(L)2(3,4-HTDC)2]-CPE at the scan rates of 10~190 mV·s-1
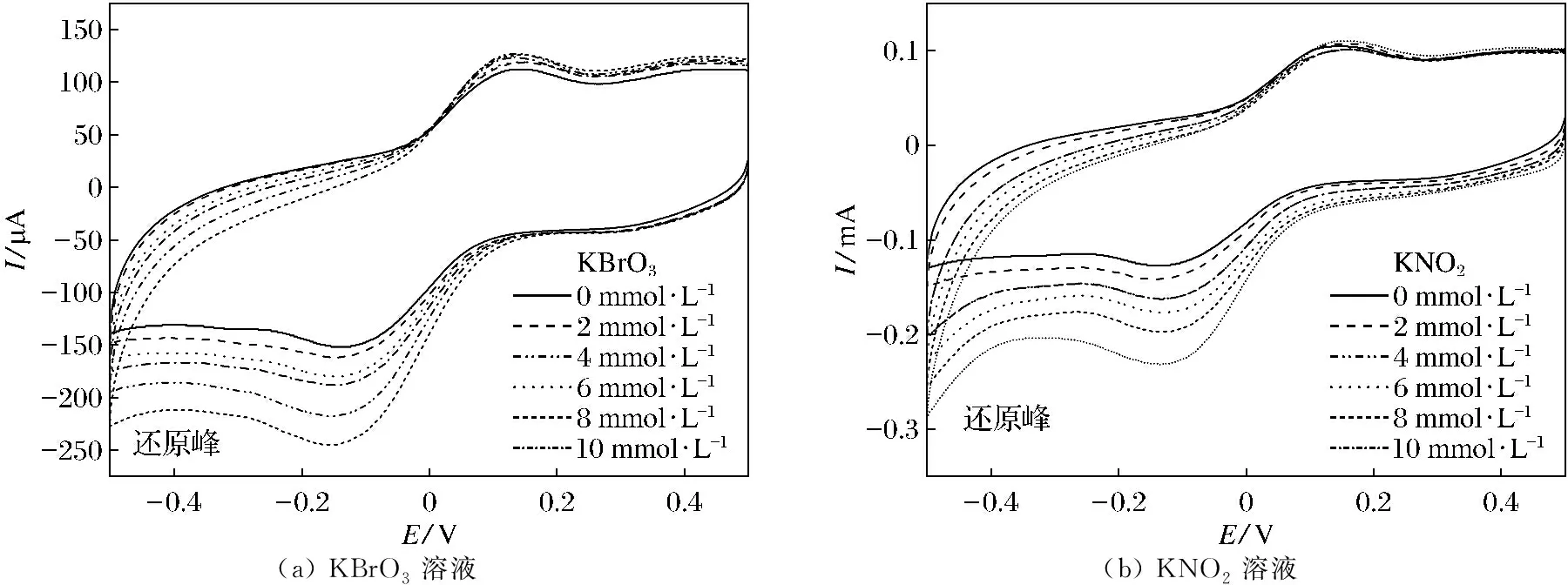
(a) KBrO3溶液(b) KNO2溶液图7 [Cu(L)2(3,4-HTDC)2]-CPE在不同浓度的KBrO3溶液与KNO2溶液中的循环伏安图Fig.7 Cyclic voltammogram of [Cu(L)2(3,4-HTDC)2]-CPE in KBrO3 and KNO2buffer solutions of different concentrations
3 结 论