GPD1酶在毕赤酵母中的表达及纯化
2020-10-29江福能朱莹莹张玉婷杨盛帮吴永定谭惠静钟惟德
江福能,朱莹莹,张玉婷,杨盛帮,吴永定,谭惠静,钟惟德
(1.华南理工大学医学院附属第二医院(广州市第一人民医院)中心实验室,广东 广州 510180; 2.广州医科大学南山学院南山班, 广东 广州 511436)
3-磷酸甘油脱氢酶(glycerol-3-phosphate dehydrogenase 1)是甘油代谢途径中的关键限速酶[1],可与烟酰胺腺嘌呤二核苷酸(NADH)一同参与代谢反应,将糖酵解的中间产物磷酸二羟丙酮和NADH催化反应生成3-磷酸甘油和NAD+,以作为三酸甘油酯合成的G-3-P骨架[2-3],直接决定了葡萄糖分解代谢中甘油合成方向的物质流分配量和甘油合成水平[4]。GPD1广泛分布于组织中,包括大脑的各个区域和内部组织,其中肠系膜脂肪、皮下脂肪和十二指肠脂肪含量最高[5]。
在近期的研究中验证了GPD1在人乳腺癌部分亚型中的表达显著下降, GPD1是一种优秀的人类乳腺癌标志物,且GPD1的表达与乳腺癌的预后有明显的相关性,将GPD1表达质粒转入乳腺癌细胞中,发现其增殖、迁移和侵袭能力明显下降;实验选择了21种类型的人类癌症,其中7种癌症也表现出了与GPD1表达水平一定的相关性;且实验进一步阐述了GPD1可能是miR-370的直接靶点[6],miR-370的调控已在各种癌症中被报道[7-9]。
大量表达纯化GPD1酶,可为进一步的机制研究和未来可能的肿瘤治疗方向的研究与应用奠定基础。本研究提取人细胞总RNA并逆转录成cDNA,采用特异引物通过PCR扩增GPD1基因,构建表达质粒pPICZα-C-gpd1,将其电转入毕赤酵母X-33中,并通过甲醇诱导表达、镍柱分离纯化,建立了GPD1酶的基因工程制备方法。
1 材料和仪器
1.1 材料
菌株和质粒载体:毕赤酵母X33和表达载体pPICZα-C(由广东省农业科学院王晓虎副研究员馈赠),大肠杆菌DH5α(购自北京全式金生物技术有限公司)。PCR相关试剂(购自北京全式金生物技术有限公司);限制性内切酶EcoRⅠ、XbaⅠ、NheⅠ和SalⅠ(购自NEB(北京)有限公司);质粒小量提取试剂盒(购自广州欣研生物科技有限公司);酵母基因组提取试剂盒(购自天根生化科技(北京)有限公司);DNA分子量marker(购自Takara公司);ClonExpress Ⅱ One Step Cloning Kit(购自南京诺唯赞生物科技有限公司);酵母粉、胰蛋白胨(购自OXOID公司),Zeocin、His标签蛋白琼脂糖纯化树脂(购自上海翊圣生物科技有限公司);蛋白质分子量marker[购自赛默飞世尔科技(中国)有限公司];酵母蛋白提取试剂盒[购自生工生物工程(上海)股份有限公司];考马斯亮蓝快速染色液和BCA蛋白浓度测定试剂盒(增强型,购自上海碧云天生物技术有限公司)。其他试剂均为国产分析纯。
1.2 仪器
PCR仪(购自杭州朗基科学仪器有限公司),凝胶成像分析系统、电泳仪(购自上海天能科技有限公司),微量分光光度计(购自杭州奥盛仪器有限公司),点转仪(购自Eppendorf公司),全波长酶标仪(购自赛默飞世尔科技(中国)有限公司),台式高速冷冻离心机(购自长沙湘仪离心机仪器有限公司)。
2 方法
2.1 GPD1基因的PCR扩增
提取人细胞的总RNA并且逆转录成的cDNA,以此为模板,采用一对GPD1基因的特异引物:GPD1-F(5′-GGCTGAAGCATCGATGAATTCTGCTAGC AAGAAAGTCTGCATTG-3′)和GPD1-R(5′-GAG ATGAGTTTTTGTTCTAGCATATGTTCTGGATGATTC TGCAGG-3′),对GPD1基因进行PCR扩增,PCR程序为:95 ℃ 3 min;95 ℃ 30 s,53 ℃ 30 s,72 ℃ 60 s,进行35个循环;72 ℃延伸10 min。PCR产物经琼脂糖凝胶电泳检测,切胶回收纯化PCR产物中的目的条带。
2.2 表达质粒pPICZα-C-gpd1的构建
将pPICZαC载体用EcoRⅠ 和XbaⅠ双酶切,经切胶回收,利用ClonExpress Ⅱ One Step Cloning Kit将回收纯化的PCR产物连接到pPICZαC载体上,转入大肠杆菌感受态细胞DH5α 中,用含25 μg/mL Zeocin的LB培养基37 ℃培养约16 h,挑取单菌落扩大培养,用质粒小提试剂盒提取pPICZα-C-gpd1质粒,用NheⅠ和SalⅠ双酶切验证,并且进行测序检测。
2.3 电击转化pPICZα-C-gpd1及阳性转化子的鉴定
pPICZα-C-gpd1质粒用Sac I线性化处理,使用电转仪将线性质粒转化入毕赤酵母X-33感受态细胞中,电转参数为电压1 200 V,时间5 ms。加入600 μL预冷的1 mol/L的山梨醇,30 ℃静置1~2 h后,涂布于含100 μg/mL Zeocin的YPDS培养基上,28 ℃培养3 d。
选取长势较好的单菌落,提取其基因组DNA作为模板,用α-factor-SF:5′-GCATCCTCCGCATTAGCTG-3′和GPD1-SR:5′-GTTCCCGGAGCCTACAATG-3′进行PCR扩增,PCR程序为:95 ℃ 3 min;95 ℃ 30 s,53 ℃ 25 s,72 ℃ 30 s,进行35个循环;72 ℃延伸5 min。琼脂糖凝胶电泳检测PCR产物。
2.4 甲醇诱导毕赤酵母表达GPD1
选取阳性毕赤酵母转化子,接种到5 mL YPD培养基中,28~30 ℃培养过夜,全部转入100 mL BMGY培养基中,加入抗生素Zeocin至浓度为2 μL/mL,250 r/min,30 ℃振荡培养16~18 h至A600nm=2.0~6.0。将培养液分装至50 mL离心管中,4 000 r/min,4 ℃离心10 min,弃上清,收集菌体,用灭菌水清洗2次,BMMY培养液清洗1次,加入20~30 mL的BMMY培养液重悬菌体沉淀,将菌液倒入具有400 mL培养基的2 L锥形瓶中,每瓶加入2 mL甲醇,于30 ℃,250 r/min培养诱导蛋白表达,每24 h向瓶中加入4 mL甲醇,诱导96 h;培养液经8 000 r/min离心10 min,用酵母蛋白提取试剂盒提取菌体中的总蛋白,上清液和菌体总蛋白用15%的SDS-PAGE凝胶电泳,考马斯亮蓝染色,检测GPD1酶的表达情况。
2.5 重组GPD1酶的纯化
上清液用透析法将溶液换为PBS (pH7.4)。用0.22 μm滤膜过滤后,利用Profinia蛋白纯化系统上样于His标签蛋白琼脂糖纯化树脂,PBS洗涤去除杂蛋白,梯度咪唑洗脱目的蛋白,获得纯化的GPD1酶,用考马斯亮蓝染色检测纯化结果。
2.6 检测纯化蛋白的浓度
将BCA蛋白浓度测定试剂盒(增强型)中的A液和B液按50∶1的体积比加到离心管中,混匀,得到工作液。把195 μL工作液加至96孔板中,每孔加入5 μL标准蛋白或者纯化蛋白,混匀,37 ℃温浴30 min。然后用酶标仪测定吸光度值(波长选择562 nm),利用标准曲线计算样品的蛋白浓度。
3 结果
3.1 GPD1基因的PCR扩增结果
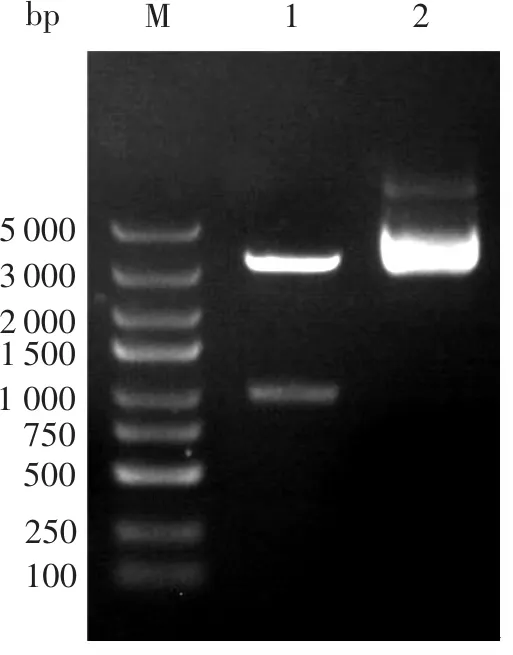
经PCR扩增后,得到GPD1基因,经过琼脂糖凝胶电泳检测,最亮的条带略大于1 000 bp,与理论大小(1 086 bp)相符(图1)。

M. Marker; 1. PCR产物1; 2. PCR产物2; 3. PCR产物3。
3.2 重组表达质粒pPICZα-C-gpd1的构建及鉴定结果
将切胶回收纯化的PCR产物与表达载体pPICZα-C用EcoRⅠ和XbaⅠ进行双酶切后用T4 DNA连接酶连接,得到重组表达载体pPICZα-C-gpd1(图2)。为了确定重组载体是否构建成功,使用NheⅠ和SalⅠ对重组载体进行双酶切,用1%琼脂糖凝胶电泳检测,酶切产物大小与理论大小(1 086 bp和3 499 bp)相符(图3)。DNA测序结果进一步证明重组载体pPICZα-C-gpd1构建成功,且未发生碱基突变。
(a) (b)
bpM1275050050003000200015001000250100
3.3 酵母阳性转化子的鉴定结果
用电击转化法,把经SacI线性化的pPICZα-C-gpd1质粒转入毕赤酵母X-33感受态细胞中,在含有Zeocin的YPDS培养基上培养至长出单菌落;分别提取长势好的酵母转化子的基因组DNA,并以此为模板,用引物α-factor-SF和GPD1-SR进行PCR扩增,得到一条比250 bp略大的特异性条带(图4)。结果符合理论值(276 bp),证实pPICZα-C-gpd1已成功整合入酵母基因组中。
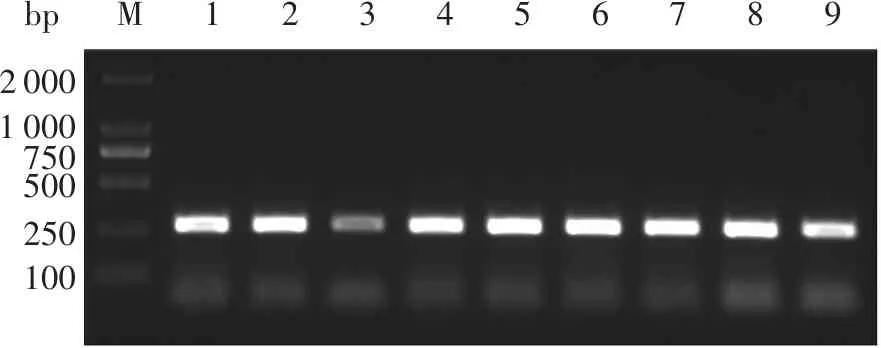
bpM12345678920001000750500250100
3.4 GPD1的表达和纯化
诱导后的上清液、诱导后的酵母总蛋白和纯化后的重组GPD1酶分别经SDS-PAGE凝胶电泳后,用考马斯亮蓝染色检测,由检测结果(图5)可见上清液中的重组GPD1酶(37 500)比菌体中的多,表明重组GPD1酶主要被分泌到菌体外。使用Image-Pro Plus软件分析图5中条带的灰度值,纯化后的重组GPD1酶的纯度为90.83%。

M. Marker; 1.未纯化的培养液上清; 2.酵母总蛋白; 3.纯化后的培养液上清。
3.5 GPD1重组酶的产量
利用BCA法测得纯化蛋白的浓度为166.18 μg/mL,则纯化后的重组GPD1酶的浓度为150.94 μg/mL,总共纯化得到1.51 mg重组GPD1酶,重组GPD1酶的收率为3.55 mg/L。
4 讨论
毕赤酵母表达系统是一种高效表达异源蛋白的真核表达系统,具有许多优点,例如:操作简易、易于培养、生长速度快、表达量高、不易形成包涵体、酵母表达载体含分泌型信号肽利于胞外表达、高密度发酵生产成本低,并且与大肠杆菌相比,不会引入内毒素,该系统的安全性已得到美国 FDA 认可[10-12]。
pPICZα-C是一种常用的毕赤酵母蛋白表达载体,其含有Zeocin抗性基因,可以筛选获得拷贝数高的转化子,具有AOX1启动子,能够利用甲醇诱导高水平表达目的蛋白,该载体本身含有α-因子分泌信号肽,可以将目的蛋白分泌到胞外, 方便了后续的分离纯化[13]。通过载体上的3个信号切除位点,该信号肽被自动切除。载体自身带有 C-Myc和C-His 标签,便于目的蛋白的检测和纯化。
本研究构建了毕赤酵母表达质粒pPICZα-C-gpd1,成功筛选出阳性转化子,利用甲醇诱导和镍柱纯化获得了分泌表达的GPD1酶,纯度为 90% 以上,建立了毕赤酵母分泌表达GPD1酶的方法,为后续的GPD1肿瘤机制研究和靶向GPD1的抗肿瘤应用治疗奠定了基础。
