海口地区37例中药注射剂严重不良反应报告分析
2020-10-29容敏婷
容敏婷
(海口市药品不良反应监测中心,海南 海口 570300)
药品不良反应(ADR)监测是药品上市后临床安全性评价的重要监测手段,自1961年“反应停”事件后,英国于1963年设立药品安全委员会,实行ADR自发呈报制度即黄卡系统(Yellow Card System),采用黄色卡片以提高医务人员对ADR的警惕性,以此作为药品上市后监测手段之一。随着中药注射剂在临床上被广泛使用,“鱼腥草注射液”、“喜炎平注射液”等多个品种因发生严重不良事件或存在严重ADR已经引起了社会的广泛关注。本文通过收集、分析我市近3年中药注射剂ADR报告数据信息,掌握中药注射剂在临床的使用情况,重点关注非预期ADR,即新的药物ADR,这类ADR在上市前临床试验中往往未被认识,在上市使用于临床后逐渐被发现,是上市后药品ADR监测的重要内容。笔者通过对海口市药品ADR监测中心2017年1月至2019年12月收到的37例中药注射剂严重ADR报告及其特点进行归纳分析,为临床中药注射剂管理提供科学依据。
1 资料与方法
1.1 资料来源
通过国家药品不良反应监测系统(海口数据库),对海口市2017年1月至2019年12月上报的严重ADR报告进行检索,从中选取怀疑药品为中药注射剂的报告,剔除关联性评价为“无法评价”的报告,再对报告进行查重排除重复报告,最终3年内共检索到37例中药注射剂严重ADR报告纳入统计分析。
1.2 统计方法
采用回顾性研究的方法对37例中药注射剂严重ADR报告进行汇总和统计分析,包括ADR报告分布、患者的基本情况、涉及药物品种的分布与临床表现,新的、严重药品ADR以及患者联合用药等方面,再结合药品说明书进行详细分析与讨论。
2 结果
2.1 中药注射剂发生严重ADR的情况
我市近3年中药注射剂严重ADR报告分布较为平均,37例报告中新的、严重ADR报告占比达78.4%。见表1。

表1 近3年中药注射剂严重ADR报告分布
2.2 患者的性别与年龄分布
37例严重报告中男性患者的药品ADR发生率略高于女性;患者年龄分布为:无10岁以下的小龄患者,最集中的是≥55岁年龄段,占比高达70.3%,患者年龄最小25周岁,最大89岁,3例年龄不详。见表2。

表2 患者年龄和性别分布情况Table 2 Distribution of age and gender in patients
2.3 发生ADR的时间分布
据统计分析发现,有10例患者在首次用药10 min内发生严重ADR,其中7例为过敏性休克,属于速发型超敏反应;37例报告中首次用药当天即发生严重药品ADR有31例,占比高达83.7%,最慢的在用药17d后发生。见表3。
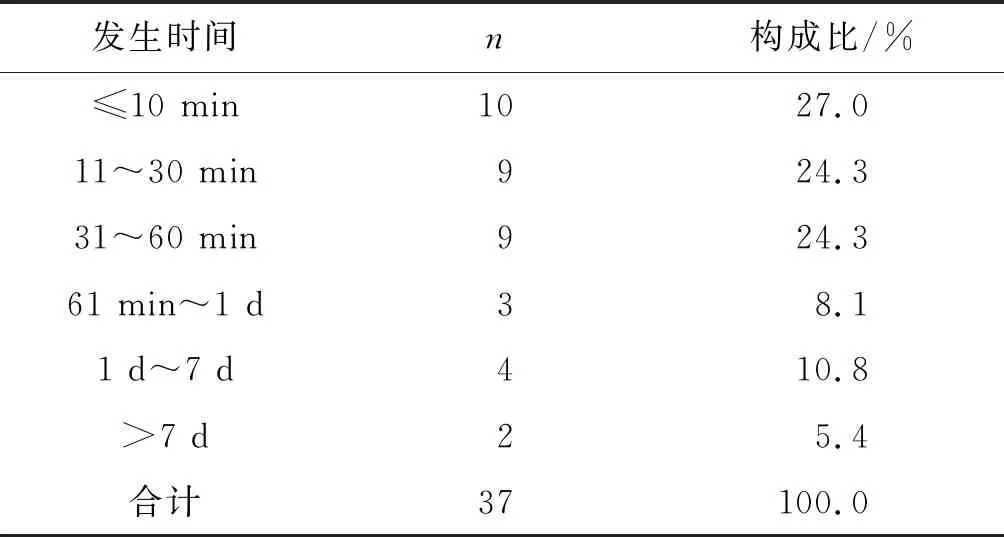
表3 37例严重ADR发生时间分布Table 3 Time distribution of severe ADR in 37 cases
2.4 引起严重ADR的药物品种与临床表现
37例中药注射剂严重ADR报告共涉及19个品种,其中注射用血栓通(冻干)和注射用血塞通(冻干)构成比最高,占总例数32.4%,均属于活血类中药注射剂;严重ADR发生例数排名前3位的7个品种占总例数67.6%。中药注射剂所致严重ADR主要以过敏反应为主,包括过敏性休克(9例次),严重过敏样反应(9例次),其中注射用血塞通(冻干)、疏血通注射液均发生了3例严重过敏反应,临床使用时应加以关注。最为值得注意的是高热、寒战出现例次最高,有17例次。见表4。
2.5 新的、严重ADR涉及的药品及临床表现
参照药品说明书,37例严重报告中有29例出现了药品说明书上未载明的新的ADR,涉及16个品种,新的严重ADR涉及的中药注射剂及临床症状见表5。
2.6 患者联合用药的情况
37例中有4例患者联合用药,情况如下:1.患者静脉滴注注射用头孢呋辛钠2.5 g结束,冲管后静脉滴注喜炎平注射液150 mg后患者出现高热(最高达40 ℃)、发冷、寒战、头晕、头痛、呕吐等严重过敏样反应;2.患者静脉滴注红花黄色素氯化钠注射液结束,未冲管继续静脉滴注注射用二丁酰环磷腺苷钙40 mg后患者出现过敏性休克的临床症状;3.患者静脉滴注注射用丹参多酚酸盐200 mg,再加口服单硝酸异山梨酯缓释片50 mg及非洛地平缓释片5 mg,用药1 d后患者出现过敏性休克的临床症状;4.患者于2017年10月13日至11月3日每天开始给予使用雷贝拉唑肠溶胶囊20 mg bid保护胃黏膜治疗,10月13日开始给予肌内注射用鼠神经生长因子至10月28日停药,10月25日开始给予静脉注射苦碟子注射液40 mL+NS 250 mL,至10月27日停药,11月4日加用左氧氟沙星滴眼液,患者于11月5日出现大疱性表皮松解型重症药疹的严重ADR临床症状。联合用药的严重ADR发生情况见表6。

表4 引起严重ADR的品种及临床表现Table 4 Types and clinical manifestations of severe ADR

表5 新的严重ADR涉及的药品及临床表现Table 5 Drugs and clinical manifestations of new severe ADR

表6 患者联合用药情况Table 6 Drug combination of patients
3 讨论
中药注射剂指的是以中医药理论为指导,采用现代的科学技术和方法,从中药、天然药物的单方或者是复方中提取有效物质从而制成注射液[1]。中药注射剂不仅保留着传统的中医药特色,同时具有生物利用度高、起效快等特点[2],与化学药联合使用优势互补。
3.1 ADR发生人群特点
海口中心在2017至2019年共接收到37例中药注射剂引起的严重ADR报告,本次统计分析的报告仅代表一定时间段和地区的药品ADR发生情况,也可能存在漏报或信息有偏差等一定的局限性,但统计分析整个海口地区的中药注射剂严重ADR发生情况相比单一一个医疗机构的数据而言,对了解某一地区中药注射剂ADR的发生情况更具有参考价值[3]。
本次统计的37例严重报告中无10岁以下的小龄患者,这可能与国家近几年对多种中药注射剂禁用于新生儿、儿童等人群有关(如柴胡注射液,双黄连注射液等)[4];陈浩等[5]研究显示2013年1月至2017年12月北京地区756例中药注射剂ADR报告中有415例为60岁以上年龄患者,占54.89%,该数据与本次研究结果基本一致。由此可见,中药注射剂发生严重药品ADR多为老年患者,这主要由两方面原因,一是55岁以上中老年群体对中医中药接受度最高的年龄段群体[6],二是老年人共患疾病多,代谢机能减退,对药物的耐受能力下降,多种药物联合使用更容易发生药品ADR。
3.2 患者发生ADR的时间及转归情况
37例报告中首次用药1 h即发生严重药品ADR有28例,占比高达75.7%,这与文献报道的中药注射剂ADR多为速发型一致[7]。《中药注射剂临床使用基本原则》第7条中指出“应加强用药监护。用药过程中,应密切观察用药反应,特别是开始30分钟。”因此,患者开始用药60 min内是ADR的高发阶段,医护人员需密切关注患者输液后的情况。
37例严重报告中无死亡病例,36例患者经医护人员采取停药及抢救措施后已逐渐好转,但有1例出现过敏性休克的患者在遵医嘱给予停药及肾上腺素注射液1 mg静脉推注、甲强龙4 mg静脉推注等抢救措施后症状仍未改善,经与家属协商后患者已办理出院。
3.3 中药注射剂致严重ADR的情况分析
严重ADR发生例数排名前3位的7种中药注射剂中,从药品类别上分析,有5种属于活血化瘀药,这可能与该类药物具有活血化瘀、通脉活络等较广泛的药理作用[8],医院老年心脑血管病患者使用该类药物较多有关[9]。据国家药品ADR监测年度报告(2017—2019年)[10-12]显示,近几年中药严重ADR/事件报告的例次数排名第一位的类别均为活血化瘀药。因此,临床应用中必须高度重视该类药物,严格按照药品说明书使用,严禁混合配伍,谨慎联合用药。
严重ADR往往不是只有单个临床表现,而是多个严重的临床表现同时出现,以致危及患者生命或造成其他严重不良后果[13]。本次统计的37例中药注射剂所致严重ADR主要有过敏性休克,严重过敏样反应,高热(最高达40 ℃),血压升高(最高达228/122 mmHg)等,累及器官或系统主要以免疫功能絮乱、感染,心血管系统及全身性损害为主。对于一些罕见的药品严重ADR可能因药品说明书未载明而容易被忽略,医护人员应结合患者的基础疾病、个人体质等因素密切监测患者用药后反应,降低药品ADR发生风险。
新的药物ADR的判定标准依据《药品不良反应报告和监测管理办法》规定:“是指药品说明书中未载明的ADR,说明书中已有描述,但ADR发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品ADR处理。”如:注射用益气复脉(冻干)、舒肝宁注射液等药品说明书上载明有发热的ADR,但患者均出现39.3~40.3 ℃的高热症状,可能会累及全身多个系统受到损害;复方苦参注射液、银杏二萜内酯葡胺注射液等药品说明书上载明偶见皮疹等过敏反应,但患者用药后出现了过敏性休克或严重过敏样反应,根据规定这些应定义为新的ADR报告。
随着近几年国家药监部门相继发布多种中药注射剂修订说明书的声明,被限制使用以及修订说明书的品种越来越多,但从新的严重报告数量占比可侧面反映出部分中药注射剂说明书描述依然不够全面,对药品安全性相关项以及风险描述还不够完善[14],导致医护人员在临床使用过程中没有引起足够的重视,因此,我们应不断强化中药注射剂上市后的安全性再评价,完善药品说明书,规范临床合理安全用药。
3.4 联合用药的情况分析
临床上将中药注射剂与其他药品联合使用是为了达到中西药联用的协同增效作用[15],根据《中药注射剂临床使用基本原则》第4条指出“谨慎联合用药,如确需联合使用其他药品时,应谨慎考虑与中药注射剂的间隔时间以及药物相互作用等问题。”因此,临床上如确需联合使用,在换药时一定要先用足量冲管液体做间隔冲洗或更换新的输液器,并保持一定的时间间隔[16]。在本次研究中发现,有1例患者在静脉滴注红花黄色素氯化钠注射液结束后并未冲管就继续静脉滴注注射用二丁酰环磷腺苷钙,在换药5 min后患者就出现双侧前臂皮肤瘙痒、潮红,后突发瘫软无力、呼之不应,伴大汗,血压测不出,无法言语应答等ADR。因此,医护人员在联合使用中药注射剂时务必严格按照药品说明书,生产企业更应不断完善临床试验研究工作,对药品说明书的安全性相关项及风险描述加快更新,增加相关操作警示语以提高医务人员对ADR的警惕性,减少差错,降低ADR的发生风险,保障患者的生命安全。
3.5 预防措施
2017年,国家药品监督管理部门发布了红花注射液和喜炎平注射液2个产品召回和暂停销售的公告;2018年,国家药品监督管理局决定对双黄连注射剂〔双黄连注射液、注射用双黄连(冻干)、双黄连粉针剂〕和血栓通注射剂〔血栓通注射液和注射用血栓通(冻干)〕等中药注射剂说明书增加警示语,并对【不良反应】、【禁忌】和【注意事项】项进行修订;2019年,国家药品监督管理局发布了丹香冠心注射液、蟾酥注射液等药品说明书修订的公告,增加或完善说明书中警示语、不良反应、注意事项、禁忌等安全性信息。由此可见,近几年国家已对中药注射剂不断采取相关风险控制措施,医护人员面对日新月异的临床医学知识更新与变动,需要及时更新知识结构,拓展知识储备,充分了解中药注射剂的ADR及其带来的危害,熟练掌握药品ADR的判断和救治,做到及时发现,及时处理,加强监测,做好防范措施[17]。
