β-葡萄糖苷酶生物转化刺梨槲皮素糖苷的工艺优化
2020-10-28余奕宏顾苑婷丁筑红陈思奇宋煜婷
余奕宏, 顾苑婷, 丁筑红, 陈思奇, 宋煜婷, 王 翼
(贵州大学 酿酒与食品工程学院/国家林业和草原局刺梨工程技术研究中心/贵州省农畜产品贮藏加工重点实验室, 贵州 贵阳 550025)
刺梨中天然黄酮类化合物大部分是以与糖结合的黄酮糖苷的形式存在,是植物的次生代谢产物[1],研究证明,黄酮结合型糖苷药物活性远远低于游离的苷元,通过去糖基定向修饰黄酮类化合物的分子结构可以发挥其特定功能[2]。生物转化去糖基是最经济绿色的途径,目前利用最多的为β-葡萄糖苷酶[3],但是不同来源的β-葡萄糖苷酶对底物水解的酶性能相差很大且安全性存疑[4-5]。因此,选择合适来源的β-葡萄糖苷酶和提升其对黄酮类化合物的水解效果成为研究的重点。刺梨中黄酮类物质作为其重要的活性成分[6],目前研究缺乏系统和深度,相关报道仅限于黄酮含量及检测方法、提取技术及黄酮粗提物功能评价[7-8]等,对刺梨黄酮类化合物的生物转化方面未见报道。
目前报道较多的常用于食品的β-葡萄糖苷酶主要来源于杏仁[9]、木霉(Trichoderma)[10]和乳酸菌(Lactobacillus)[11]。本项目组前期研究发现,嗜酸乳杆菌(Lactobacillusacidophilus) GIM1.208β-葡萄糖苷酶释放刺梨槲皮素(Que2)含量为处理前原料的5.42倍。因此本实验通过分析木霉、杏仁及嗜酸乳杆菌3种来源的β-葡萄糖苷酶酶解刺梨槲皮素-3-O-芸香糖苷(Rut)、槲皮素-3-O-鼠李糖苷(Que)和槲皮素-3-O-葡萄糖苷(Iso)的黄酮苷元特性及酶解条件,筛选较优β-葡萄糖苷酶,探讨提高刺梨黄酮苷元释放能力的生物转化途径,以期为刺梨黄酮的研究开发提供理论基础,为药物和功能食品提供丰富的资源。
1 材料与方法
1.1 材料与试剂
刺梨:贵农5号种植品种,摘于贵州省龙里县,新鲜洁净,大小均匀无霉烂,密封装袋后冻藏于-20 ℃的冰箱备用。
试剂:槲皮素标准品、槲皮素-3-O-鼠李糖苷标准品、槲皮素-3-O-葡萄糖苷标准品、槲皮素-3-O-芸香糖苷标准品,纯度均大于等于98.0%,上海源叶生物科技有限公司;对硝基苯酚,南京大唐化工有限责任公司;对硝基苯酚-β-D葡萄糖苷(p-NPG)、杏仁β-葡萄糖苷酶,美国Sigma公司;嗜酸乳杆菌GIM.1.208,贵州轻化工中心;木霉β-葡萄糖苷酶(Trichodermaβ-glucosidase),江苏锐阳生物科技有限公司;无水乙醇、磷酸,均为分析纯,济南明星化工有限公司;甲醇、乙腈,均为色谱纯,美国Tedia公司;其他试剂均为分析纯。
1.2 仪器与设备
1260型高效液相色谱仪(配有DAD检测器/紫外-荧光检测器),美国Agilent公司;SpectraMAX190型光吸收酶标仪 ,美谷分子仪器(上海)有限公司;TGL20M型台式高速冷冻离心机,诸城鼎力机械有限公司。
1.3 实验方法
1.3.1液相色谱条件
参考文献[12],色谱柱为ACI C18(250 mm×4.6 mm),流动相为乙腈-0.4%磷酸水溶液(体积比28∶72),流速1.0 mL/min,柱温25 ℃,检测波长360 nm,进样量10 μL。
1.3.2酶比活力的测定
酶比活力的测定采用丁小娟等[13]的方法,即以p-NPG为底物,在β-葡萄糖苷酶作用下水解成p-NP(对硝基苯酚)和葡萄糖,利用p-NP在碱性条件下显色的原理,测定β-葡萄糖苷酶的酶活力。1 mL酶液1 min酶解1 μmolp-NPG产生1 μmolp-NP所需的酶量,定义为一个酶活力单位,以U/mL表示。
1.3.3菌种活化培养基配制
MRS培养基:参照丁小娟等[13]配制方法。
菌种活化:MRS活化培养液121 ℃,0.1 MPa灭菌30 min,接入嗜酸乳杆菌GIM.1.208,37 ℃静置培养24 h备用。
1.3.4标准溶液的配制
称取槲皮素4.5 mg,槲皮素-3-O-芸香糖苷、槲皮素-3-O-葡萄糖苷、槲皮素-3-O-鼠李糖苷标准品各5.0 mg加甲醇溶解,于25 mL容量瓶中定容,得到质量浓度分别为0.18、0.20、0.20、0.20 mg/mL标准品储备液,分别吸取0、1.0、2.0、4.0、8.0、16.0 mL定容至20 mL容量瓶中,进行HPLC分析。以HPLC测得的峰面积为y轴,标准品质量浓度为x轴,绘制标准曲线。
1.3.5样品溶液的制备
将刺梨真空冷冻干燥后粉碎,得刺梨干粉备用。称取适量刺梨粉于锥形瓶中按液料比20∶1 (mL/g)加入体积分数70%乙醇,300 W、50 ℃条件下超声40 min,石油醚去除脂溶性色素,4 000 r/min 离心5~10 min,收集上清液浓缩,加入预处理好的HPD600树脂层析柱上进行纯化富集,吸附饱和后,用体积分数70%乙醇洗脱,收集洗脱液,制得纯化样品溶液,灭活内源酶备用。
1.3.6不同来源β-葡萄糖苷酶对槲皮素糖苷转化率的测定
参照文献[12]适当修改。以不加任何酶的体系为空白组,其他实验组分别加入1 U/mL的3种β-葡萄糖苷酶[14]。反应体系200 μL,包含样品液20 μL、磷酸钠缓冲溶液(pH值5,50 mmol/L)120 μL、酶液60 μL。在50 ℃,pH值5的条件下分别反应10、20、30、40、50、60 min,反应完成后冰浴3 min终止反应,加入等体积甲醇,样品经0.45 μm滤膜过滤,取10 μL进行HPLC检测,根据式(1),计算各β-葡萄糖苷酶酶解槲皮素糖苷的转化率。
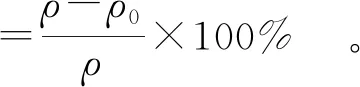
(1)
式(1)中:ρ为酶解前槲皮素糖苷质量浓度,μg/mL,ρ0为酶解后剩余糖苷质量浓度,μg/mL。
1.3.7杏仁β-葡萄糖苷酶水解槲皮素糖苷单因素实验
反应体系200 μL:样品液20 μL、磷酸钠缓冲溶液(pH值5,50 mmol/L)120 μL、酶液60 μL。分别考察酶解时间(10、20、30、40、50、60 min)、酶解pH值(4.0、4.5、5.0、5.5、6.0、6.5、7.0)、酶解温度(30、35、40、45、50、55、60 ℃)、酶用量(酶与底物质量比)(0.030%、0.040%、0.050%、0.075%、0.100%、0.200%)对糖苷转化率的影响,反应完成后冰浴3 min终止反应,加入等体积甲醇,样品经0.45 μm滤膜过滤,取10 μL进行HPLC检测[12,15]。
1.3.8响应面优化试验
在最优来源的杏仁β-葡萄糖苷酶水解条件单因素实验结果基础上,进行 Box-Behnken 试验,以槲皮素-3-O-芸香糖苷转化率(Y1)、槲皮素-3-O-鼠李糖苷转化率(Y2)、槲皮素-3-O-葡萄糖苷转化率(Y3)为评价指标,进行四因素三水平Box-Behnken试验,因素与水平见表1。
1.4 数据处理
每组实验重复3次,采用SPSS 22.0软件进行显著性分析,Design-Expert 8.0.6软件设计响应面试验方案,建立数学模型并进行多元回归分析,
Origin 8.0软件制图。
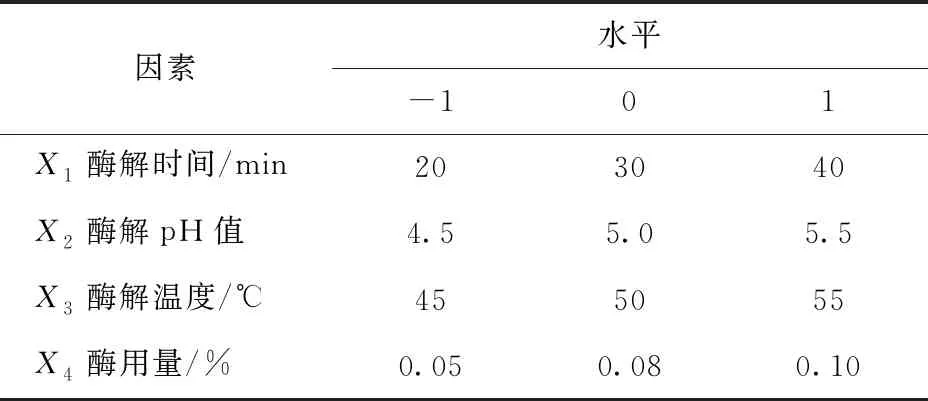
表1 响应面试验因素与水平
2 结果与分析
2.1 标准曲线的建立
回归方程与线性范围见表2,考察结果证明3种糖苷在0.01~0.20 mg/mL线性良好,槲皮素在0.004 5~0.144 0 mg/mL线性良好,可为后续样品含量测定提供可靠依据。

表2 不同黄酮化合物的回归方程
2.2 不同来源β-葡萄糖苷酶对刺梨槲皮素糖苷的酶解效果
2.2.1β-葡萄糖苷酶对槲皮素糖苷转化率的影响
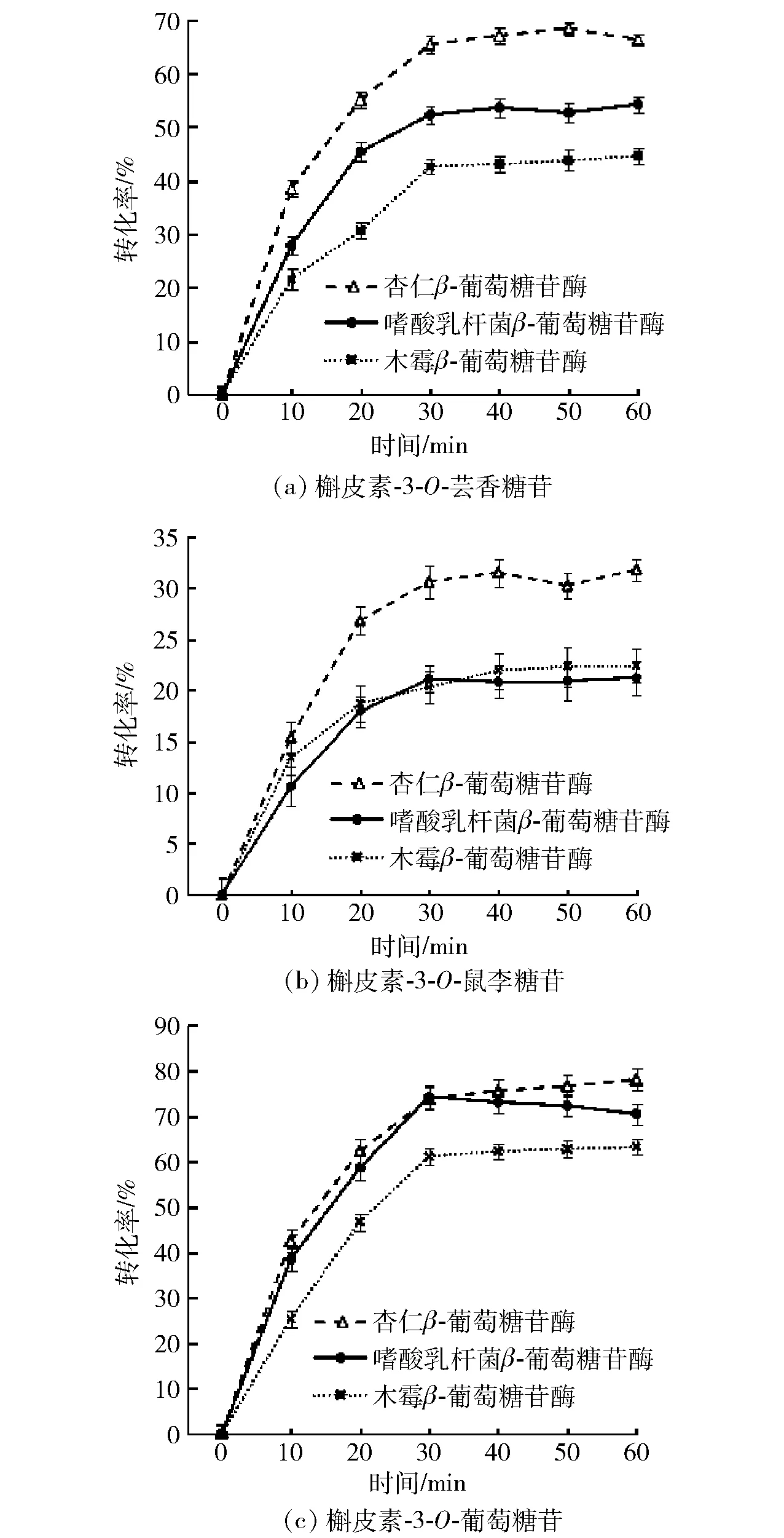
图1 不同来源β-葡萄糖苷酶对槲皮素糖苷转化率的影响Fig.1 Effect of β-glucosidase from different sources on conversion rate of quercetin glycosides
β-葡萄糖苷酶通过断裂槲皮素糖苷化合物之间的糖苷键来完成对底物的水解,不同来源的β-葡萄糖苷酶结构与组成不同,糖基化程度、糖链聚合度、糖链分支与相对分子质量差异较大,一级结构、活性区域氨基酸序列中心基团以及具催化作用的氨基酸残基排列及状态不同[16],从而导致它们对不同底物亲和力及水解机制存在差异。3种来源的β-葡萄糖苷酶对槲皮素糖苷转化率的影响见图1。由图1可以看出,反应60 min时,3种β-葡萄糖苷酶对槲皮素-3-O-葡萄糖苷的转化率均为最高,分别为74.10%、70.50%、62.50%。β-葡萄糖苷酶水解槲皮素糖苷键的能力取决于糖基[17],槲皮素苷元的糖基不同对酶的水解效率影响显著[18],且双糖苷的转换速率比单糖苷慢。槲皮素-3-O-葡萄糖苷只有一个葡萄糖基,在葡萄糖基的特定位点处的羟基可以形成额外的氢键,增强酶与底物的作用[19],因而β-葡萄糖苷酶对槲皮素-3-O-葡萄糖苷水解转化率最高。
2.2.2β-葡萄糖苷酶对槲皮素含量的影响
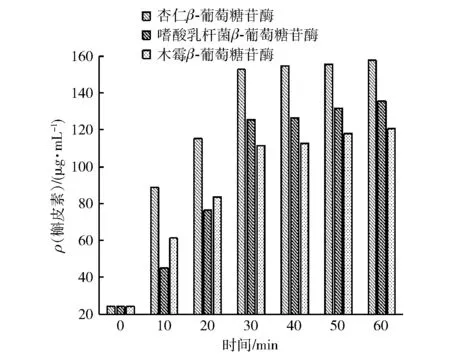
图2 不同来源β-葡萄糖苷酶对槲皮素含量的影响Fig.2 Effect of β-glucosidase from different sources on quercetin content
不同来源β-葡萄糖苷酶对槲皮素含量的影响见图2。由于β-葡萄糖苷酶的种类众多,其苷元结合位点处的氨基酸残基呈现多样性,活性位点外的部分氨基酸也能通过非共价作用影响活性中心的氨基酸对底物的专一性[20]。此外,β-葡萄糖苷酶催化活性中心结构以及氨基酸活性位点位置不同导致表面电势差异,因此,β-葡萄糖苷酶与构成苷元结合位点的氨基酸残基及与活性中心以外的氨基酸残基的作用机制存在差异[21],使不同β-葡萄糖苷酶具有不同的底物结合及催化作用模式。由图2可以直观地看出各来源的β-葡萄糖苷酶对槲皮素糖苷的整体转化程度。由杏仁β-葡萄糖苷酶转化所得槲皮素含量一直最高,反应30 min时含量达到152.60 μg/mL。水解作用较优的杏仁β-葡萄糖苷酶对不同底物的转化率由高到低依次为槲皮素-3-O-葡萄糖苷(74.10%)、槲皮素-3-O-芸香糖苷(64.30%)、槲皮素-3-O-鼠李糖苷(31.80%),因此,杏仁β-葡萄糖苷酶为较优水解酶,槲皮素-3-O-葡萄糖苷为较佳酶解底物。
2.3 酶解条件对杏仁β-葡萄糖苷酶转化槲皮素糖苷的影响
2.3.1酶解pH值的影响
pH值对酶解反应的影响见图3。由图3可知,随着体系pH值增加,槲皮素糖苷转化率上升显著,在pH值5.0时达到最高;当体系pH值大于5.0时,糖苷转化率快速下降。pH值是影响β-葡萄糖苷酶活性的重要因素,酶的两端具有游离的氨基和羧基,对pH值极为敏感,反应体系过酸或过碱都会使酶的活性架构解离受到影响[26],降低底物与酶的结合程度。因此,选择pH值5.0为优化的酶解pH值。
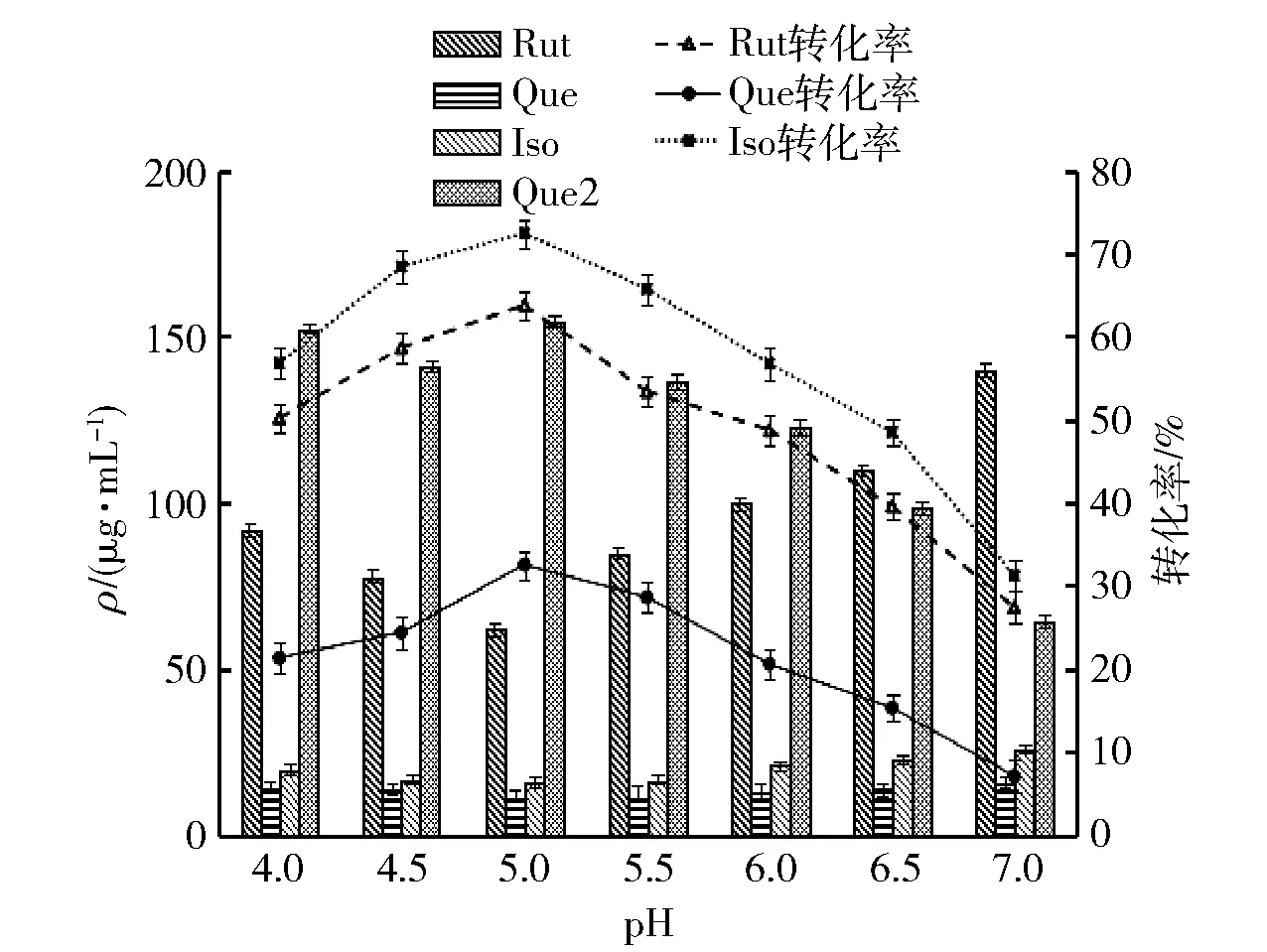
图3 酶解pH值对槲皮素糖苷含量及转化率的影响Fig.3 Effect of hydrolysis pH on content and conversion rate of quercetin glycoside
2.3.2酶解温度的影响
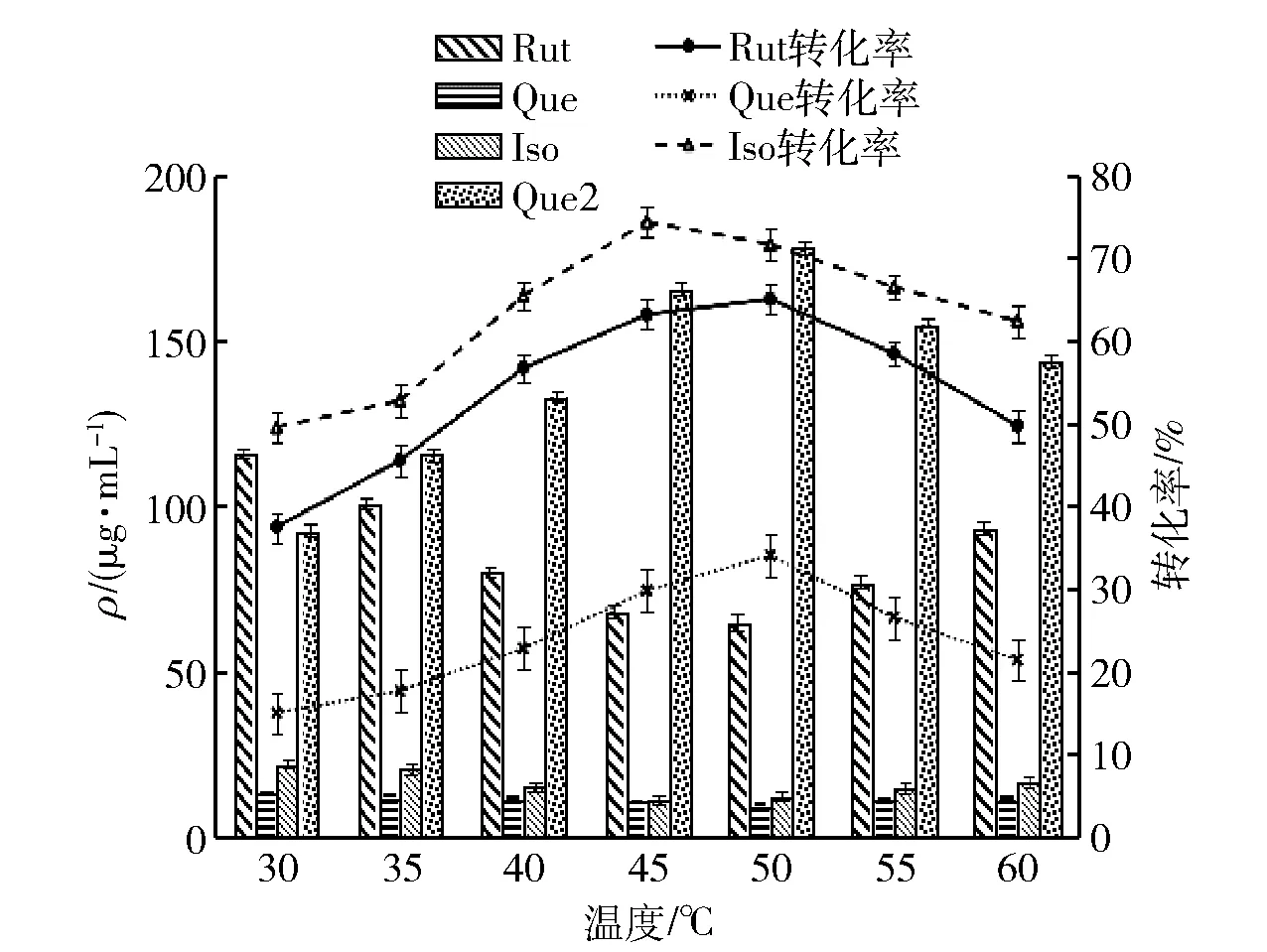
图4 酶解温度对槲皮素糖苷含量及转化率的影响Fig.4 Effect of enzymatic hydrolysis temperature on content and conversion rate of quercetin glycoside
酶解温度对酶解反应的影响见图4。由图4可知,随酶解温度的升高,糖苷转化率先升高后下降。当温度达到45 ℃时,槲皮素-3-O-葡萄糖苷转化率达到最高;当温度为50 ℃时,槲皮素-3-O-芸香糖苷与槲皮素-3-O-鼠李糖苷转化率最高,且此时槲皮素含量最大,所以温度选择50 ℃为宜。由于低温影响分子运动的能量,在低温时,酶活化分子少活性低,槲皮素糖苷分子与酶分子活性部位接触较少导致反应速率慢。温度的升高使得酶分子运动加速,酶解反应进行较快;但随着温度的增加,稳定酶的共价键也逐渐被消除,酶部分展开变得松弛[22],温度过高导致维持酶分子结构的次级键解体[22],蛋白质核心的疏水性残基暴露在溶剂中,使得蛋白质聚集,造成酶不可逆地解构变性失活[23],酶解反应被抑制。
2.3.3酶用量的影响

图5 酶用量对槲皮素糖苷含量及转化率的影响Fig.5 Effect of enzyme dosage on content and conversion rate of quercetin glycoside
酶用量对酶解反应的影响见图5。由图5可知,随着酶用量的增加,糖苷转化率随之不断升高;当酶用量达到0.075%后,增加酶用量,转化率基本保持不变,选择酶用量0.075%为宜。当酶用量较小时,糖苷底物充足,随着酶用量的增加,酶与底物结合程度增强,酶促反应速度与底物浓度成正比[24],转化率呈现上升趋势;当酶与底物质量比达到一定比例,糖苷底物分子结合点饱和,抑制酶解[22],继续增大酶用量不会使转化率显著提高。
2.4 响应面试验分析
2.4.1响应面试验结果
杏仁β-葡萄糖苷酶酶解条件响应面试验设计与结果见表3,方差分析见表4至表6。

表3 响应面试验设计与结果

表4 槲皮素-3-O-芸香糖苷方差分析及显著性结果
通过软件对表3数据进行二次多项式回归拟合,得到槲皮素糖苷转化率回归方程:
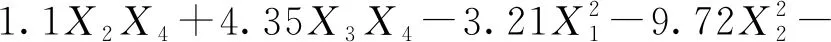
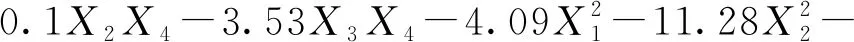

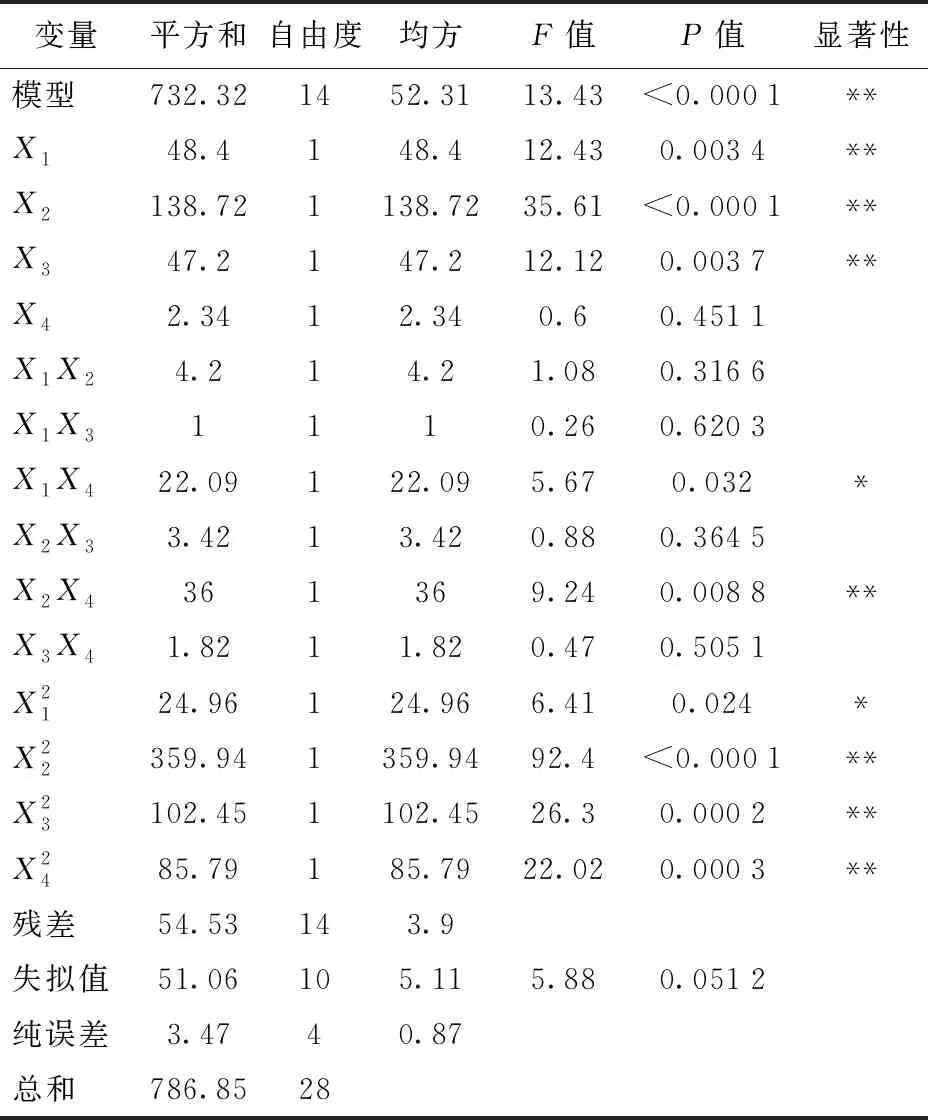
表5 槲皮素-3-O-鼠李糖苷方差分析及显著性结果

表6 槲皮素-3-O-葡萄糖苷方差分析及显著性结果
2.4.2响应面分析与验证实验
各因素交互作用对槲皮素糖苷转化率的影响如图6至图8。从图6(a)、图6(b)可以看出,酶解时间和酶解温度交互作用显著,酶解温度和酶用量交互作用极显著,表现为等高线密集,响应面曲面陡峭。表明β-葡萄糖苷酶酶解槲皮素-3-O-芸香糖苷时对温度敏感,同时也受酶解时间、酶用量的影响。同理,从图7(a)、图7(b)可以看出,酶解时间和酶用量交互作用显著,酶解pH值和酶用量交互极显著,表明β-葡萄糖苷酶酶解槲皮素-3-O-鼠李糖苷时对酶用量较敏感,同时也受酶解时间、酶解pH值的影响。从图8(a)、图8(b)可以看出,酶解时间和酶用量交互作用极显著,酶解温度和酶用量交互显著,表明β-葡萄糖苷酶酶解槲皮素-3-O-葡萄糖苷时对酶用量较敏感,同时也受酶解时间、酶解温度的影响。
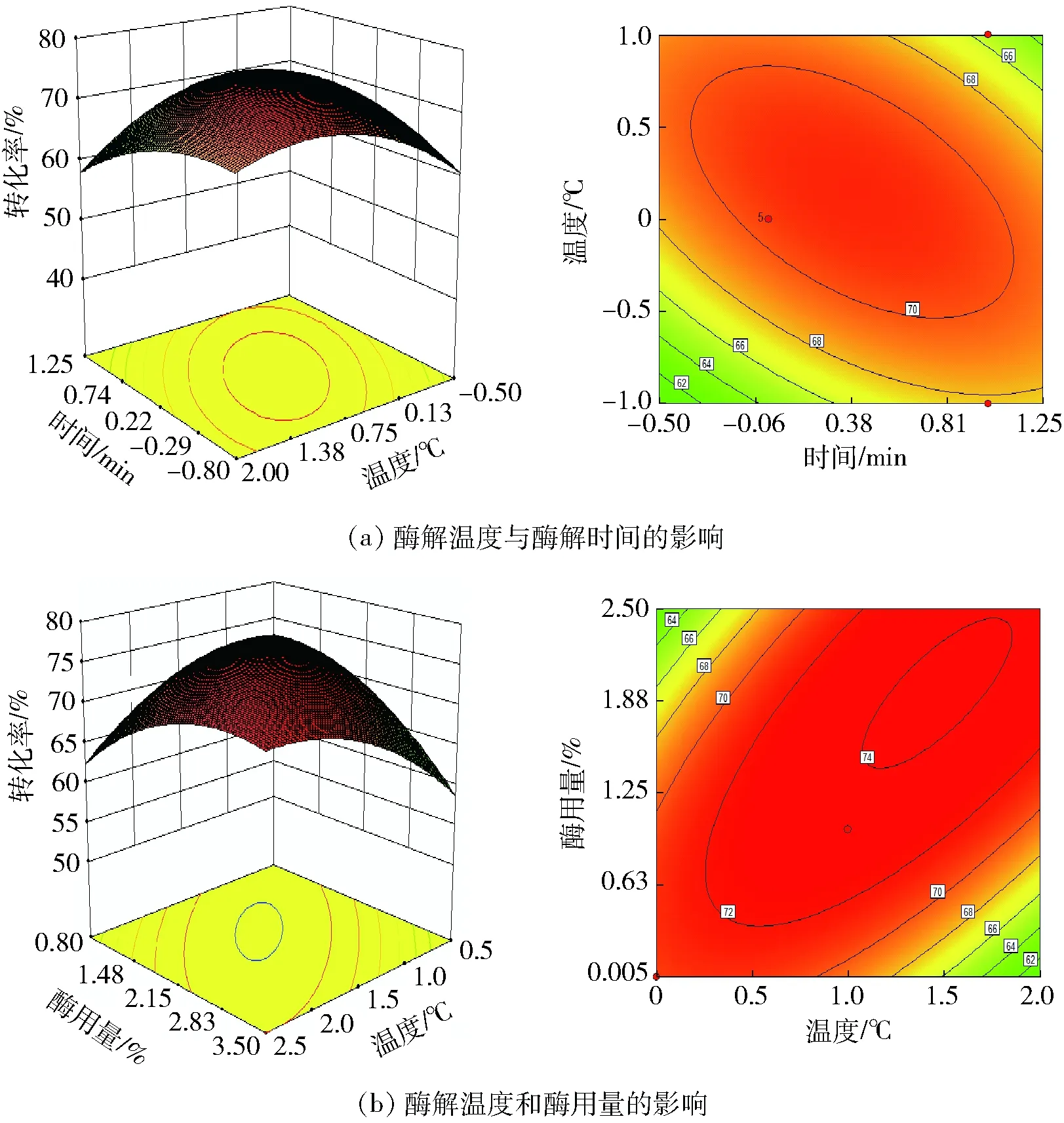
图6 各因素交互作用对槲皮素-3-O-芸香糖苷转化率的影响Fig.6 Effect of interaction of various factors on quercetin-3-O-rutinoside conversion rate
根据响应面计算得到各因素优化酶解条件为酶解时间28.91 min、酶解pH值4.9、酶解温度51.55 ℃、酶用量0.08%,通过方程得到糖苷转化率预测值为槲皮素-3-O-芸香糖苷72.52%,槲皮素-3-O-鼠李糖苷37.10%,槲皮素-3-O-葡萄糖苷78.40%。考虑实际操作修正实验条件为酶解时间28.90 min、酶解pH值4.9、酶解温度52 ℃、酶用量0.08%,此条件下对酶解工艺进行3次平行实验,得到槲皮素-3-O-芸香糖苷转化率为71.48%,RSD=0.49%;槲皮素-3-O-鼠李糖苷转化率36.32%,RSD=1.67%;槲皮素-3-O-葡萄糖苷转化率77.86%,RSD=0.35%。槲皮素糖苷实际平均转化率分别达到理论预测值的98.57%、97.90%、99.31%,实验值与预测值吻合较好,模型拟合度达到98.4%,说明该模型可以用来优化杏仁β-葡萄糖苷酶水解3种槲皮素糖苷实验。
3 结 论
通过利用HPLC对糖苷转化率及槲皮素含量进行动态监测,根据3种糖苷转化所得槲皮素含量对比得出杏仁β-葡萄糖苷酶为最优水解酶,槲皮素-3-O-葡萄糖苷为最佳水解底物。
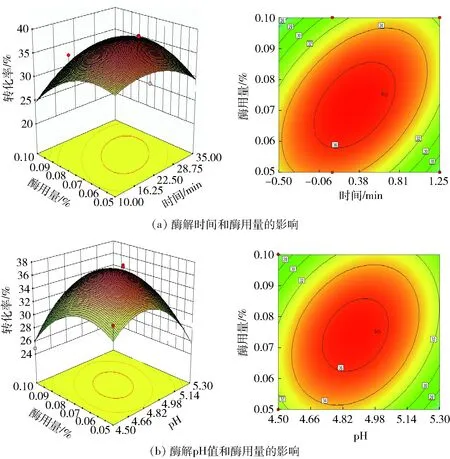
图7 各因素交互作用对槲皮素-3-O-鼠李糖苷转化率的影响Fig.7 Effect of interaction of various factors on quercetin-3-O-rhamnoside

图8 各因素交互作用对槲皮素-3-O-葡萄糖苷化率的影响Fig.8 Effect of interaction of various factors on quercetin-3-O-glucoside conversion rate
利用Box-Behnken 中心组合方法对杏仁β-葡萄糖苷酶水解3种糖苷进行响应面试验设计,确定了优化酶解工艺:酶解时间28.90 min,酶解pH值4.9,酶解温度52 ℃,酶用量0.08%,此条件下得到槲皮素-3-O-芸香糖苷转化率为71.48%,槲皮素-3-O-鼠李糖苷转化率36.32%,槲皮素-3-O-葡萄糖苷转化率77.86%。
