降血压活性卡拉胶钾的肠道菌群调节作用研究
2020-10-28付晓丹朱常亮牟海津韩振莲
陈 梦, 付晓丹, 朱常亮, 牟海津,*, 韩振莲
(1.中国海洋大学 食品科学与工程学院, 山东 青岛 266003;2.淮阴师范学院 生命科学学院, 江苏 淮安 223300)
κ-卡拉胶及其寡糖的抗凝血作用已被证实[1],而有报道指出改善高血压病人的凝血功能有助于控制患者的病情[2],这说明 κ-卡拉胶可能具有潜在降压作用。当人体摄入的钾离子增多,细胞膜上的“钠钾泵”会充分地将K+泵入细胞内以形成高钾环境,同时使Na+外流,并随尿液排出,减轻了胞内钠离子过多导致机体大量饮水而出现的细胞外液、血容量增多以及心室充盈等现象,进而减轻血压升高现象。κ-卡拉胶的重复二糖单元携带一个负电荷,可以与溶液中的阳离子结合;分子卡拉胶经酶解成短链糖结构,其空间结构得以舒展,硫酸根基团也得以更大程度地暴露进而与钾离子更充分地接触,提高钾离子的结合率。
肠道菌群被视为人类的第二基因组,其对机体各方面的调控作用不容小觑。卡拉胶一直都被证实有多种生理活性,并且有潜力成为功能性食品和药物开发的益生元剂。然而,到目前为止仍旧没有相关实验揭示卡拉胶在动物实验中对肠道菌群的影响。众多研究表明,肠道菌群失调会导致机体出现多种慢性和急性病征,如高血压[3]、糖尿病[4]、结肠炎[5]、过敏[6]等。有学者指出肠道菌群失衡往往发生在高血压之前,而机体一旦患上高血压又会反作用于肠道菌群[7],肠道菌群失调与高血压处于一种互相促进的状态,因此肠道菌群的调整和改善可以作为防治高血压的一个切入点。
研究利用制备的低分子质量的酶解卡拉胶钾为实验材料,分析其对原发性高血压大鼠(SHR)的降血压功效和对肠道菌群的调节作用,重点关注肠道内环境的改善、短链脂肪酸(short-chain fatty acids,SCFAs)的变化以及菌群组成上的差异等,以期从肠道环境及菌群的角度对低分子质量卡拉胶钾(LCP)降低SHR血压的可能机理进行更深一步的阐释。
1 材料与方法
1.1 材料与试剂
卡托普利,深圳海王药业有限公司;低分子质量卡拉胶钾(分子质量3.5 kDa),本实验室制备; SCFAs标准品、异己酸纯物质原液,西格玛贸易有限公司;脂多糖试剂盒,上海酶联免疫公司;体积分数4%多聚甲醛固定液,中山康乃欣生物医疗有限公司;地衣酚,上海一研试剂有限公司。
1.2 仪器与设备
Milli-Q Reference型超纯水系统,美国默克密理博公司;XW-80A型旋涡混合器,海门市麒麟医用仪器厂;Olympus BX41型荧光显微镜,南京贝登医疗股份有限公司;1260型高效液相色谱仪,安捷伦科技有限公司; KC-811型色谱柱,北京恩加壹科技有限公司。SPF级的雄性SHR 18只[9周龄,220~260 g,收缩压大于165 mmHg(1 mmHg=0.133 kPa)],北京维通利华实验动物有限公司,实验动物生产许可证号:SCXK(京)2016-0011。
1.3 实验方法
1.3.1动物饲养与血压测定
18只SHR于SPF级屏障环境动物房适应性喂养1周,温度:22~26 ℃;湿度:50%~70%;饲养密度:3只/笼。SHR的头、背、尾3个部位分别被染上苦味酸(黄色)作为区分标记;人为控制光照环境,保持生存环境12 h光照,12 h黑暗。根据体重和血压平均分为3组,每组6只,保证组间初始血压平均值尽可能接近。根据参考文献[8],实验剂量如下:空白对照(B)组灌胃蒸馏水,实验(LCP)组灌胃LCP[600 mg/(kg·d)],阳性对照(P)组灌胃卡托普利[10 mg/(kg·d)]。实验持续6周,每周定时定点测量收缩压(SBP)1次,完全按仪器的测量方法进行操作,等大鼠在黑暗密闭环境完全安静后仪器自动读数,每只大鼠测量5次,若有相差较大的数值,当场剔除,保证5次测量结果相差不大。并称重2次以便根据体重随时微调实际灌胃体积。实验结束后,乙醚迷晕大鼠,腹主动脉取血, 注意收集盲肠内容物。
1.3.2短链脂肪酸的测定
样品前处理(水提法):取保存于-80 ℃冰箱的LCP组的盲肠内容物置于冰盒上,冷冻状态下用消毒的镊子称取0.3 g左右置于2 mL EP管中,用超纯水定容至刻度线,混匀后冷冻离心。将上清液转移至另外的离心管中,注入60 μL 2 mg/mL的磺基水杨酸以除去蛋白质,充分混匀后冷冻离心。取1 mL上清液,加入异己酸原液12.5 μL以保证和标准品中异己酸的浓度一致,混合均匀,冷藏待用。
色谱条件:色谱柱为离子排阻KC-811色谱柱(8.0 mm×300 mm);流动相为体积分数0.01% H3PO4(pH值3.12),柱温50 ℃,流速0.8 mL/min,检测器为紫外检测器,波长210 nm,检测时间35 min。
短链脂肪酸的测定采用内标法[9],内标物为异己酸,计算见式(1)~式(3)。
(1)
式(1)中,Ar,标准品中异己酸的峰面积;As,待测样品中异己酸的峰面积。
则待测样品中相应SCFAs的质量浓度ρi为:
(2)
式(2)中,Ai,待测样品中相应SCFAs的峰面积;Ari,标准品中相应SCFAs的峰面积;ρri,标准品中相应SCFAs的质量浓度,mg/L。
则盲肠内容物中SCFAs的含量(mg/g)为:
(3)
式(3)中,2,样品体积,mL;m,称取的盲肠内容物的质量,g。
1.3.3菌群多样性分析
针对16S rRNA的V3~V4区进行Miseq扩增子测序。测序数据经拼接、质控、去接头之后获得优化序列,基于优化序列进行OTU聚类,获得OTU丰度表,用于后续生信分析。对于Beta多样性分析,基于Bray_Curtis weighted和unweighted unifrac距离计算距离矩阵,使用PCoA进行结果可视化展示;使用非参数的adonis分析(PerMANOVA)检测组间差异是否显著,以及分组因素对组间差异的解释度。使用Welch’s t tests进行不同组间门和属水平物种丰度变化的差异分析,使用Bonferroni进行多重检验校准。
1.4 数据处理
采用SPSS 22.0软件进行统计学分析,各组数据均表示为平均数 ± 标准偏差,组间数据采用单因素方差分析(one-way ANOVA)的方法,P<0.05为差异有统计学意义。
2 结果与分析
2.1 LCP对SHR收缩压的影响
SHR不同时间段的收缩压见表1。由表1可知,空白组SHR的血压值随周龄增加而上升,第3周稳定在210 mmHg左右。LCP组在灌胃第1周基本无降压作用,从第2周开始便控制血压不再上升,第3周开始与空白组有了显著差异(P<0.05),这种显著的降压效果持续到了第4周,第5周血压略有回升,但在第6周与空白组血压相比出现极显著差异(P<0.01),降压效果明显,总体上与空白组相比,有18 mmHg左右的血压差,说明LCP具有一定的降压作用且能够保持稳定持续的降压效果。阳性对照组控制血压的效果较为明显,灌胃1周后就出现了显著的降压效果并持续到实验结束,但是对照组在第3周血压出现波动。

表1 每组SHR不同时间段的收缩压
2.2 各组间SCFAs的含量变化
SCFAs也称挥发性脂肪酸,是碳链中碳原子数在1~6的有机脂肪酸,包括乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸等,其中乙酸、丙酸、丁酸的总含量在95%以上[10]。90%的SCFAs是由肠腔内厌氧菌酵解食物中不消化的碳水化合物成分产生,余下与蛋白质代谢和饮食组成相关。SCFAs被肠上皮细胞吸收后可为线粒体提供能量,尤其是丁酸,其含量占肠道SCFAs总含量的80%以上,是肠上皮细胞的主要供能者。丁酸可调节肠道内部的酸碱性,降低pH值,减少有害菌的生长[11];还可抑制炎症因子的生成,降低免疫应答效应,控制结肠炎症的发展等[12]。
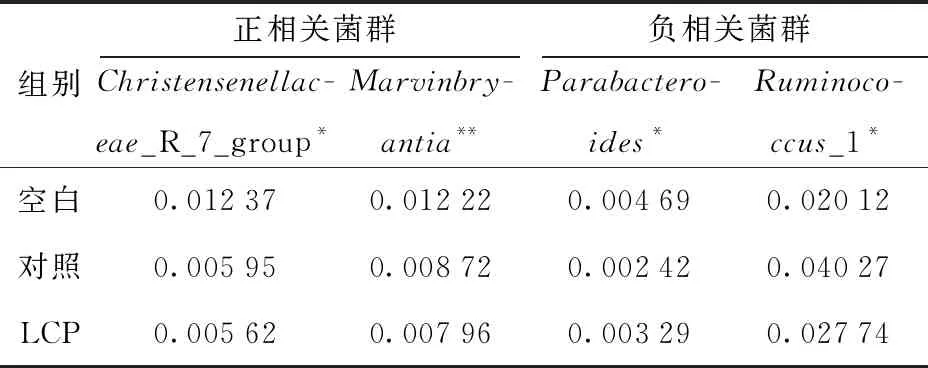
*、** 分别表示与空白组相比有显著、极显著差异,#、##分别表示与对照组相比有显著、极显著差异。图1 各组盲肠内容物中乙酸、异丁酸及丁酸的含量比较Fig.1 Comparison of acetic acid, isobutyric acid and butyric acid contents in each group
盲肠内容物SCFAs含量变化见图1。在乙酸含量上,LCP组与空白组相比出现显著差异(P<0.05),且与对照组相比呈现出极显著差异(P<0.01),显示出LCP在改善肠道内环境方面明显优于卡托普利的特性。前人研究发现,异丁酸最主要作用是利于纤维分解菌的生长,在日粮中添加异丁酸等,白色瘤胃球菌成为优势菌群[13]。本实验中,比较于其他类型的SCFAs,异丁酸含量上的组间差异性最大;LCP组与空白组相比出现极显著性差异(P<0.01),与对照组相比出现显著性差异(P<0.05);对照组与空白组相比,虽略微有所升高,但统计学分析结果显示两组间并无显著差异。丁酸可增加肠上皮细胞之间紧密连接蛋白的表达量,使得肠上皮细胞间紧密连接作用加强,抑制肠道通透性增加,增强黏膜屏障功能[14];丁酸亦可促进黏蛋白分泌,增加肠道润滑度[15]。同时肠炎患者在口服丁酸肠溶片后,大部分患者肠炎病症在临床上得到缓解,内镜及组织病理实验显示,典型促炎因子IL-1水平下降,在病理和生理上均未发现其他不良反应[16]。研究发现LCP组丁酸含量与空白组、对照组相比,均出现显著性差异(P<0.05),而对照组与空白组相比无显著差异。
2.3 LCP对SHR肠道菌群的影响
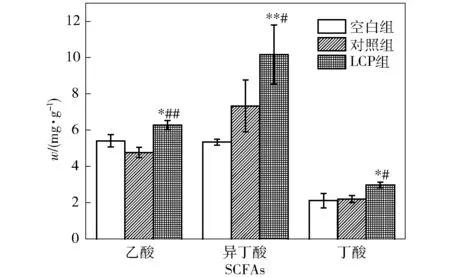
研究首先在门水平上从厚壁菌门与拟杆菌门比值(F/B值)出发对肠道菌群进行评估(图2),发现相比较于空白组和对照组,LCP组厚壁菌门明显减少,拟杆菌门明显增多,F/B值下降,与宏观表现出的血压下降结果一致。LCP组相较于空白组,厚壁菌门数量减少8.3%,拟杆菌门数量增加8.4%,空白组的F/B值是LCP组的1.53倍(表2)。对于降压药物卡托普利来说,门水平上的菌群结果并未显示出其在调节肠道菌群上的差异性。

图2 各组肠道内门水平的菌群分布Fig.2 Intestinal flora distribution in level of Phylum
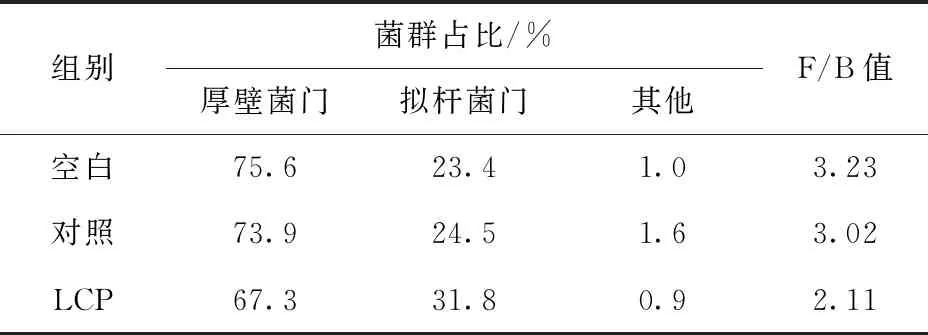
表2 门水平肠道菌群的F/B值
此外,本实验从属水平对各组菌群的丰度(图3)进行评价,发现LCP组在肠道主要优势菌群的丰度上明显高于空白组和对照组。图3中蓝色为其他菌属,绿色为毛螺菌科中未经正式分类的未知属,红色为普雷沃克氏菌属(Prevotella)。Dae-Wook等[17]在对比了神经典型儿童与伴随高比例胃肠道疾病的自闭型儿童的肠道菌群后发现后者的特征在于Prevotella水平的显著降低,这表明Prevotella作为肠道有益菌和优势菌对于肠道调节的重要性。根据图3、图4的差异菌分析可知,LCP组中的Prevotella菌属相较于空白组明显占据优势。紫色为毛螺菌属,是属于梭菌的一类产丁酸菌,这一菌属可通过产丁酸来预防人类的结肠癌[18]。
LEfSe分析可显示不同组之间具有统计学差异的生物标识,即找出两组之间的差异菌株。分析水平选择属水平,在差异菌种的分析中发现,与空白组对比,LCP组的差异菌为普雷沃克氏菌属(Prevotella)和瘤胃球菌属(Ruminococcus)(图4)。正常成人肠道细菌种类以拟杆菌型(Bacteroides)、普氏菌型(Prevotella)和瘤胃球菌型(Ruminococcus)3个属的细菌为肠内优势菌群[19],可见LCP对调节肠内菌群回归正常水平有一定作用。普雷沃克氏菌属消化纤维素,主要产生乙酸、丁酸以及少量的异丁酸。由于异丁酸可有效地促进白色瘤胃球菌的生长[20],故推测LCP组大鼠肠道菌群内的普雷沃克氏菌的增多,有效地提高了肠道内异丁酸的含量,进而促进瘤胃球菌属的生长;而瘤胃球菌属是典型的产丁酸菌[21],所以肠道内丁酸的含量也获得了显著地提高。
2.4 高血压与肠道菌群的相关性分析
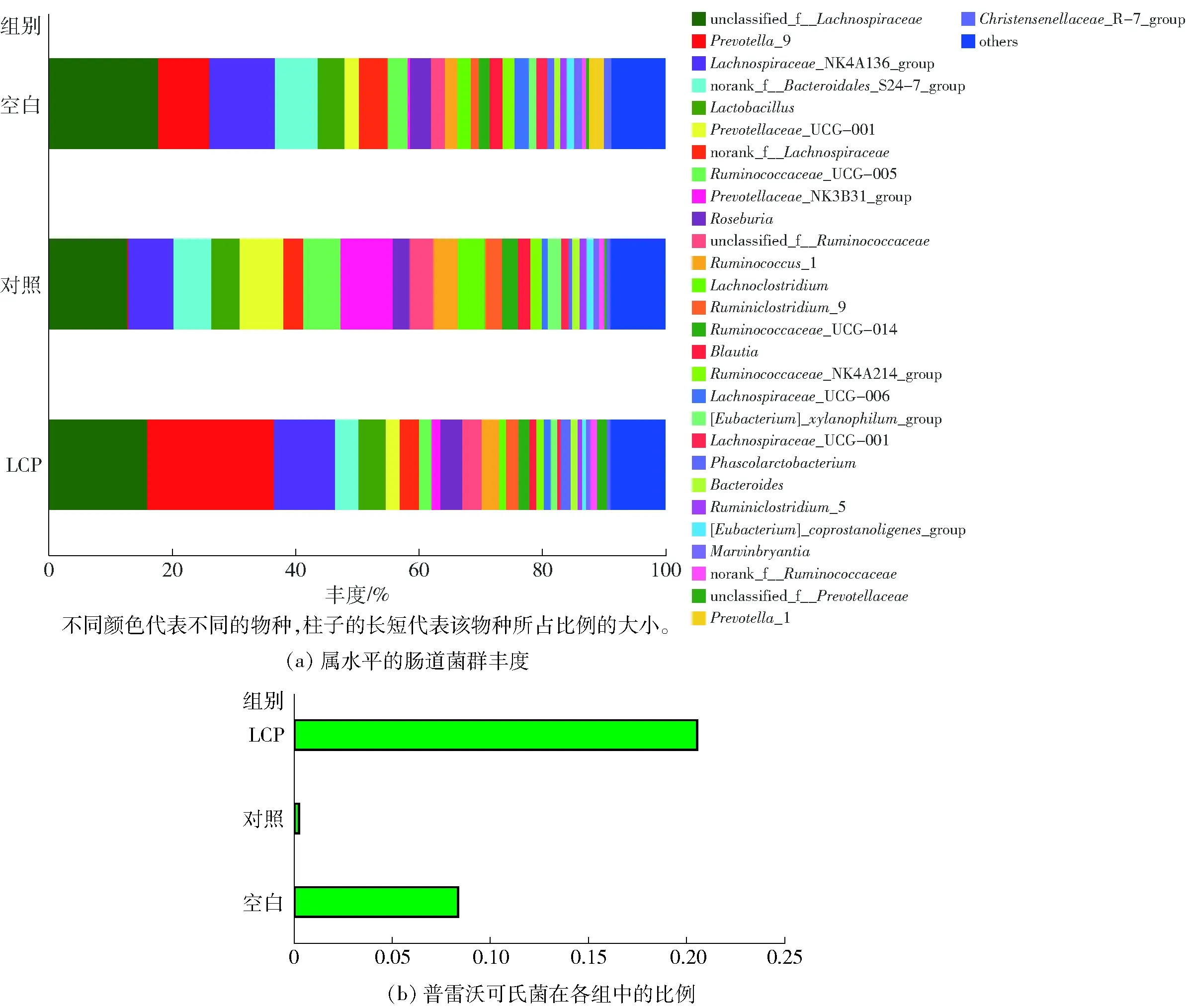
图3 属水平的肠道菌群丰度及普雷沃可氏菌比例Fig.3 Abundance of intestinal flora in level of genus and percentage of Prevotella

LDA分值为以10为底的对数值;LDA分值越大,代表物种丰度对差异效果影响越大。图4 空白组和LCP组的差异菌分析Fig.4 Different bacteria of blank and LCP group
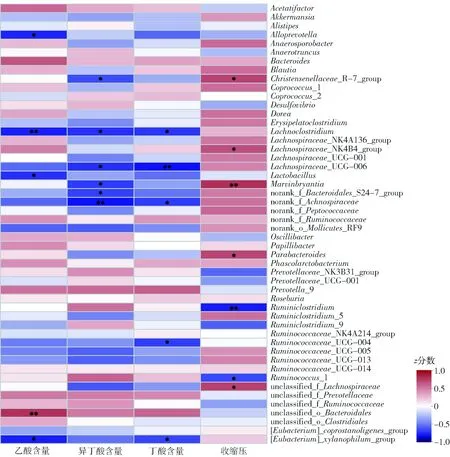
红色表示正相关,蓝色表示负相关。*0.01 以收缩压(SBP)的数据表征高血压,通过环境因子关联分析,借助大数据分析将高血压与肠道菌群进行关联,结果如图5。高血压与Christensenellaceae_R_7_group、Lachnospiraceae_NK4B4_group、Marvinbryantia、Parabacteroides、unclassified_f_Lachnospiraceae5种细菌呈正相关,与Ruminiclostridium、Ruminococcus_1呈负相关。研究表明Christensenellaceae_R_7_group与心血管疾病风险呈正相关[22],Marvinbryantia在神经元活动引起的肠道综合征中丰度有所上升[23],而Parabacteroides在高血压个体的肠道中分布广泛[24],Lachnospiraceae_NK4B4_group和unclassified_f_Lachnospiraceae未查阅到与高血压以及肠道生理功能相关的研究。Ruminococcus_1是瘤胃球菌的一种,主要产生丁酸,而瘤胃球菌与高血压的负相关性也多有报道[21,25]。这一分析结果表明,本实验中LCP组血压的降低与产丁酸的瘤胃球菌有一定关系。 此外,表3是不同细菌在不同实验组中的丰度百分比。在与血压正相关菌群中,LCP组的丰度皆低于空白组;而在负相关菌群中,LCP组的丰度略高于空白组。其中,拟杆菌与收缩压呈负相关,但是与乙酸的产生呈正相关,这一分析结果与前面LCP组中拟杆菌门的丰度高于空白组一致。此外,LCP组中乙酸的含量显著高于空白组,由此可以推测,乙酸含量的提高与拟杆菌门丰度提高可能有关。 Holmes等[26]在以亚洲黄种人和欧洲白种人为调查对象的研究中发现,SCFAs的水平和血压具有很显著的相关性。SCFAs在一定范围内可以激活孤儿型G蛋白偶联受体(Gpr41)起到降压作用。此外,SCFAs还可以通过直接地调节血管舒张程度进而降低血压[27]。在对SHR的肠道中SCFAs含量和菌种丰度的研究中发现,与对照组WKY大鼠相比较,SHR结肠粪便中的丙酸和丁酸含量显著减少[28]。体外实验证明乙酸可抑制细菌LPS诱导的炎症因子释放[29];在给无菌小鼠通过口服方式给予浓度为150 mmoL/L乙酸后,其肠道炎症因子含量下降,对肠道进行组织活检发现肠炎症状减轻,肠道内环境得到改善[30]。 表3 各组中不同细菌的比例 Tab.3 Percentage of different bacteria in each group % 而厚壁菌门与拟杆菌门的比值与高血压息息相关,众多研究表明在高血压患者或动物模型中F/B值会增加。Yang等[28]在对高血压大鼠模型的研究中发现,与血压正常的WKY大鼠相比较,肠道菌群丰度、均匀度和多样性等在SHR与Ang II诱导的高血压大鼠模型中显著降低,同时F/B值增加,是正常WKY大鼠的5倍,产乙酸和产丁酸的细菌数量显著减少。 本文研究结果基本符合前人的正向研究结论,LCP通过增加普雷沃克氏菌属和瘤胃球菌属的丰度来提高肠道内SCFAs的含量,增加优势有益菌群的数量,降低肠道其他有害菌的占比,进而改善肠道内环境,即LCP能调节肠道内环境以及使肠道菌群趋于正常化,因而具有潜在的改善高血压症状的作用。3 结 论