冰封期内蒙古南海湖细菌菌群结构特征分析
2020-10-28杨文焕毋凡琛李卫平
杨文焕,毋凡琛,申 涵,李卫平,张 生
(1.内蒙古农业大学 水利与土木建筑工程学院,呼和浩特 010018; 2.内蒙古科技大学 能源与环境学院,内蒙古 包头 014010)
0 引 言
细菌群落作为湖泊生态系统中重要组成部分,在推动湖区生物地球化学循环方面发挥着重要作用[1]。细菌不仅可通过自身新陈代谢与环境发生作用,进而改变水环境因子,亦可作为生物学指标,来指示湖泊生态系统的健康状况[2]。【研究意义】寒旱区湖泊由于其特殊的地理位置,和气候特征,导致其有冰封期长、冰层厚、流量小、污染重等特有的水体特征以及其重要的生态系统功能,逐渐成为国内外研究的焦点[3-4]。在冰封期间,由于湖泊水温急剧下降,大量生物在极端环境下存活困难,但依然有些细菌还具有强大的生物活性,特殊的遗传背景和代谢途径使其能够产生适合低温极端环境的特殊酶类及活性物,从而使其能够在寒冷条件下表现出较高的活性[5-6]。【研究进展】目前对于寒旱区湖泊的研究主要集中在其功能、水质、鱼类群落、鸟类、浮游生物和水生大型植物方面,而针对南海湖的研究多集中在营养盐分布、生态风险评价和浮游植物分布等,而对微生物的研究还较少。【切入点】由于寒旱区湖泊具有较长的冰封期这一特点,而在冰封过程中,湖泊的生态系统特征受到物理和化学波动的影响,由此产生的一系列生态过程及表象将对生存在该生态系统中的细菌多样性和代谢活动产生更大的影响,进而导致整个食物链的结构发生变化[8]。因此,通过探究寒旱区湖泊冰封期细菌种群特征,了解细菌群落的组成和多样性,对分析湖泊生态系统物质循环,以期能锚定该湖泊中主要优势菌属,进而解决寒旱区水环境问题具有指导意义。【拟解决的关键问题】本研究采用高通量测序技术,通过对寒旱区湖泊在冰封期不同区域水体及沉积物细菌群落特征进行分析,与环境因子进行相关性分析,来探究寒旱区冰封期湖泊理化因子对细菌群落特征的影响,为进一步探究高原寒旱区湖泊细菌群落与环境的相应关系和富营养化水体的生物修复提供参考。
1 材料与方法
1.1 采样点布设
南海湖受人为因素影响显著,不同水域有不同特征。根据湖泊补水特征、水生植物生长特点及人为因素干扰等,将其划分为4 个区域,分别为进水口区S1(NH1、NH2、NH3),旅游开发区S2(NH4、NH5、NH6),湖心区S3(NH7、NH8、NH9)及水草区S4(NH10、NH11、NH12),在每个区域均布设3 个采样点。湖泊西南部定期接受黄河补水,水质影响明显;补水口东北部坐落一座小岛,供游人观光,污染较多;岛屿周围及湖泊东北部水草密集生长,以芦苇为主;湖中心污染较少,水力条件稳定。采样点具体分布如图1 所示。
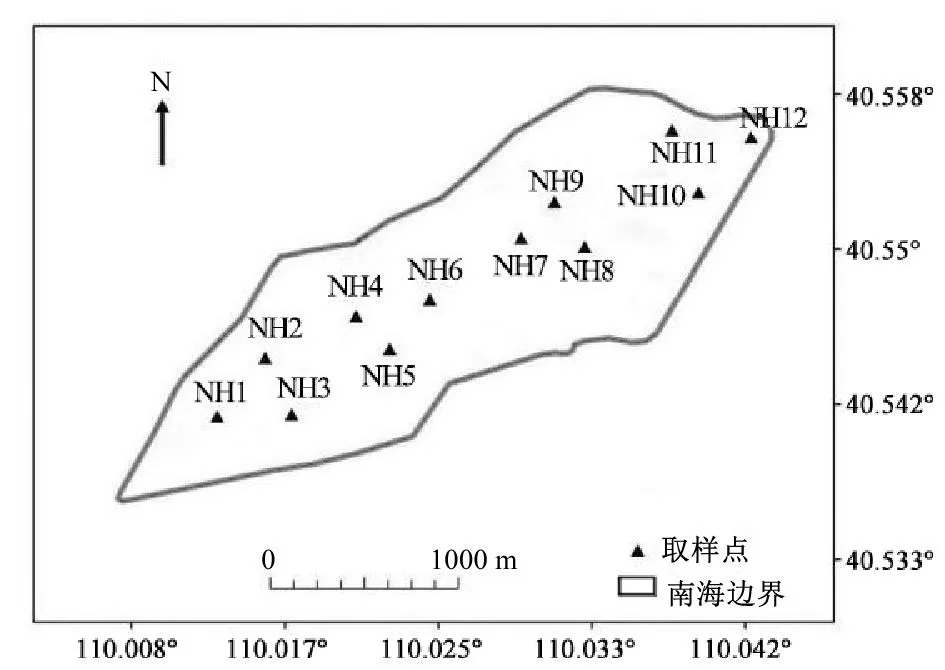
图1 包头南海湖冰封期采样点布设图 Fig.1 Distribution of sampling sites in the ice period of Nanhai Lake in Baotou
1.2 样品采集与处理
于2017 年12 月—2018 年2 月在研究区域各采样点采集样品。采集水样时,使用不锈钢柱状采样器,取冰体下表面之下0.5 m 与沉积物之上0.5 m 处水样进行混合,水样存放于经灭菌消毒的聚乙烯取样瓶中。于实验室内将样品分为两部分,一部分用于理化指标的测定,另一部分经0.22 μm 无菌微滤孔滤膜过滤,将滤膜置于50 mL 无菌离心管中,放置于-80 ℃液氮中保存,用于微生物群落结构和多样性分析。
使用不锈钢采样器取表层沉积物样品,每个样点均取3 个平行样,充分混合后存放于经灭菌消毒聚乙烯自封袋中(保证无菌)。将样品分为2 部分,一部分待自然风干后研磨用于各理化指标测定,另一部分置于-80 ℃液氮冷冻保存,用于微生物群落结构和多样性分析。
1.3 理化因子检测
本研究水质检测指标为水温(T)、溶解氧(DO)、pH 值、总氮(TN)、总磷(TP)、氨态氮(NH4+-N)、硝态氮(NO3--N)、亚硝态氮(NO2--N)、叶绿素a(Chl.a)和化学需氧量(CODCr)。其中水温,溶解氧和pH 值采用便携式水质检测仪在采样现场检测,其他指标根据国家环境保护总局《水和废水监测分析方法》中所述方法检测。沉积物理化指标包括pH 值、总有机碳(TOC)、总磷(TP)、总氮(TN)、氨态氮(NH4+-N)、硝态氮(NO3-N)和碳氮比(C/N)。具体测定方法如表1、表2 所示。

表1 水体理化指标测定方法 Table 1 Test method of physical and chemical indexes of water
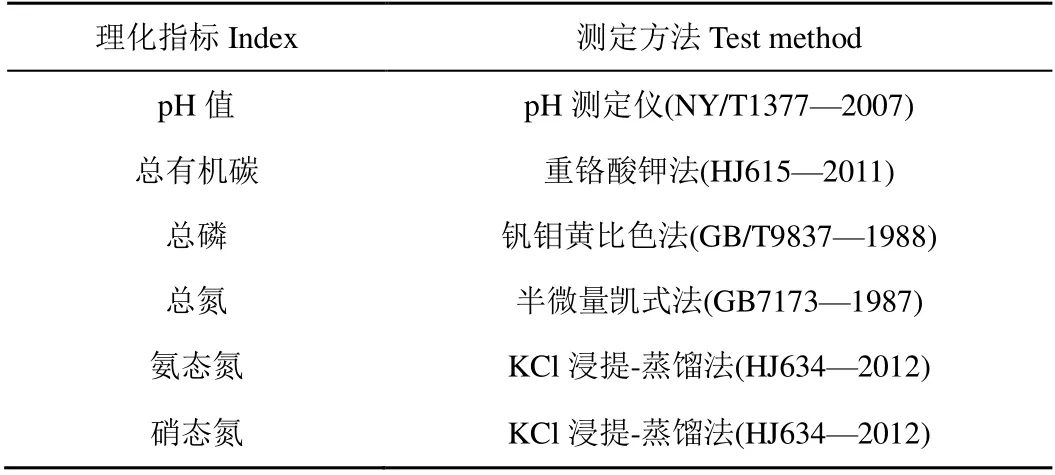
表2 沉积物理化指标测定方法 Table 2 Test method of physical and chemical indexes of sediments
1.4 高通量测序
采用 OMEGA 的 Soil DNA Isolation Kit(BioTek,Inc.,GA,USA)提取沉积物及水体样品总DNA,完成基因组DNA 抽取后,使用1%琼脂糖凝胶电泳检测抽取基因组DNA。采用通用引物338F(5'-ACTCCTACGGGAGGCAGCA-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')作为 16S rRNA 基因序列PCR 扩增的引物序列,进行V3~V4区目的基因PCR 扩增。将PCR 产物用2%琼脂糖凝胶电泳检测,使用 AxyPrepDNA 凝胶回收试剂盒(AXYGEN)公司切胶回收PCR 产物,Tris-HCl 洗脱,用25%琼脂糖电泳检测,参照电泳初步定量结果,将PCR 产物用QuantiFluorTM-ST 蓝色荧光定量系统进行检测定量,随后按照每个样本测序量要求,按照相应比例混合,做Miseq 测序[10],高通量测试在上海美吉生物公司进行。
1.5 数据分析
将相似性大于97%的优化序列划分为一个操作分类单元(Operational Taxonomic Units,OTU),对OTU 样本进行聚类分析,计算Chao1 指数、香农指数(Shannon)、文库覆盖率(Coverage),采用RDP-classifier 贝叶斯算法从各个分类水平对各个样本的群落组成进行分析[11]。利用相关性Spearman图分析理化因子与细菌群落结构关系;Origin(8.5版本)绘制物种丰度柱状图。采用SPSS 进行方差分析。
2 结果与分析
2.1 理化指标
南海湖水环境及沉积物理化因子分布情况见表3、表4。从表3 可以看出,不同湖区营养水平有一定差异,从水体看(表3),TN、NH4+-N、NO3--N、T 差异显著(0.01
岛内各种生活生产废水排放入旅游开发区,由于受人为污染较多,这一区域营养水平较其他区域偏高;由于水草区水生植物在冰封期的腐败,残体分解等过程,体内营养元素释放,各污染物的量处于较高的水平,且TP 和COD 较其他区域高;进水口受到黄河补水的影响,稀释了水体中营养物质造成,营养水平较低;湖心区受人为干扰因素较小,污染较少。总体来看沉积物营养水平与冰封期冰下水体分布大致相同。
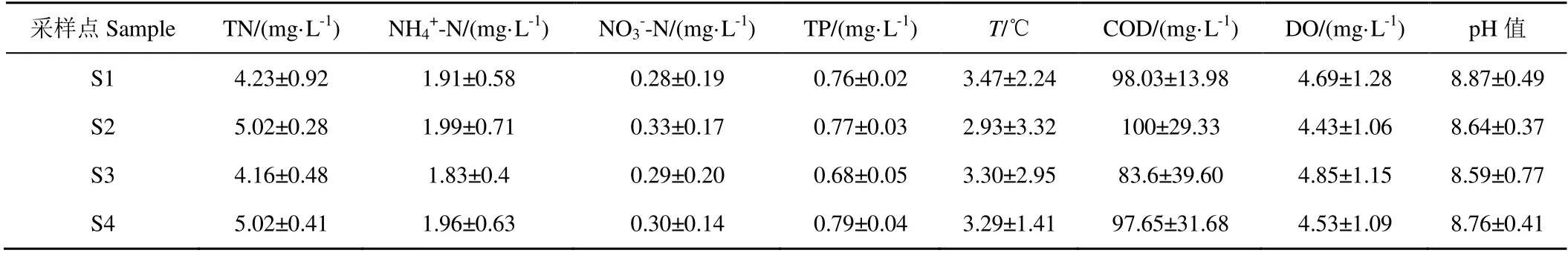
表3 南海湖水环境因子分布特征 Table 3 Distribution characteristics of water environmental factors in Nanhai Lake

表4 南海湖沉积物理化因子分布特征 Table 4 Distribution characteristics of sediments factors in Nanhai Lake
不同湖区沉积物中污染物质的量有一定差异,污染严重程度由高到低依次为S2>S4> S1> S3。沉积物整体呈弱碱性,TN、NH4+-N差异极显著(p<0.01),NO3--N 在S1、S3 湖区差异极显著(p<0.01),在S2、S4 湖区(0.01
2.2 OTU 聚类及多样性分析
各采样点α多样性指数及OTU聚类结果见表5。测序结果显示覆盖率均在99%以上,表明测序结果基本代表了样本中微生物的真实情况[12]。
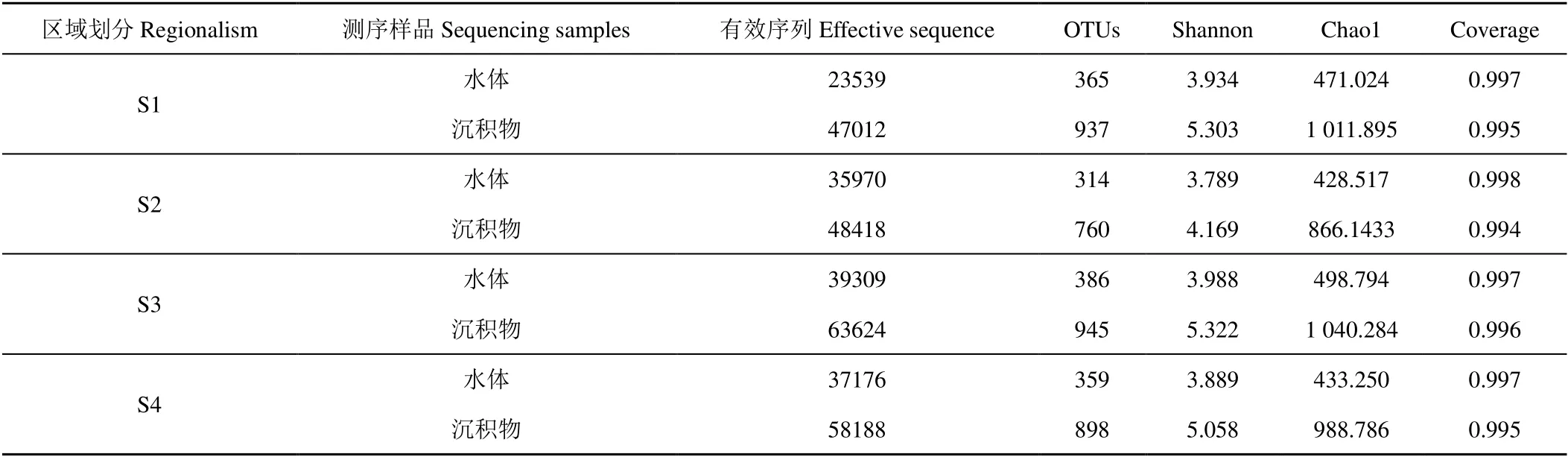
表5 各区域水体及沉积物OTU 聚类与多样性分析 Table 5 OTU clustering and diversity analysis of water and sediment in different regions
以多样性指数Sobs 做稀释曲线(图2),各样点的稀释曲线逐渐趋缓。通过Chao1、Shannon 等多样性指数综合来看,在本次试验中不同湖区样品物种丰度和均匀度大小依次为S3>S1>S4>S2。在冬季冰封期由于冰盖的影响导致水体内溶解氧较低,因此溶解氧成为制约微生物量的关键因素。
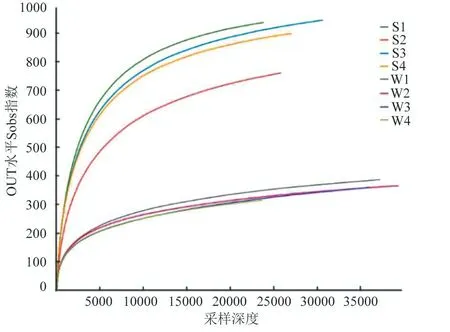
图2 稀释曲线 Fig.2 Rarefaction curve
为了探究不同区域水体、沉积物细菌的群落组成差异,对各个区域样品进行β 多样性分析(图3),在沉积物中湖心区与水草区沉积物细菌组成最为接近,进水口区次之;进水口区与旅游开发区细菌组成差异最大。在水体中,进水口区与湖心区细菌群落最为相似,水草区次之,类似的营养条件使得细菌群落结构最为接近。旅游开发区在其他季节受人为影响较大,故在经历冰封期的沉降作用后与其他区域细菌群落组成差异较大;虽然在冰封期进水口区接受黄河补水有限,但也对沉积物细菌组成造成了一定影响;湖心区与水草区均位于内湖,受外界干扰较小,细菌组成也最为接近。
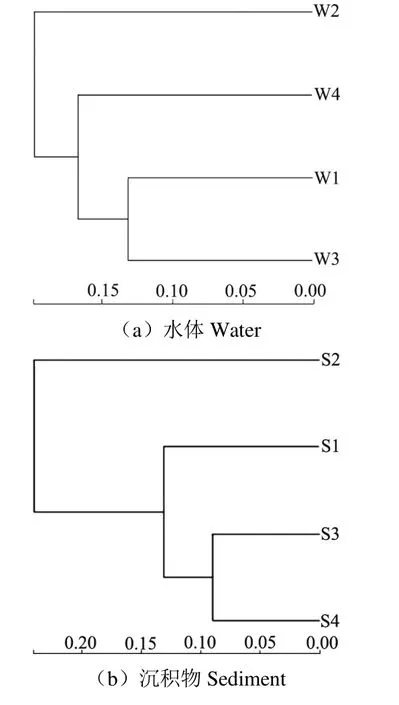
图3 样本层级聚类树 Fig.3 Hierarchical clustering tree
2.3 细菌群落结构
对测序结果进行分析得出,南海湖在冰封期水体及沉积物中具有较丰富的微生物群落结构。共计46 个门,1 073 个属。按门水平分类,水体及沉积物中优势种均集中在变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、蓝藻门(Cyanobacteria)、拟杆菌门(Bacteroidetes)和放线菌门(Actinobacteria)等(图4),其中变形菌门和绿弯菌门是沉积物中的优势菌属,绿弯菌门和拟杆菌门是水体中的优势菌。进水口区沉积物中变形菌门和绿弯菌门为优势菌种,此外,蓝藻细菌也较为丰富,水体中放线菌门、蓝藻门为优势菌种。旅游开发区沉积物中主要菌种为变形菌门、绿弯菌门和拟杆菌门,水体中主要菌种为蓝藻门、变形菌门和放线菌门。湖心区与水草区沉积物细菌组成较为相似,主要菌种为变形菌门、绿弯菌门,但二者的水体细菌差异较大,湖心区的优势菌种为放线菌门,水草区的优势菌种为蓝藻门。

图4 样品门水平优势细菌分布 Fig.4 Distribution of dominant bacteria at the phylum level

图5 样品属水平优势细菌分布 Fig.5 Distribution of dominant bacteria at the genus level
对样品在属水平上进行相对丰度计算(图5), 在沉积物中硫杆菌属(Thiobacillus)、未命名厌氧绳菌科(norank-f-Anaerolineaceae)、未分类绿弯菌科(unclassified-p-Chloroflexi)是优势菌属,在水体中,未分类蓝藻细菌(unclassified-Cyanobacteria)、分支杆菌属(Mycobacterium)和hgcl-clade 是优势菌属。硫杆菌属和norank-f-Anaerolineaceae 在进水口区丰度接近;硫杆菌属在旅游开发区内丰度较其他区域更高,此外unclassified-p-Chloroflexi 丰度也处于4 个采样点的最高水平;在湖心区与水草区,丰度最高的为norank-f-Anaerolineaceae,硫杆菌属的稍低,除此之外螺旋体属(Spirochaeta-2)、暖发菌属(Caldithrix)、硝化螺菌属(Nitrospira)等也均有检出。
2.4 细菌群落与环境因子相关性
环境因子对细菌群落结构有着显著影响,通过对环境因子与主要属水平细菌的相关性热图得出(图6):unclassified-c-Cyanobacteria 与pH 值、COD、DO、T 正相关,与TP、TN 负相关;Mycobacterium与TP、COD 正相关,与NH4+-N、NO3--N、NO2--N呈负相关;norank-o-PeM15 则与NH4+-N、NO3--N、NO2--N、Chaol 呈极显著负相关(p<0.001)。对hgcl-clade 影响较大的环境因子是TN。总体来看,TN、DO、T 对水体细菌群落结构影响较大。

图6 Spearman 相关性热图 Fig.6 Spearman correlation heat map
沉积物中硫杆菌属、unclassified-p-Chloroflexi 与TN、NH4+-N 正相关,与C/N 负相关,与TP 相关性不大;norank-f-Anaerolineaceae、norank-c-KD4-96与 TOC 负 相 关, 与 pH 值 正 相 关; 对norank-c-Cyanobacteria 影响较大的环境因子是TOC。总体来看,TN、NH4+-N、C/N 对沉积物细菌群落结构影响较大。沉积物理化因子的量受湖泊水体质量长期影响,短期内不会产生剧烈变化。由于南海湖氮污染及有机物污染严重,因而沉积物中氮元素的量及总有机碳对细菌群落结构影响显著。
3 讨 论
变形菌门能够适应复杂的生存环境,另外在变形菌门中已发现多种可参与氮循环的细菌,因此,其在南海湖中占据优势地位,绿弯菌门为兼性厌氧微生物,在冰封期水低体溶解氧的条件下依然可以保持较好的活性[14]。蓝藻门并不是沉积物中的优势菌种,但在水体中的量较高。各采样点间营养水平的差异,使微生物拥有不同的生存环境,进而影响细菌群落结构,变形菌门、绿弯菌门、放线菌门、拟杆菌门和蓝藻门在4 个采样点之间具有显著差异,Thiobacillus、unclassified-p-Chloroflexi、unrank-c-Bacteroidetes-vadinHA17 等在营养化水平较高区域丰度更高,放线菌门在营养化水平较低区域的量较高,Liu 等[15]在对太湖进行相关研究时也得出了类似结论。
在冰封期间,虽然低温在一定程度上限制了细菌的活性,但其仍然在湖泊物质循环中发挥着重要作用,且在本研究中细菌种类繁多。本次研究中,变形菌门、绿弯菌门在沉积物中有较高的量,这与薛银刚等[16]在对太湖进行的相关研究相似,但是与太湖相比,南海湖在冰封期独有的冰盖导致溶解氧量较低,检测到了种类繁多的厌氧菌,如硝化螺菌属、螺旋体属等。硫杆菌属是沉积物中的优势菌种,属于硫氧化细菌,可将还原态硫化物和元素硫氧化为硫酸。由于冰盖的存在使湖中污染物发生浓缩效应,污染状况较其他时间更为严重,占据优势菌种的硫杆菌属可以极大程度地减少水体中还原态硫化物的量,降低了水体中的污染,对减轻湖泊富营养化现象具有积极作用[17]。
unclassified-c-Cyanobacteria 是水体中占比最高的属。unclassified-c-Cyanobacteria 分布极广,普遍生长在淡水、海水和土壤中,并且在极端环境中也能生长,故有“先锋生物”的美称[18],因此在冰封期水体中虽然外界条件恶劣,但也能发现较多unclassified-c-Cyanobacteria 存在。在相关研究中unclassified-c-Cyanobacteria 类群具有固氮能力,通过氮气的固定提高稻田与其他土壤的肥力[19],但其在富营养化严重的水体中具有较高的量,是水体富营养化的指示生物,其中的一些属种普遍存在于发生赤潮与水华的水体中,导致水体环境的恶化及水生动物的死亡,由此可见南海湖中氮磷污染较为严重,若产生合适的条件极易爆发水华[20]。
造成湖泊富营养化的因素有很多,情况复杂,特别是在北方冰封期,由于冰盖的影响造成水体中溶解氧较低,并且营养物质发生沉降作用,使水体污染状况加剧。以往研究表明,南海湖在冰封期水体已呈现出富营养状态,沉积物中相关污染物也随之加剧,从而对沉积物细菌群落造成影响[9]。Winter等[21]对劳伦森大湖研究后发现硝态氮、氨氮以及有机物量是影响其中细菌群落结构的主要影响因子,而同样地处我国北方寒旱区的乌梁素海中,总磷、水溶盐总量和氨氮对其中细菌群落结构的影响最为明显。
unclassified-c-Cyanobacteria 为水体中各区域丰度较高的菌属,较多unclassified-c-Cyanobacteria 的存在,说明南海湖冰封期水体已呈现富营养化状态,污染已十分严重。pH 值、COD 是冰封期unclassified-c-Cyanobacteria 的主要影响因子,控制pH 值、COD 量是避免南海湖水华爆发的重要举措。
硫杆菌属为沉积物中各个区域丰度较高的菌属,其在南海湖冰封期生物物质循环中扮演着重要的角色[22]。从相关性热图可以看出,TN、NH4+-N以及COD 与硫杆菌属有较强的正相关。冰封期沉积物为硫杆菌属提供了良好的生存环境,鉴于其在预防水体恶化中的重要作用,应给予足够重视,通过研究分析出与硫杆菌属呈负相关的理化因子,从而控制其在水体及沉积物中的量,有效预防南海湖在冰封期水质发生恶化。
4 结 论
1)在冰封期,溶解氧成为影响细菌物种丰富度的关键因素,物种丰富度依次为旅游开发区>水草区>进水口区>湖心区。
2)冰封期南海湖细菌主要类群分别为Proteobacteria 、 Chloroflexi 、 Cyanobacteria 、Bacteroidetes 和Acidobacteria;从属水平分析,优势类群集中在Thiobacillus、unclassified-c-Cyanobacteria、unclassified-p-Chloroflexi。
3)南海湖在冰封期已经呈富营养化状态,控制TN、NH4+-N 以及COD 量是避免南海湖水华爆发的重要举措。
