维生素K2促进BM-MSCs成骨分化及其机制研究
2020-10-27许志贤何武兵柯铁张永发傅超锋蔡加琴张桂枫
许志贤 何武兵 柯铁 张永发 傅超锋 蔡加琴 张桂枫
福建医科大学省立临床医学院/福建省立医院,福建 福州 350001
各种原因如创伤、感染等造成的骨缺损、骨不愈合一直是骨科治疗的难题之一,骨组织工程、生长因子和基因修饰是研究较多的治疗手段,以提高骨密度从而促进骨的再生[1]。由于骨髓来源间充质干细胞(bone marrow derived-mesenchymal stem cells, BM-MSCs)是一类来源于中胚层且具有强大增殖潜力和多向分化能力的一种前体干细胞,其来源不受限制,取材方便,分离后在体内或特定的条件下,能够向成骨细胞分化[2],是再生医学和组织工程研究中重要的种子细胞,在骨组织工程和细胞治疗中具有广阔的应用前景,也为骨科疑难问题提供了新的解决途径。维生素K2是一种脂溶性维生素,是参与血液凝固的关键因子[3]。流行病学研究[4]显示缺乏维生素K2可能导致骨质疏松症和老年人的骨关节炎。此外,它在临床上已被用于预防骨质疏松症,并且可能通过促进成骨细胞分化和矿化发挥其保护作用[5]。本研究旨在观察不同浓度维生素K2对BM-MSCs成骨分化过程的影响,探讨维生素K2对BM-MSCs成骨信号轴中Smad1/5/8、Runx2、成骨细胞特异性转录因子(Osterix) 等表达的调节作用,为维生素K2作为潜在的促成骨分化因子协同MSCs应用于骨缺损等相关骨科疾病提供实验基础。
1 材料与方法
1.1 材料
DMEM低糖培养基 (Gibco公司,美国);胎牛血清 (FBS,赛默飞世尔生物化学制品有限公司);青霉素-链霉素混合液(Gibco公司,美国),0.25%胰酶 (Gibco公司,美国);CCK-8细胞计数试剂盒(碧云天公司,中国);维生素K2 (Sigma公司,美国);成骨诱导培养基(Cyagen公司,美国);PCR相关试剂isoPlus、PrimesScriptTMRT Kit反转录试剂盒和SYBR© Premix Ex TaqTMⅡ Kit(Takara,Japan);Runx2 兔抗鼠单克隆抗体(Abcam公司,英国);Smad1/5/8 兔抗鼠单克隆抗体(Novus公司,美国);Osterix兔抗鼠单克隆抗体(Abcam公司,英国);倒置相差显微镜(Olympus IX50,日本);荧光定量PCR仪器 (Eppendorf,德国);Western blot成像系统(Bio. Rad,美国);Western blot半干转膜仪 (Bio. Rad,美国)。
1.2 方法
1.2.1BM- MSCs分离、培养:按前期实验方法[6]对骨髓来源的间充质干细胞进行分离、培养。 选取1月龄SD大鼠,雌雄不限 [购自福建省医学科学研究院,实验动物许可证号: SYXK(闽)2016-0004]。无菌环境下抽取胫骨骨髓,加入肝素抗凝。混入Percoll分离液进行离心,获取鼠的骨髓间充质干细胞。接种于培养瓶中,加入L-DMEM完全培养基,于5% CO2, 37 ℃培养箱中培养3 d后换液,待细胞融合80%后进行传代。
1.2.2CCK-8 法检测细胞增殖能力:将生长良好的BM-MSCs以10 000/cm2的密度接种于96孔板,孵育24 h后,分为加药组(维生素K2组)和对照组,加药组加入含维生素K2浓度(10-9~10-4mol/L)的L-DMEM,对照组加入L-DMEM,每组4个样本,分别于24、48和72 h检测细胞增殖能力。每孔加入10 μL CCK-8溶液,未接种细胞孔调零,37 ℃ 培养箱中孵育 1 h,酶标仪 450 nm 处测吸光度值。
1.2.3Real-time PCR检测成骨相关基因BMP-2表达:将生长良好的BM-MSCs接种于六孔板,待细胞融合至70%,吸弃培养液。根据CCK-8实验结果,将后续实验分为两组:加药组和对照组。加药组加入含不同浓度的维生素K2 (10 nmol/L, 100 nmol/L, 1 μmol/L)的成骨诱导培养基,对照组是成骨诱导培养基,置于5% CO2, 37 ℃培养箱中继续培养。第3天收集细胞,每孔细胞加入 1 mL的RNA裂解液,提取细胞总RNA并检测浓度,反转录后实时荧光定量PCR检测成骨相关基因BMP-2的表达。引物序列:GAPDH上游引物为 5’- TGT TCC TAC CCC CAA TGT GT-3’,下游引物 为5’-GGT CCT CAG TGT AGC CCA AG-3’,BMP-2 上游 引物为 5′-TGTGG ACTTCAG TGATGTG-3′,下游引物 为 5′-TGGAGTTCAGG TGGT CAG-3′。
1.2.4茜素红染色:将生长良好的BM-MSCs接种于六孔板,待细胞融合至70%,吸弃培养液。实验分为两组:加药组和对照组,加药组加入含不同浓度的维生素K2 (10 nmol/L, 100 nmol/L, 1 μmol/L)的成骨诱导培养基,以成骨诱导培养基为对照组,置于5% CO2,37 ℃培养箱中继续培养,于成骨诱导的第7天、14天和21天,行茜素红染色。方法如下:PBS清洗细胞2遍后,每孔加4%多聚甲醛固定20 min,PBS清洗2次后,加入1.5 mL茜素红染液,30 min后PBS清洗2遍,放入倒置相差显微镜下观察并拍照。
1.2.5Western blot检测Smad1/5/8, Runx2及Osterix蛋白表达水平:将生长良好的BM-MSCs接种于六孔板,待细胞融合至70%,吸弃培养液。实验分为两组:加药组和对照组,加药组加入终浓度为1 μmol/L维生素K2的成骨诱导培养基,以成骨诱导培养基为对照组,置于5% CO2,37 ℃培养箱中继续培养,3 d后收集细胞,提取总蛋白,BCA法检测蛋白浓度。取20 μg 蛋白样品,经8% SDS-PAGE分离,电转到硝酸纤维膜上后,封闭2 h,加入一抗(兔抗Smad1/5/8,Runx2, Osterix抗体或兔抗-β-actin 抗体) 4 ℃过夜,1 × TBST溶液洗涤5次,每次5 min,加二抗(HRP标记的羊抗兔 IgG 抗体),室温孵育2 h,ECL显色,放入Bio-Rad成像仪中,打开软件进行扫描与分析。
1.3 统计学方法
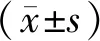
2 结果
2.1 BM-MSCs的形态学表现
原代培养BM-MSCs 48 h时,细胞形态多呈短梭形和多角形,随着培养时间延长,细胞呈三角形、多角形和梭形;一周左右可见细胞趋于融合。第3代细胞形态基本趋于梭形(图1)。后续实验所用的细胞是第三代。
图1 BM-MSC形态学观察(×200)Fig.1 Aspect of BM-MSCs at confluence(×200)
2.2 不同浓度维生素K2对BM-MSCs细胞活性的影响
使用CCK法分析不同浓度的维生素K2处理BM-MSCs细胞不同时间后对细胞生长的影响。与对照组比较,随着处理时间的延长,维生素K2在浓度小于1 nmol/L时不影响BM-MSCs的生长活性,维生素K2在浓度为10 nmol/L、100 nmol/L、1 μmol/L时明显促进BM-MSCs的生长(P<0.05),当浓度高于1 μmol/L时对BM-MSCs的活力呈抑制趋势,10 μmol/L时则明确抑制细胞的生长(P<0.05),见图2。可见不同浓度的维生素K2对BM-MSCs生长影响作用不同,中浓度(10 nmol/L, 100 nmol/L, 1 μmol/L)维生素K2对BM-MSCs生长呈促进作用。
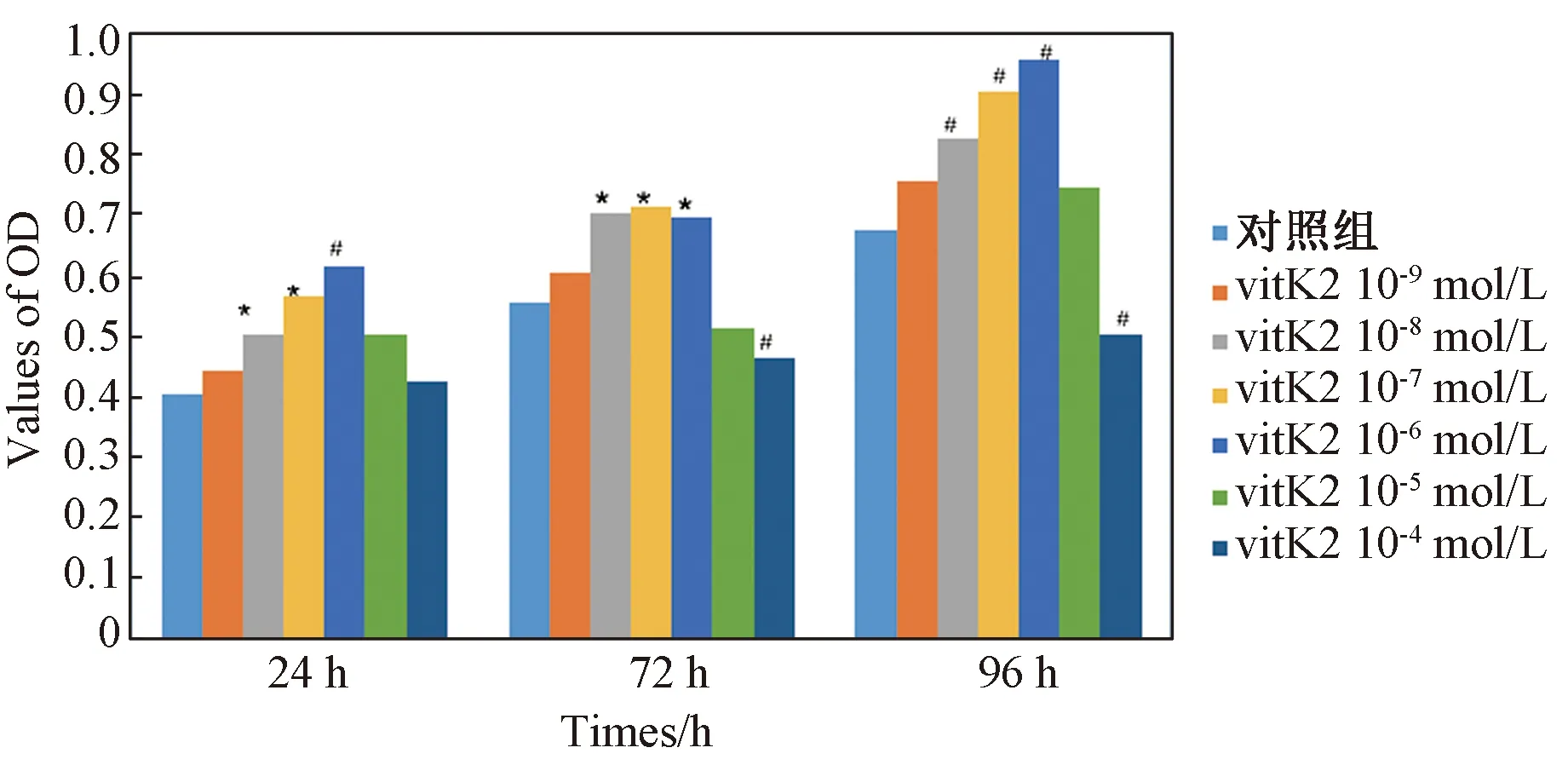
图2 维生素K2对BM-MSC生长的影响注:与对照组比较,*P<0.05, #P<0.01。Fig.2 Effects of Vitamin K2 on the growth of
2.3 不同浓度维生素K2对BM-MSCs成骨过程中BMP-2mRNA的影响
不同浓度维生素K2干预72 h后,Q-PCR结果显示,与对照组比较,不同浓度(10 nmol/L、100 nmol/L、1 μmol/L)的维生素K2对BM-MSCs成骨过程中BMP-2 mRNA表达具有明显促进作用,在剂量范围内,随着浓度的增加,BMP-2 mRNA表达升高越明显,差异具有统计学意义(P<0.01),且1 μmol/L维生素K2对BMP-2 mRNA表达的促进作用比10 nmol/L和100 nmol/L更明显(P<0.05),见图3。
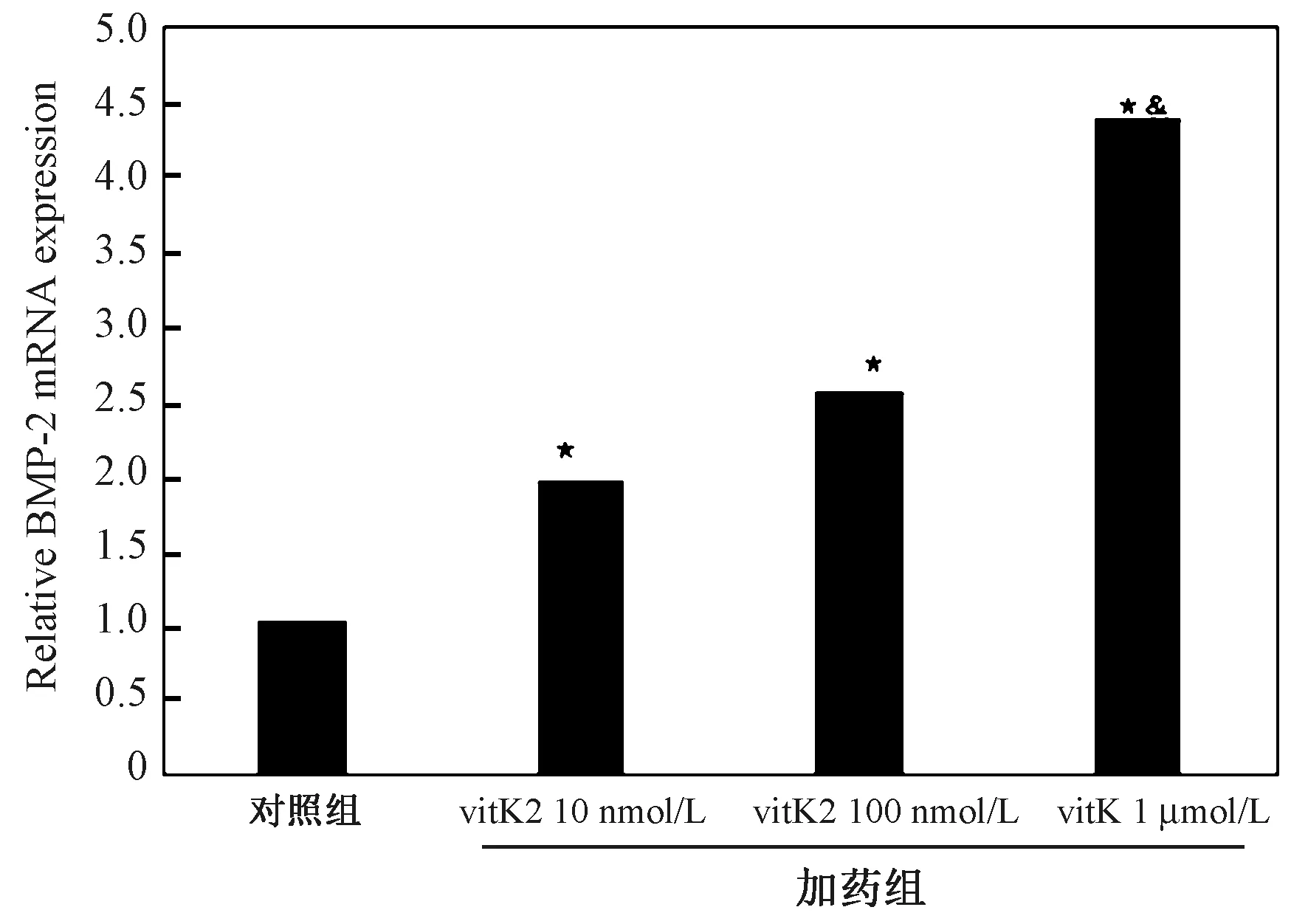
图3 维生素K2对BM-MSCs成骨过程中BMP-2 mRNA的影响注:与对照组比较,*P<0.01;与10 nmol/L和100 nmol/L组比较,&P<0.05。Fig.3 Effects of Vitamin K2 on the expression of BMP-2 mRNA in BM-MSCs
2.4 维生素K2对BM-MSCs成骨过程中钙结节形成的影响
钙结节是BM-MSCs向成骨细胞分化的重要标志之一。与对照组比较,不同浓度(10 nmol/L、100 nmol/L、1 μmol/L)的维生素K2在BM-MSCs成骨分化的第7、14、21天均具有促进钙结节形成的作用,并且该作用呈浓度依赖性(图4),表明维生素K2在BM-MSCs在成骨分化整个过程均发挥促进作用。
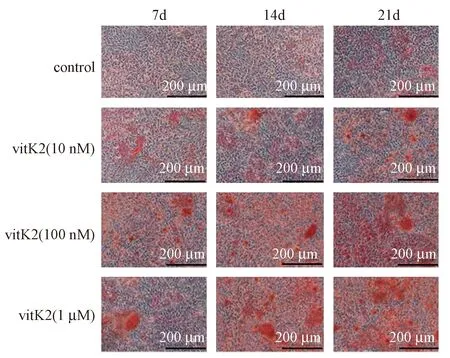
图4 不同浓度维生素K2对BM-MSCs成骨分化过程中钙结节的影响Fig.4 Effects of Vitamin K2 with Different Concentrations on the Calcium Nodules during Osteogenic Differentiation of BM-MSCs
2.5 维生素K2对BM-MSCs成骨过程中Smad1/5/8、Runx2 及 Osterix 蛋白表达的影响
Western blot结果显示,与对照组比较,1 μmol/L的维生素K2处理BM-MSCs 3 d后,可明显增强成骨信号轴Smad1/5/8、Runx2和Osterix蛋白表达水平 (图5)。
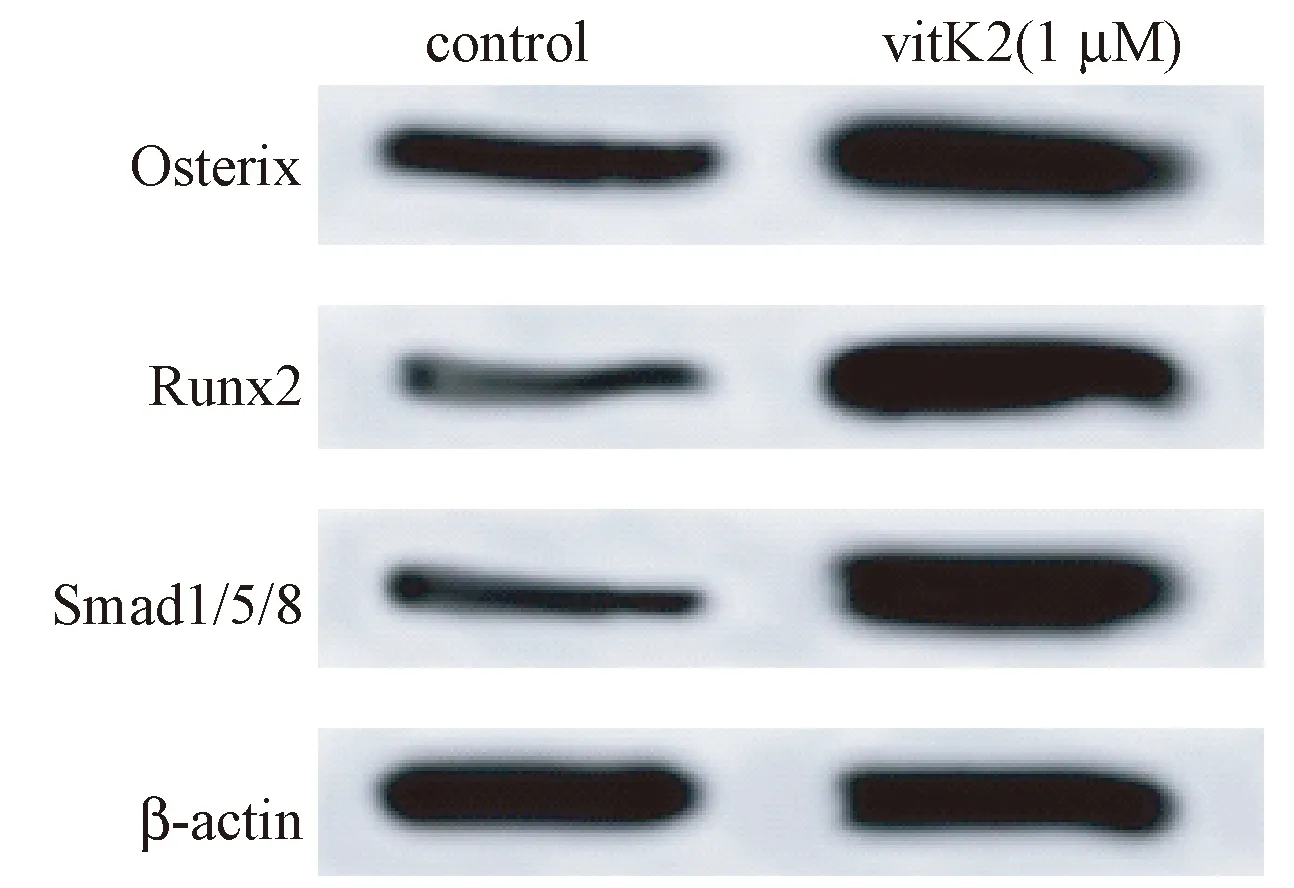
图5 维生素K2对BM-MSCs中Smad1/5/8、Runx2 和Osterix表达的影响Fig.5 Effect of vitamin K2 on expression of Smad1/5/8, Runx2 and Osterix in BM-MSCs
3 讨论
维生素K2是维生素K家族中唯一具有生物活性的脂溶性维生素, 是人体骨和钙代谢的必需物质,在骨和钙代谢中发挥着关键及决定性的作用[7]。近年的研究[8]已经证实维生素K2对成骨细胞具有保护作用,维生素K2可促进成骨细胞增殖和体外成骨细胞-骨细胞转变,包括细胞外基质中的OCN积累、Runx2和碱性磷酸酶(ALP)的上调以及成骨基因的转录,从而促进成骨细胞的分化和矿化,因此在骨质疏松的治疗中可能发挥重要作用。BM-MSCs因具备强大的增殖能力及分化能力已经成为骨组织工程重要的种子细胞,在骨折愈合及骨质疏松等骨科疾病的治疗都具有重要价值。如何使BM-MSCs定向成骨分化及探索内在机制将成为研究的焦点。维生素K2对BM-MSCs生化和成骨分化作用却未见报道,此次研究结果显示BM-MSCs的生长受维生素K2的浓度变化影响较大,低浓度(小于1 nmol/L)不影响BM-MSCs的生长,中浓度维生素K2(10 nmol/L、100 nmol/L、1 μmol/L)明显促进BM-MSCs的生长,而高浓度维生素K2(高于1 μmol/L) 呈明显地抑制作用。中浓度维生素K2在BM-MSCs成骨分化的第7、14、21天均具有明显促进矿化的作用。
目前已知多种信号通路如Wnt/β-catenin、MAPK、成纤维细胞生长因子(FGFs)及ERK等参与BM-MSCs的成骨分化过程[9-12]。这些信号相互联系相互影响,组成复杂而精细的调控网络,共同调节BM-MSCs的成骨分化。研究[13-14]表明BMP信号通路在骨组织形成、间充质干细胞成骨分化及骨再生过程中发挥着关键作用。有报道[15]显示维生素K2通过诱导自噬而促进成骨细胞MC3T3-E1的成骨分化。本研究中维生素K2在中浓度范围内(10 nmol/L、100 nmol/L、1 μmol/L)可显著促进骨髓来源BM-MSCs的成骨分化,促进成骨相关因子BMP-2mRNA的表达,且与在该浓度范围内呈药物剂量相关性。后续研究采用不影响BM-MSCs生长且保持促进成骨作用的药物浓度(1 μmol/L)。Smad信号通路是调控BMP发挥成骨作用的主要通路,Runx2和Osterix 都是BMP/Smad通路重要的调控转录因子[16-17]。Runx2是参与成骨细胞分化与骨形成的重要转录因子之一,该基因发生突变后将会导致颅骨销骨发育不全综合征[18]。Osterix在成骨细胞分化中发挥重要调控作用,研究[19]发现Osterix在小鼠胚胎发育期的骨形成细胞中高表达,敲除后小鼠的骨组织发生发生严重障碍。本实验发现经维生素K2处理3天后,BM-MSCs的Smad1/5/8、Runx2以及Osterix蛋白水平均较对照组有显著升高,表明维生素K2对BM-MSCs成骨分化早期的促进作用可能是通过这一信号通路实现。
综上所述, 本次研究初步证实了维生素K2具有定向促进BM-MSCs成骨分化的作用,并且成骨信号轴BMP-2/Smads/Runx2/Osterix与维生素K2的促成骨分化作用密切相关,是维生素K2促进成骨分化的分子机制之一,为维生素K2作为潜在的促成骨分化因子协同MSCs用于骨缺损等相关骨科疾病提供实验基础。
