山竹醇介导JAK2/STAT3信号通路发挥抗骨肉瘤作用
2020-10-26程安源
宋 奇 程安源 徐 立 余 铃 夏 平
Anti-osteosarcomaEffectofGarcinolbyMediatingJAK2/STAT3SignalingPathway.SongQi,ChengAnyuan,XuLi,etal.DepartmentofOrthopedics,WuhanFirstPeople′sHospital,Hubei430022,China
AbstractObjectiveTo study the effect of garcinol on cell viability, cell cycle distribution, apoptosis of osteosarcoma cells and the growth of subcutaneous tumor in nude mice and further explore its mechanism.MethodsU2OS cells were treated with vary concentrations of garcinol. The cell viability of osteosarcoma cells were detected by CCK-8 assay.The cell cycle distribution and apoptosis rate of U2OS cells were determined by flow cytometry. The subcutaneous osteosarcoma model of nude mice was constructed to detect the effect of garcinol intraperitoneal injection on the growth of subcutaneous tumor of nude mice. RNA-Sequence analysis was used to detected genes influenced by garcinol treatment. The expression levels of proteins in JAK2/STAT3 signal pathway were detected by Western blot.ResultsCCK-8 assay showed that garcinol reduces cell viability of U2OS cells in a concentration- and time-dependent manner. The results of flow cytometry suggested that garcinol treatment could arrest cell cycle at S phase and induce apoptosis of osteosarcoma cells. Furthermore, garcinol inhibited the growth of subcutaneous tumor in nude mice. Gene-Set Enrichment Analysis showed that JAK/STAT signaling pathway was significant enriched in garcinol treated osteosarcoma cells. The expression levels of p-JAK2, p-STAT3, Bcl-xl were significantly decreased and the expression level of Bax were significantly increased in osteosarcoma cells and osteosarcoma tumor tissues treated with garcinol.ConclusionGarcinol exerts anti-osteosarcoma effect in vitro and in vivo, which may be related to the down-regulation of JAK2/STAT3 signaling pathway.
KeywordsGarcinol; Osteosarcoma cells; Cell viability; JAK2/STAT3 signaling pathway
骨肉瘤(osteosarcoma, OS)是人体骨骼系统最常见的恶性肿瘤,好发于青少年,常见于长管状骨干骺端,恶性程度高,预后较差[1]。骨肉瘤患者的治疗手段,早期主要包括外科截肢手术治疗、放疗及化疗等,患者5年生存率不足10%。近年来随着对肿瘤病因、病理及药理等研究的深入,以及新辅助化疗方案的出现,患者的5年生存率明显提高,但仍无法与乳腺癌等肿瘤相比[2]。由于顺铂、阿霉素等常用的化疗药物的毒性作用及长期使用会导致化疗耐药的出现,限制了临床上化疗药物选择、影响治疗的效果[3]。因此,亟需寻找新的低毒、高效的抗肿瘤药物,而国内外越来越多的研究者开始从祖国传统医学里面寻找抗肿瘤新药[4]。
山竹醇(garcinol)是从印度藤黄的干果皮中提取出来的黄色结晶化合物,其主要成分为多聚异戊二烯基苯甲酮,具有抗炎、抗氧化、抗肿瘤等多种药理活性,也可作为低分子抑制剂抑制组蛋白乙酰基转移酶活性[5,6]。既往研究表明,山竹醇对多种肿瘤细胞能产生明显抑制作用,包括口腔鳞状细胞癌、宫颈癌、非小细胞肺癌等,这些研究虽证明山竹醇具有抗多种肿瘤细胞活性,但是未能深入探究山竹醇抗癌机制,并且山竹醇在骨肉瘤中的作用及机制目前还未见报道[7~9]。本研究通过体外细胞实验和在体动物实验探究山竹醇抗骨肉瘤作用,并借助RNA-Seq测序手段初步探究其抗骨肉瘤作用的相关机制,以期为山竹醇后续进行化疗药物增敏实验及用于临床上骨肉瘤患者的治疗提供实验基础。
材料与方法
1.材料:人骨肉瘤U2OS细胞系购自中国科学院上海细胞库。α-MEM培养基购自美国Hyclone公司。1%双抗(青霉素100U/ml, 链霉素100μg/ml)、细胞周期检测试剂盒、胰蛋白酶购自武汉谷歌生物科技公司;DMSO购自美国Sigma公司,山竹醇购自美国Glpbio公司;CCK-8(Cell Counting Kit-8)购自上海陶素生物科技有限公司;细胞凋亡检测试剂盒购自美国BD公司;抗GAPDH、JAK2、p-JAK2、STAT3、p-STAT、Bax和Bcl-xl一抗均购自美国CST公司。
2.细胞培养:人骨肉瘤U2OS细胞培养在含有5%CO2的培养箱中培养,并调整培养温度为37℃,给予含有10%胎牛血清和1%双抗的α-MEM培养基,隔天换1次液,后续细胞实验和裸鼠皮下种植实验均取对数生长期细胞进行。
3.细胞活力检测:将细胞消化重悬后,调整骨肉瘤U2OS细胞密度为5×105/ml,取100μl接种于96孔板上,孵育8h待细胞贴壁后,加入不同浓度的山竹醇(0、1、3、10、30、100μmol/L),分别培养24h和48h,PBS洗1次后,每孔加入100μl CCK-8试剂和培养基的混合液(1∶9),37℃避光孵育1h,使用多功能酶标仪并调整波长为450nm,测量每孔细胞的吸光度值(A)。细胞活力(%)=实验组平均A值/对照组平均A值×100%。
4.细胞周期检测:用不同浓度山竹醇(0、3、10、30μmol/L)处理骨肉瘤U2OS细胞24h后,用冷PBS洗涤2次,收集细胞后用75%乙醇固定过夜,离心后用PBS洗涤1次,加入200μl冷PBS重悬细胞,再加入2μl RNA酶A(1mg/ml)和50μl PI(50μg/ml),室温下置于暗盒中孵育30min,用流式细胞仪分析细胞周期分布。
5.细胞凋亡分析:不同浓度山竹醇(0、3、10、30μmol/L)处理骨肉瘤U2OS细胞24h后,离心收集细胞,取200μl结合缓冲液重悬细胞,依次加入Annexin Ⅴ/FITC和PI荧光染料,各5μl,后样品置于暗盒中室温下孵育20min,然后再加入300μl结合缓冲液重悬细胞,随即用流式细胞仪进行细胞凋亡检测。
6.Western blot法检测:不同浓度山竹醇(0、3、10、30μmol/L)处理骨肉瘤U2OS细胞24h后,收集细胞,加入RIPA细胞裂解液冰水裂解30min,4℃、12000r/min离心后取上清,提取总蛋白蛋白,蛋白定量后取10μg总蛋白,进行10%或12%聚丙烯酰胺凝胶电泳分离,电泳条件为100V、120min,电泳完成后进行湿法转膜,转膜条件为200mA、90min,转膜完成后用5%脱脂奶粉于室温封闭1h,TBST洗涤3次,每次10min,加入相应一抗孵育过夜。TBST溶液振摇洗涤3次,每次10min,按1∶3000稀释辣根过氧化物酶标记二抗,室温摇床孵育1h。在暗室中将PVDF膜用底物显影后曝光分析结果。蛋白表达水平=目的蛋白灰度值/GAPDH的灰度值。
7.裸鼠成瘤实验:BALB/c-nu裸鼠购自武汉华联科生物技术有限公司,18只裸鼠随机分为3组,通过打耳标进行标记,饲养1周待小鼠状态恢复后,于右侧背部皮下接种处于对数生长期的U2OS骨肉瘤细胞,每只裸鼠接种细胞量约为5×106个。每3天监测小鼠生长情况及成瘤情况,接种1周后开始隔天腹腔注射山竹醇,分为高剂量组(2mg/kg)和低剂量组(1mg/kg)[7]。对照组注射相同体积的DMSO,每3天测量1次皮下瘤的长径和短径。接种4周后,裸鼠全身麻醉后通过颈椎脱位法处死,取出瘤体组织,-80℃冰箱保存。皮下瘤体积(mm3)=(长径×短径2/2)。
8.RNA-Seq测序分析:将山竹醇(10μmol/L)处理24h后U2OS骨肉瘤细胞样本与对照组样本收集后,提取总RNA,每组重复3次,-80℃保存,由武汉谷歌生物科技公司完成RNA-Seq测序。取处理组和对照组中基因改变|log2(Fold Change)|>2的基因为差异基因,使用GSEA4.0.3软件进行基因富集分析。

结 果
1.山竹醇对骨肉瘤U2OS细胞活力的影响:用不同浓度的山竹醇处理骨肉瘤细胞24h或48h后,采用CCK-8法检测骨肉瘤细胞活力。随着药物作用时间的延长或药物浓度的增加,与空白对照组(0μmol/L山竹醇)比较,山竹醇处理组中,U2OS细胞活力逐渐降低(图1)。
2.山竹醇对骨肉瘤U2OS细胞周期分布的影响:采用PI单染流式细胞术检测骨肉瘤细胞经不同浓度山竹醇处理后细胞周期分布的变化。骨肉瘤细胞经不同浓度山竹醇(0、3、10、30μmol/L)处理后,处于S期的细胞显著增加,与空白对照组比较,差异有统计学意义(P<0.05)(图2)。
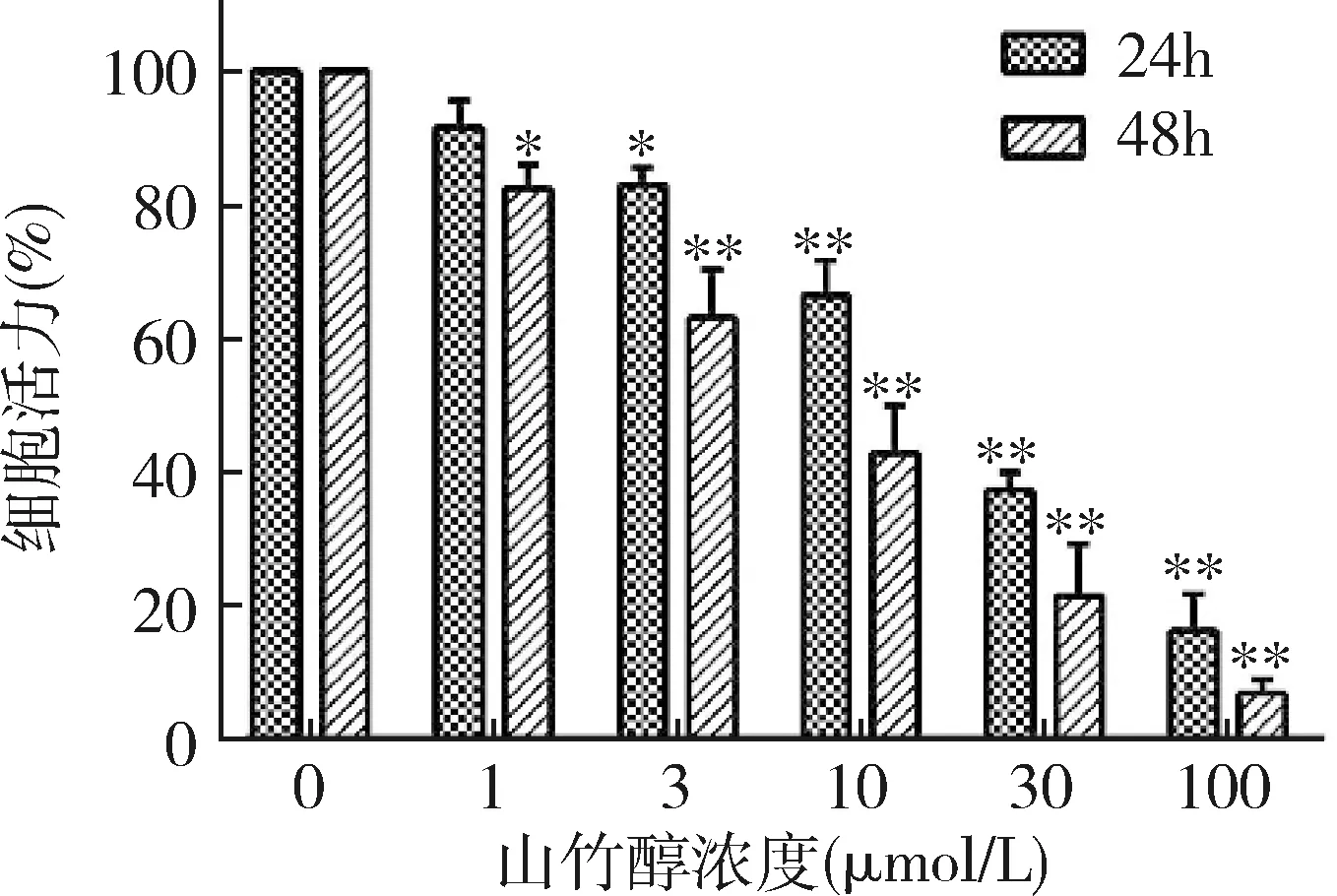
图1 山竹醇对骨肉瘤U2OS细胞活力的抑制作用与0μmol/L比较,*P<0.05,**P<0.01
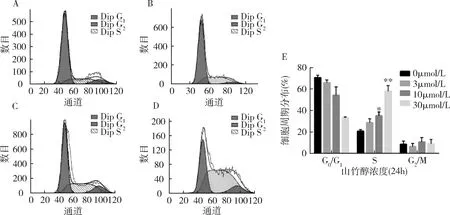
图2 山竹醇对骨肉瘤U2OS细胞周期分布的影响A.对照组(0μmol/L山竹醇处理组);B.3μmol/L山竹醇处理组;C.10μmol/L山竹醇处理组;D.30μmol/L山竹醇处理组;E.细胞周期定量分析。与0μmol/L比较,*P<0.05,**P<0.01
3.山竹醇对骨肉瘤U2OS细胞凋亡的影响:使用不同浓度山竹醇(0、3、10、30μmol/L)处理骨肉瘤细胞24h后,采用流式细胞术检测骨肉瘤细胞凋亡率。随着山竹醇药物浓度的增加,U2OS细胞凋亡率也显著提高(图3)。
4.山竹醇对骨肉瘤细胞JAK2/STAT3信号通路的影响:将山竹醇(10μmol/L)处理24h后U2OS骨肉瘤细胞样本进行RNA-Seq测序分析。共有2388个基因表达水平发生改变(|log2(fold change)|>2),其中1351个基因上调,1037个基因下调。进一步通过基因富集分析发现,山竹醇处理的骨肉瘤细胞中JAK/STAT信号通路显著富集,并且表现为信号通路活性降低。进一步通过Western blot法检测细胞中p-JAK2、p-STAT3、Bax、Bcl-xl水平,发现山竹醇处理细胞中p-JAK2、p-STAT3、Bcl-xl水平明显降低,而Bax表达水平显著升高,并且具有浓度依耐性(图4)。
5.山竹醇对裸鼠骨肉瘤生长的影响:山竹醇能抑制裸鼠皮下骨肉瘤的生长。检测山竹醇处理骨肉瘤组织中p-JAK2、p-STAT3、Bax和Bcl-xl水平,发现山竹醇处理肿瘤组织中p-JAK2、p-STAT3和Bcl-xl水平明显降低,而Bax表达水平显著升高,并且具有浓度依耐性(图5),这一结果与细胞实验结果相符。
讨 论
随着病理学、影像学、药理学等多学科的发展以及外科手术的进步,目前临床上对于早期局限性骨肉瘤患者,经过规范诊疗后5年生存率可达70%,然而,对于复发或转移的患者尚无切实有效的治疗手段[10,11]。骨肉瘤作为一种间叶组织来源的恶性肿瘤,对放疗敏感度较差,基于手术切除和化学药物治疗的综合治疗手段是骨肉瘤患者的常见治疗手段[12]。其中化疗药物对杀伤肿瘤细胞、预防肿瘤的复发具有重要意义,但对正常组织细胞也具有一定的杀伤作用并且长期使用会出现药效的下降[13]。因此寻找高效且低毒的抗肿瘤药物是当前研究的一大方向,越来越多的学者将目光投向祖国传统中药。

图3 山竹醇对骨肉瘤细胞凋亡率的影响A.对照组(0μmol/L山竹醇处理组);B. 3μmol/L山竹醇处理组;C.10μmol/L山竹醇处理组;D.30μmol/L山竹醇处理组;E.细胞周期定量分析。G1~G4.分别为坏死细胞、晚期凋亡细胞、正常细胞、早期凋亡细胞;与0μmol/L比较,*P<0.01

图4 山竹醇对骨肉瘤细胞中p-JAK2、p-STAT3、Bax和Bcl-xl表达的影响A.基因表达矩阵火山图分析;B.基因表达矩阵GSEA分析;C.JAK/STAT信号通路基因热图分析;D.蛋白电泳结果;E.蛋白定量分析。与0μmol/L比较,*P<0.05,**P<0.01

图5 山竹醇对裸鼠骨肉瘤生长及肿瘤组织中p-JAK2、p-STAT3、Bax和Bcl-xl表达的影响*P<0.05,**P<0.01
山竹醇已被证明具有治疗各种人类疾病的潜力,如糖尿病、哮喘、心血管疾病和神经退行性疾病,而近年来山竹醇抗肿瘤活性逐渐被证实。Duan等[14]研究发现,山竹醇能抑制膀胱癌细胞增殖和侵袭,可能与山竹醇抑制AKT和STAT3的磷酸化、降低MMP2、MMP9的表达有关。Zhang等[15]研究证实,山竹醇能抑制口腔鳞癌细胞的增殖、迁移和侵袭,可能与其抑制细胞线粒体氧化磷酸化,影响细胞能量代谢有关。Wang等[16]研究表明,山竹醇能通过降低p300/CBP 和p-Smad2/3水平发挥抑制食管癌转移的作用。此外,也有学者证实,山竹醇也能影响肿瘤细胞干细胞特性和化疗药物敏感度。Huang等[17]研究表明,山竹醇能通过抑制Wnt/β-catenin/STAT3信号通路抑制非小细胞肺癌细胞“干细胞表型”。Li等[18]通过体外动物实验发现,山竹醇能增强头颈鳞状细胞癌对于顺铂的敏感度。而探讨山竹醇在骨肉瘤中的作用的研究目前还不多见,因此,本研究初步探索山竹醇对骨肉瘤U2OS细胞活力、细胞周期分布和凋亡的影响及对裸鼠皮下肿瘤生长的影响,并初步探索其相关作用机制,以期为后续进行化疗药物增敏实验提供基础。
本研究用不同浓度的山竹醇(0、1、3、10、30、100μmol/L)处理骨肉瘤U2OS细胞24h或48h后,CCK-8结果显示,山竹醇能时间、浓度依耐性的抑制骨肉瘤细胞活力,表明山竹醇具有一定的抗骨肉瘤细胞作用。诱导细胞凋亡和周期阻滞是抗肿瘤药物的重要特征之一,为探究山竹醇对骨肉瘤细胞凋亡率和细胞周期分布的影响,采用流式细胞术检测不同浓度山竹醇处理后骨肉瘤细胞凋亡率及细胞周期分布的变化,结果显示,山竹醇能诱导U2OS细胞凋亡,并导致细胞周期阻滞于S期,这一效应具有浓度依耐性。进一步验证山竹醇的在体作用,通过皮下种植骨肉瘤细胞,2周后待皮下成瘤,通过腹腔注射山竹醇,监测皮下肿瘤的生长,结果表明,山竹醇能抑制裸鼠皮下骨肉瘤的生长。
为进一步探究山竹醇抗骨肉瘤细胞的作用机制,笔者进行了RNA-Seq测序分析。结果表明,与对照组比较,山竹醇处理细胞中共有2388个基因表达水平发生改变,其中1351个基因上调,1037个基因下调。进一步通过基因富集分析发现,山竹醇处理的骨肉瘤细胞细胞中JAK/STAT信号通路显著富集,并且表现为信号通路活性降低。JAK/STAT信号通路是由蛋白酪氨酸激酶(JAKs家族)和信号转导及转录活化因子(STATs家族)组成,目前已发现,哺乳动物中JAKs家族共有4种激酶,即JAK1、JAK2、JAK3和Tyk2,除JAK3外,在JAKs家族蛋白在组织细胞中广泛分布。STATs家族作为JAKs的靶蛋白,共有STAT1、STAT2、STAT3、STAT4、STAT5a、STAT5b和STAT6 7种,各种信号引起受体偶联的JAKs家族激酶相互聚集,磷酸化修饰而激活,进一步引起下游STATs家族蛋白发生磷酸化修饰而发生二聚化,进入细胞核内,调控下游基因的转录、表达[19]。有关JAK2/STAT3信号通路的研究最为常见,大量研究证实,JAK2/STAT3信号通路在肿瘤中高度活化,广泛参与细胞增殖、分化、凋亡以及炎症等过程,抑制JAK2/STAT3信号通路能通过抑制细胞周期进程、诱导细胞凋亡等生物学过程而抑制肿瘤细胞的增殖[20]。
针对JAK2/STAT3信号通路的靶向治疗是目前肿瘤药物研究中热点。本研究发现,山竹醇处理的骨肉瘤细胞及肿瘤组织中p-JAK2、p-STAT3和Bcl-xl水平明显降低,而Bax表达水平显著升高,并且具有浓度依耐性。这些结果表明,山竹醇可能是通过抑制骨肉瘤中JAK2/STAT3信号通路的激活,诱导凋亡相关性蛋白的表达从而发挥抗骨肉瘤作用,此外抑制JAK2/STAT3信号通路的活性能诱导肿瘤细胞周期阻滞,这与以往的研究相符,说明JAK2/STAT3信号通路可能作为抗骨肉瘤药物研发的重要靶点。但本研究尚未探究山竹醇处理细胞中JAK2/STAT3信号通路抑制的具体机制,后续会进一步探讨。
综上所述,山竹醇能在体内、体外发挥一定的抗骨肉瘤作用,可能与其抑制骨肉瘤中JAK2/STAT3信号通路活性,导致细胞周期阻滞,诱导凋亡相关性蛋白的表达并促进细胞凋亡有关。
