白酒酒糟中醇溶蛋白的提取及性质比较
2020-10-22侯梦媛范文来徐岩
侯梦媛,范文来*,徐岩
1(江南大学 生物工程学院,江苏 无锡,214122) 2(工业生物技术教育部重点实验室(江南大学),江苏 无锡,214122) 3(江南大学 酿造微生物与应用酶学研究室,江苏 无锡,214122)
白酒酒糟是粮谷类作物经过发酵、蒸馏生产白酒而产生的混合固体废弃物,是酿酒行业最主要的副产物。据统计,2018年我国约产生2 344万t酒糟,其营养丰富,包含蛋白质、脂肪、淀粉、纤维素、维生素和无机盐等。因此为了解决酒糟堆积所带来的资源浪费和环境污染问题,针对酒糟高附加值再利用的研究必不可少。如今,酒糟已被开发成饲料[2]、沼气[3]、肥料[4]和白炭黑[5]等,除此之外,提取酒糟中的高附加值物质也是一种非常可取的酒糟再利用途径。目前已有关于多肽[6-7]和类黑精[1]提取分离的相关报道,通过对具有血管紧张素转换酶(angiotensin converting enzyme,ACE)抑制活性多肽的鉴定,揭示了酒糟在治疗高血压方面的潜在可能性,而酒糟中类黑精的提取和活性鉴定,也为酒糟的高附加值利用提供了新思路。目前关于白酒酒糟中醇溶蛋白的提取和利用尚未见报道。
高粱和小麦是白酒酿造和制曲的主要原料,经发酵和蒸馏后大量营养成分特别是蛋白质残存于酒糟中,使得酒糟蛋白含量丰富[7]。醇溶蛋白是谷物中的一种贮藏蛋白,是种子萌发时的主要碳源和氮源[8],在高粱和小麦蛋白中比例较高,占高粱总蛋白的77%~82%[9],小麦总蛋白的50%~60%[8],但醇溶蛋白在酒糟中的比例尚不清楚。高粱和小麦中提取的醇溶蛋白具有较高的工业应用潜力,这得益于其较强的疏水性、难消化性以及广泛的交联性等特性。醇溶蛋白已经在可食性薄膜及涂层、胶黏剂、药物控释和乳化稳定剂等领域得到了研究与开发。比如,目前醇溶蛋白可食用涂层的保鲜性能已经在梨[10]、牛油果[11]和鸡肉[12]上得到证实;醇溶蛋白基胶黏剂[13]的黏合性能良好,且比常见的大豆蛋白基胶黏剂疏水性更强;有研究者通过醇溶蛋白微粒负载泼尼松龙[14]以及儿茶素和高粱缩合单宁[15]证实了其在药物控释方面的潜力。对酒糟这一白酒工业副产物进行醇溶蛋白的提取及开发,既能够解决酒糟的堆积和污染、提高酒糟附加值,又能够在一定程度上代替高粱和小麦等谷物,从而节约谷物的用量。
研究者们已经探索出了几种对于醇溶蛋白提取的方法。EMMAMBUX等[16]通过修改一种广泛应用于玉米醇溶蛋白提取的方法,从而得到了醇碱法,并首次将其应用到了高粱醇溶蛋白的提取,因提取效果良好而得到广泛应用;乙酸法是由TAYLOR等[17]开发的一种针对高粱醇溶蛋白提取的方法,由于乙酸相对于乙醇来说具有不易燃、宗教接受度高以及与食物相容的特性,因此被认为是优良的醇溶蛋白提取方法。除此之外,异丙醇[18]、叔丁醇[19]和碱性硼酸钠/十二烷基硫酸钠缓冲液[20]也在醇溶蛋白提取上有所应用。
本实验以干燥前后浓香型白酒酒糟为研究对象,对蛋白组分分布进行分析后,分别用醇碱法和乙酸法提取酒糟中的醇溶蛋白,通过对醇溶蛋白提取得率及纯度、分子质量、氨基酸组成、基本结构和热性质的分析比较,进而确定适合于干燥前后酒糟醇溶蛋白提取的方法,为酒糟醇溶蛋白的研究和应用奠定基础,提高酒糟的附加值。
1 材料与方法
1.1 样品与试剂
样品:浓香型酒糟,安徽金种子酒业股份有限公司。
试剂:无水乙醇、NaOH、CuSO4·5H2O、K2SO4、H2SO4、KOH、KBr、焦亚硫酸钠、乙酸、三氯乙酸,AR级,国药集团。
1.2 仪器与设备
Kjeltec 8400凯氏定氮仪,丹麦FOSS公司;Agilent 1100高效液相色谱仪(high performance liquid chromatography,HPLC),美国Agilent公司;Centrifuge 5418冷冻离心机,德国Eppendorf公司;Avanti J-E高速冷冻离心机,美国Beckman Coulter公司;恒温水浴锅、电热鼓风干燥箱,上海博讯实业有限公司;Millipore-Q超纯水系统,美国Millipore公司;冷冻干燥机,美国LABCONCO公司;RY-280A多功能粉碎机,永康市锐意机电有限公司;Nexus 400傅里叶红外光谱仪,美国NICOLET公司;DSC Q2000差示扫描量热仪,美国TA仪器公司。
1.3 实验方法
1.3.1 酒糟前处理
鲜酒糟:从白酒厂直接取样;干酒糟:将鲜酒糟置于70~80 ℃的电热鼓风干燥箱中烘干至质量恒定,并对烘干后的酒糟去除稻壳。
1.3.2 酒糟蛋白组分分级提取
采用Osborne分级提取法略作修改后,对酒糟各蛋白组分进行逐级分级提取,称取适量酒糟粉,料液比为1∶10(g∶mL),提取时间2 h,重复2次;清蛋白:以超纯水为提取溶剂,提取温度20 ℃;球蛋白:以0.5 mol/L NaCl溶液为提取溶剂,提取温度20 ℃;醇溶蛋白:以体积分数70%乙醇水溶液为提取溶剂,提取温度70 ℃;谷蛋白:以0.1 mol/L KOH溶液为提取溶剂,提取温度90 ℃。
1.3.3 酒糟醇溶蛋白的提取
醇碱法:参照WANG等[21]的方法,对酒糟中的醇溶蛋白进行提取。以含质量浓度5 g/L焦亚硫酸钠和3.5 g/L NaOH的体积分数70%乙醇水溶液作为提取剂,料液比1∶10(g∶mL),70 ℃搅拌提取1 h,3 500×g离心10 min,重复提取3次,收集上清液;将上清液乙醇体积分数稀释至40%后将其置于-20 ℃冰箱中静置12 h;3 500×g离心10 min,收集沉淀,并用蒸馏水洗涤沉淀3次,冻干;用正己烷对冻干粉末进行脱脂,室温下通风橱干燥,重复3次,即得酒糟醇溶蛋白粉末。
乙酸法:参照TAYLOR等[17]的方法,取适量酒糟在相对其4倍体积的质量浓度5 g/L焦亚硫酸钠溶液中浸泡16 h,过滤后去除焦亚硫酸钠溶液,用乙酸作提取剂,料液比1∶5(g∶mL),25 ℃下搅拌提取1 h,1 000×g离心10 min,重复提取3次,收集上清液;在冰浴条件下用饱和NaOH溶液将上清液pH调节到5.0以沉淀蛋白,4 ℃静置12 h后3 500×g离心10 min,收集沉淀,并用蒸馏水洗涤沉淀3次,冻干;正己烷脱脂,室温下通风橱干燥,重复3次,即得酒糟醇溶蛋白粉末。
1.3.4 水解氨基酸测定
称取100.0 mg左右的酒糟醇溶蛋白于水解管中,加入8 mL 6 mol/L的 HCl溶液,充N23 min,放入120 ℃烘箱中水解22 h,加入4.8 mL 10 mol/L NaOH溶液中和水解样品,用蒸馏水定容,双层滤纸过滤后取1 mL于1.5 mL离心管中15 000×g离心30 min,取400 μL上清液进行HPLC分析;OPA柱前衍生,色谱柱为Hypersil ODS柱(4 mm×250 mm,5 μL);流动相A为体积比为500∶0.11∶2.5的27.6 mmol/L乙酸钠∶三甲胺∶四氢呋喃(pH 7.2),流动性B为体积比为1∶2∶2的80.9 mmol/L乙酸钠∶乙腈∶甲醇(pH 7.2),波长338和262 nm,流速1 mL/min;洗脱条件:初始体积分数8%B,0~17 min为50%B,17.0~20.1 min为100%B,20.1~24.0 min为0%B;使用17种氨基酸作外标[7]。
1.3.5 傅里叶红外光谱测定
采用Nexus 400傅里叶红外光谱仪分析酒糟醇溶蛋白的结构。将约4 mg样品和150 mg KBr在光滑的研钵中彻底研磨,在400~4 000 cm-1收集数据。
1.3.6 差示扫描量热仪测定
酒糟醇溶蛋白的热性质采用DSC Q2000差示扫描量热仪进行测定,该仪器在测试前已经用铟和锌进行了校准。称取5~10 g样品于铝盘中,密封后在N2下以50 mL/min的流速测定样品,其中测定温度以10 ℃/min的速率从25 ℃加热到280 ℃。
1.4 数据分析
采用Excel和Origin Pro 9.1软件进行统计整理。
2 结果与分析
2.1 酒糟蛋白组分分布
根据溶解度的差异可将酒糟的蛋白质分成不同组分,各蛋白组分分布情况如图1所示。其中球蛋白的含量在酒糟总蛋白中的分布比例最低,谷蛋白和清蛋白次之,醇溶蛋白含量最高,占44%~50%,是白酒酒糟中含量最高的蛋白组分。因此,本研究对酒糟中的醇溶蛋白进行提取,以期提高白酒酒糟的附加值。

图1 白酒酒糟蛋白组分分布情况Fig.1 Protein fractionation of distiller’s grains of Baijiu
2.2 酒糟醇溶蛋白的提取
表1显示了不同方法对新鲜和干燥白酒酒糟中醇溶蛋白的提取得率及纯度,其中醇碱法的提取得率及纯度均高于乙酸法,该结果与高粱干酒槽及其可溶物(distillers driers grains with solubles,DDGS)中提取醇溶蛋白的结果相似。对于干燥前后酒糟中醇溶蛋白的提取,醇碱法似乎并未受到较大影响,提取得率及纯度较接近,而乙酸法虽蛋白提取纯度相差无几,但蛋白得率之间差异较大。因此,从提取得率及纯度的角度看,醇碱法更适合于白酒酒糟中醇溶蛋白的提取。
表1 白酒酒糟醇溶蛋白的提取得率及纯度

单位:%
2.3 不同方法提取的干燥前后酒糟醇溶蛋白的比较
2.3.1 分子质量
醇溶蛋白是由多个亚基组成的一类蛋白质,通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳 (sodium dodecyl sulfate-polyacrylamide gel electrophoresis, SDS-PAGE) 将酒糟醇溶蛋白按照分子质量的差异分成不同条带,结果如图2所示。醇碱法提取的干燥前后酒糟醇溶蛋白的电泳条带基本相同且表现的较清晰,其中分别分离到了分子质量为25和23 kDa的α1和α2-醇溶蛋白以及18 kDa的β-醇溶蛋白,而乙酸法提取的醇溶蛋白由于提取纯度相对较低,因而使分离到的蛋白亚基条带强度低。

M-蛋白质Marker;泳道1-醇碱法提取的干酒糟醇溶蛋白;泳道2-醇碱法提取的鲜酒糟醇溶蛋白;泳道3-乙酸法提取的干酒糟醇溶 蛋白;泳道4-乙酸发提取的鲜酒糟醇溶蛋白图2 白酒酒糟醇溶蛋白SDS-PAGE谱图Fig.2 SDS-PAGE of prolamin from distiller’s grains of Baijiu
2.3.2 氨基酸组成
图3显示了不同方法提取的干燥前后白酒酒糟醇溶蛋白的氨基酸组成。其中谷氨酸、亮氨酸、丙氨酸、脯氨酸、苯丙氨酸、异亮氨酸、天冬氨酸和缬氨酸是白酒酒糟醇溶蛋白中含量较高的氨基酸。醇碱法提取的干燥前后酒糟醇溶蛋白,其氨基酸无论在种类还是含量上均未因酒糟的干燥而产生较大差异;而乙酸法提取的醇溶蛋白,虽氨基酸种类相同,但在含量上存在着较明显的差异;因此相比于乙酸法,醇碱法提取的醇溶蛋白的氨基酸含量更高,且干酒糟和鲜酒糟醇溶蛋白之间的氨基酸含量差异小。
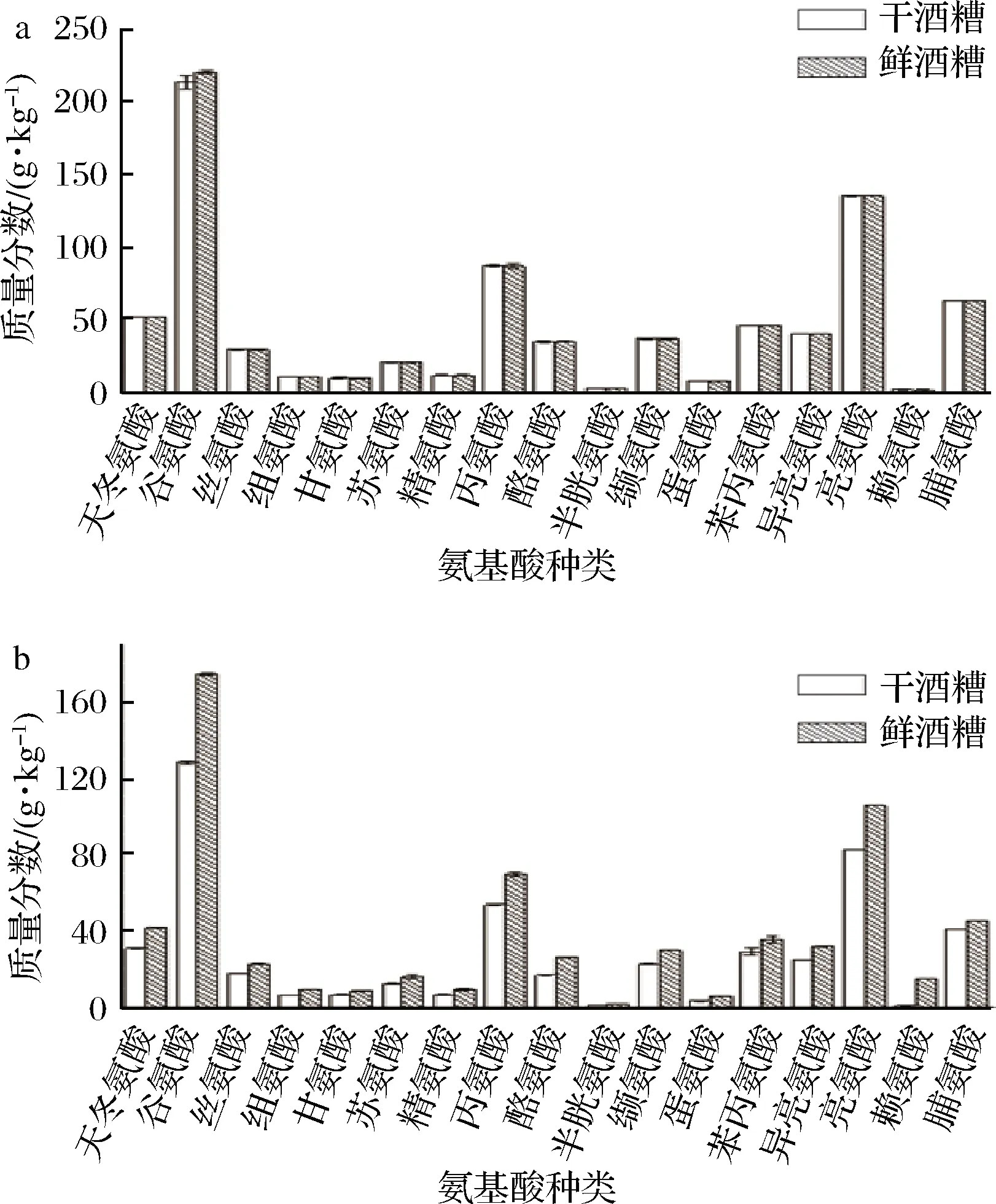
a-醇碱法;b-乙酸法图3 白酒酒糟醇溶蛋白氨基酸组成Fig.3 Amino acid composition of prolamin from wet and dried distiller’s grains
2.3.3 傅里叶红外光谱测定
醇溶蛋白提取物并非完全的纯品,据文献报道可能含有少量酚类及糖类物质[16, 21]。图4为白酒酒糟醇溶蛋白提取物的傅里叶红外光谱(Fourier transform infrared spectrometer,FTIR)图,醇碱法和乙酸法提取的干燥前后醇溶蛋白的光谱图均表现的极为相似,醇碱法提取纯度相对要高于乙酸法。其中白酒酒糟与高粱DDGS[21]中醇溶蛋白提取物的谱图基本保持一致,从图4中我们可以观察到几个特征吸收谱带,其中包括位于3 300和3 070 cm-1处的酰胺A和A’,1 660、1 540和1 240 cm-1处的酰胺Ⅰ、Ⅱ和Ⅲ,而图4中表现较强的为酰胺Ⅰ谱带,其中酰胺Ⅰ被认为是能够代表蛋白质二级结构中α-螺旋结构的谱带。

a-醇碱法;b-乙酸法图4 白酒酒糟醇溶蛋白傅里叶红外光谱图Fig.4 FTIR of prolamin from wet and dried distiller’s grains
2.3.4 差示扫描量热仪测定
如图5所示,相比于醇碱法,乙酸法提取的干燥前后酒糟醇溶蛋白,其差示扫描量热仪(differential scanning calorimetry,DSC)热谱图显示出了较大的差异,其中干酒糟和鲜酒糟分别在175.17和138.21 ℃附近出现吸热峰。吸热峰意味着醇溶蛋白的变性,表明乙酸法提取的干燥前后的酒糟醇溶蛋白在变性温度上存在着较大差异;而醇碱法提取的醇溶蛋白的吸收峰位置分别在137.64和136.22 ℃附近,两者之间的变性温度差异小,表明所提取的干燥前后酒糟醇溶蛋白的变性温度较一致,且与高粱中醇溶蛋白的变性温度接近。
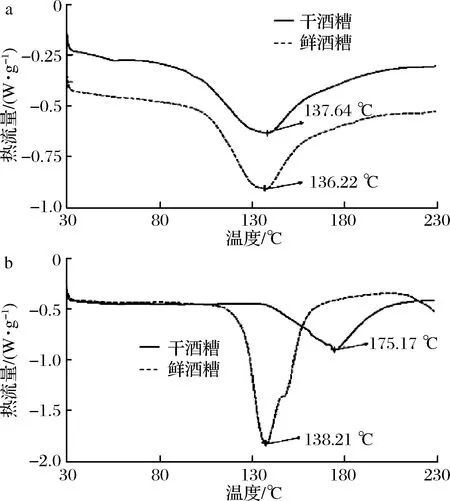
a-醇碱法;b-乙酸法图5 白酒酒糟醇溶蛋白热分析图Fig.5 Thermograms of prolamin from wet and dried distiller’s grains
3 结论
在实际应用中,若要避免夏季高温时的霉变,需对酒糟进行干燥处理,为尽量保持干酒糟和鲜酒糟中醇溶蛋白品质的一致性,便于后续对酒糟及其醇溶蛋白的高附加值再利用,本研究分别采用醇碱法和乙酸法,探究适合于干燥前后白酒酒糟中醇溶蛋白的提取方法。从提取得率及纯度上来看,醇碱法要优于乙酸法,且醇碱法的提取效果并未因酒糟的干燥处理而受到显著影响,而乙酸法对于鲜酒糟的提取得率显著高于干酒糟;从醇溶蛋白来看,无论酒糟干燥与否,醇碱法提取的醇溶蛋白在分子质量、氨基酸组成、FTIR和DSC方面均无明显差异,而乙酸法提取的干燥前后酒糟醇溶蛋白,虽FTIR分析差异不明显,但在分子质量、氨基酸组成和DSC分析上均有所不同。综上所述,醇碱法更适合于干燥前后白酒酒糟中醇溶蛋白的提取。
