藏药俄色叶的化学成分及药理作用研究进展
2020-10-20徐俊陈华林陈蓉蔡晓洋李敏
徐俊 陈华林 陈蓉 蔡晓洋 李敏

摘 要 目的:探究藏药俄色叶的化学成分及其药理作用,为俄色叶的深入研究和开发利用提供参考。方法:以“俄色叶”“变叶海棠”“花叶海棠”“Malus toringoides(Rehd.)Hughes”等为关键词,在中国知网、万方数据、PubMed等数据库中组合查询2000年1月-2020年2月发表的相关文献,对俄色叶的化学成分及药理作用进行归纳总结。结果与结论:共检索到相关文献193篇,其中有效文献57篇。俄色叶的化学成分主要包括根皮苷、根皮素、槲皮苷、异槲皮苷等黄酮类成分及咖啡酸、对香豆酸等酚酸类成分,具有降血糖、降血脂、抗氧化、保肝、耐缺氧、抗疲劳、抗炎等药理作用。目前,对俄色叶的药效成分研究集中于粗提物上,且尚未涉及体内化学成分变化,因此,应注意其潜在药效成分在体内的作用过程,促进俄色叶在药动学和临床应用方面的研究。
关键词 俄色叶;黄酮类化合物;根皮素;降血糖;降血脂;抗氧化
中图分类号 R961 文献标志码 A 文章编号 1001-0408(2020)18-2300-05
DOI 10.6039/j.issn.1001-0408.2020.18.22
俄色叶(藏文名
1 化学成分
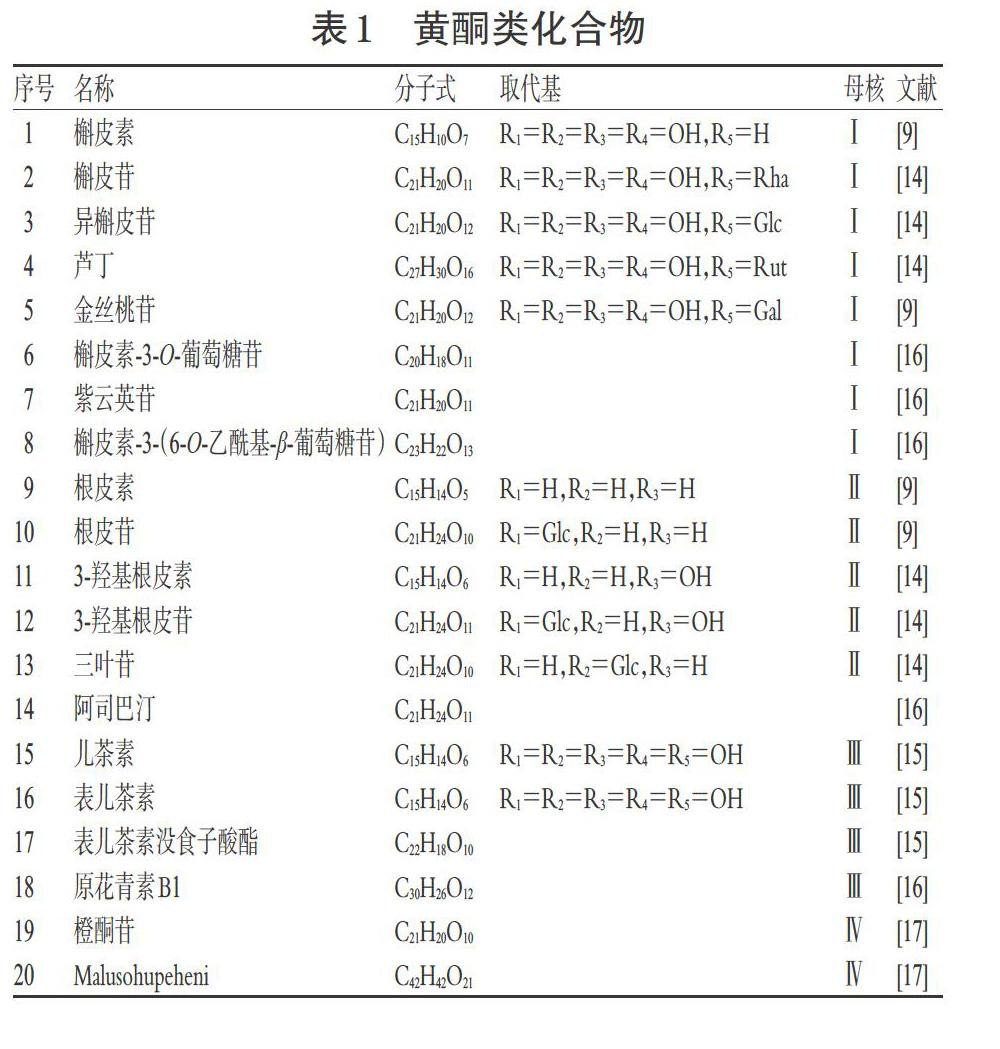
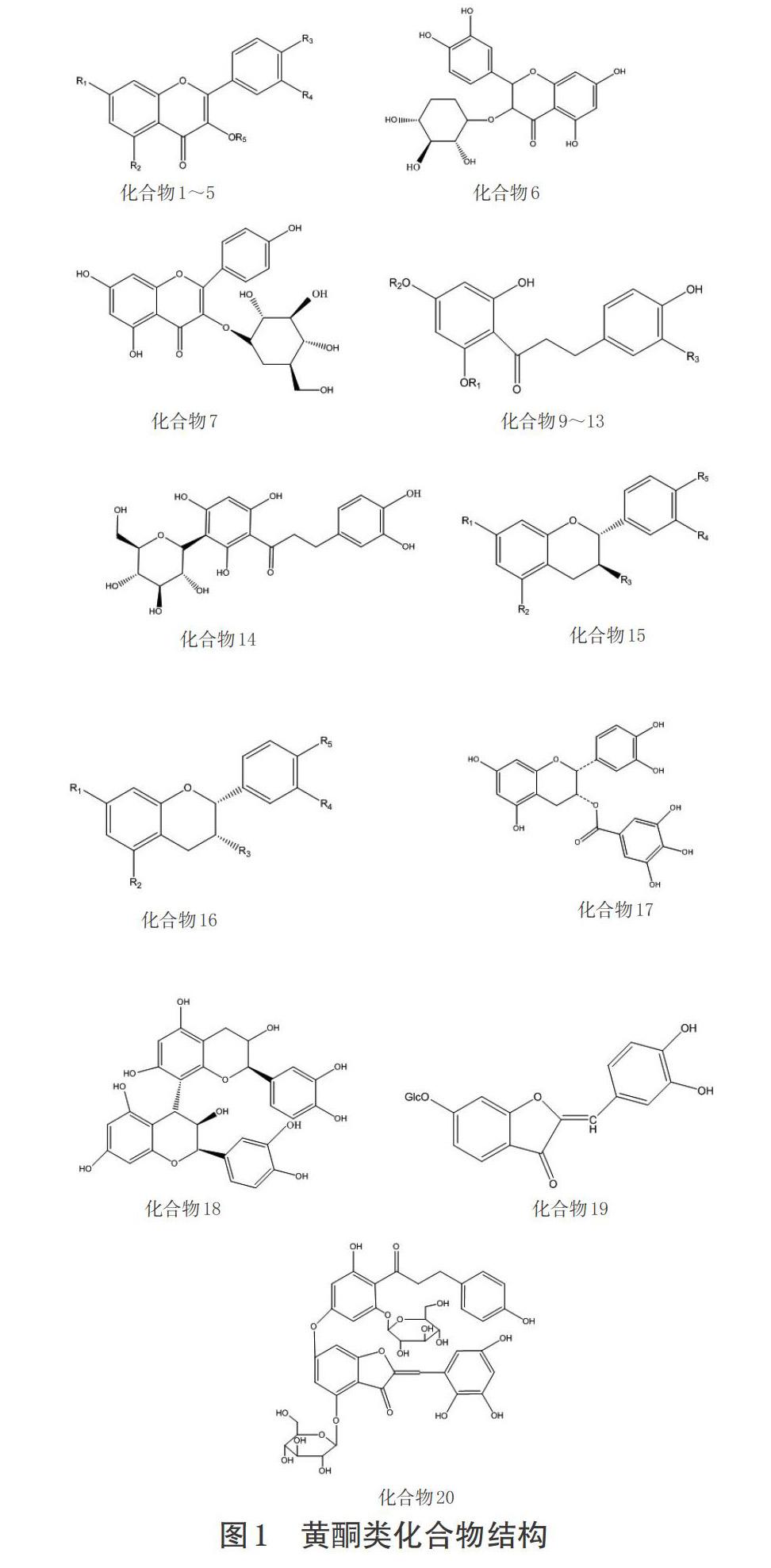
目前,已从俄色叶中分离鉴别20余种化合物,主要包含黄酮类、酚类、芳香类。俄色叶的黄酮类成分(如根皮苷、根皮素)具有多种重要生物活性,其总黄酮含量为同科属植物西府海棠叶的2.81倍[6];其根皮苷含量约为湖北海棠叶的6倍[7],为尖嘴林檎叶的33倍[8]。由此可见,俄色叶的黄酮含量对保证其药材质量和药效具有重要意义。
1.1 黄酮类化合物
黄酮类化合物是俄色叶主要的活性物质,其提取方法包括超声波辅助提取法、溶剂提取法,通过柱层析法、质谱、正/反相色谱法、Sephadex LH-20凝胶柱色谱进行分离纯化[9-13]。王道清[9]从俄色叶中提取分离得到根皮苷、根皮素、槲皮素和金丝桃苷等4种化合物;杨威等[14]从俄色叶中分离得到10种黄酮类化合物,包括5种二氢查耳酮型、5种黄酮醇型;张磊[15]从俄色叶中分离得到3种黄烷醇型化合物;Fan ZF等[16]利用超高效液相色谱-电喷雾串联高分辨质谱质谱联用(UHPLC-ESI-HRMS/MS)从俄色叶中分离得到12种黄酮类化合物。目前,从俄色叶中共分离出20种黄酮类化合物,主要类型包括:黄酮醇(母核-Ⅰ)、二氢查耳酮(母核-Ⅱ)、黄烷醇(母核-Ⅲ)、橙酮(母核-Ⅳ),详见表1、图1。
1.2 酚酸类化合物
酚酸类化合物主要通过超声辅助有机溶剂法、超临界流体萃取法、酸水提取法、碱液提取法、酶解法、超声微波酶解法进行提取,采用大孔树脂分离法、反相硅胶色谱、半自动制备型液相色谱等进行分离纯化[18]。从俄色叶中已分离鉴别出2种酚酸类化合物,分别是咖啡酸和对香豆酸,详见表2、图2。
1.3 芳香类化合物
俄色叶中的芳香类化合物具有良好抗菌活性,可采用溶剂提取法进行提取,萃取法进行分离纯化[19]。从俄色叶醇溶性溶剂中首次分离出1,2-环氧-1-(3,4-二羟基-苯基)-3-(2,4,6-三羟基-苯基)-丙烷,被命名为俄色素[19],详见图3。
1.4 其他
俄色葉中还含有白果内酯、土大黄苷、常春藤皂苷元[17]、茶碱、鞣质、多糖、维生素、蛋白质、脂肪酸、微量元素和矿物质等营养成分[20-23]。可见,俄色叶具有较高的营养价值。
2 俄色叶的药理作用
对俄色叶药理作用的研究主要集中在治疗肝脏疾病和心血管疾病等领域,如肝损伤、糖尿病、高血脂等。此外,一些研究者亦对俄色叶及其黄酮类成分在抗氧化、抗炎、耐缺氧、抗疲劳方面的药理作用进行了研究。
2.1 降血糖作用
据统计,目前全球糖尿病患病人数仍在不断上升,我国患病人数位居全球第一;同时,糖尿病可引起多种并发症,严重危害人类健康,影响其生活质量[24]。研究发现,俄色叶中的黄酮类化合物可降低由四氧嘧啶或链脲佐菌素所致的糖尿病模型小鼠的血糖、肝糖原、丙二醛(MDA)水平,升高胰岛素、C肽含量和超氧化物歧化酶(SOD)活性,其降血糖机制与改善受损胰岛B细胞的状态和抗氧化能力有关[25-26]。李燕等[27]研究发现,俄色叶中的总黄酮可通过控制肝糖原合成和血清胰岛素分泌来改善四氧嘧啶所致糖尿病模型小鼠的血糖水平。赵军宁等[28]发现,变叶海棠的醇提物能降低糖尿病模型小鼠的空腹血糖,但对正常动物无明显影响。任军辉等[29]研究发现,俄色叶水提物能降低糖尿病模型小鼠的血糖水平,有效恢复其体质量,且这种降糖作用与抗氧化应激反应有关;同时,该水提物对小鼠的肝功能无影响。罗园等[30]研究发现,变叶海棠醇提物可有效降低链脲佐菌素所致糖尿病模型小鼠的血糖水平,其作用机制可能与改善胰岛细胞损伤,抑制细胞凋亡,促进胰岛素分泌,改善胰岛素抵抗、糖代谢和脂质代谢有关。孟宁[31]的研究指出,俄色叶醇提物对高糖诱导的脐静脉内皮细胞损伤具有保护作用,发现其能改善内皮细胞的损伤,缓解糖尿病诱发的血管病变。
2.2 降血脂作用
俄色叶醇提物和根皮苷均具有较好的降血脂活性,且根皮苷能显著抑制胆固醇合成限速酶——羟甲基戊二酰辅酶A(HMG-CoA-R)的表达并促进细胞色素P450家族成员7A1(CYP7A1)酶的表达,从而降低血清总胆固醇的水平[32]。毛羽等[33]研究发现,俄色叶醇提物能显著降低高血脂模型大鼠血清中胆固醇、三酰甘油的水平,说明俄色叶醇提物具有降血脂的作用。Huang S等[34]通过探讨俄色叶醇提物对高血脂模型大鼠血脂水平的影响,发现其具有降血脂作用,其机制可能与增强SOD和谷胱甘肽过氧化物酶(GSH-Px)活性、降低MDA的含量有关。
2.3 保肝作用
夏冬梅[35]研究发现,俄色叶能明显降低四氯化碳(CCl4)诱导急性肝损伤小鼠的丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)及MDA水平,增强SOD活性,抑制肝损伤。周海玉[22]采用MTT法观察俄色叶醇提物对CCl4诱导损伤的人肝正常细胞HL-7702的影响,发现俄色叶醇提物能通过显著降低乳酸脱氢酶(LDH)、ALT、AST水平,升高SOD活性而发挥保肝作用,提示保护作用可能与清除自由基、增强抗氧化酶活性,以及抑制脂质过氧化有关。曾俊等[36]研究证明,俄色叶醇提物对小鼠酒精性肝损伤具有保护作用,其作用机制可能与调节肝功能、清除氧自由基等有关。
2.4 抗氧化应激作用
Fan ZF等[16]采用铁离子还原/抗氧化能力(FRAP)法、1,1-二苯基-2-三硝基苯肼(DPPH)法、2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)法评价了俄色叶醇提物的抗氧化作用,发现与空白组比较,其能升高FRAP值、DPPH自由基清除率,降低ABTS自由基的半数抑制浓度(IC50)(P<0.05)。此外,有研究者通过DPPH法和芬顿(Fenton)反应法测定了变叶海棠醇提物的抗氧化能力,发现变叶海棠能升高DPPH自由基和羟基自由基清除率[11,36]。Huang S等[34]研究发现,俄色叶醇提物能升高大鼠SOD、GSH-Px活性,降低MDA水平,具一定的抗氧化作用。Fan ZF等[16]利用过氧化氢(H2O2)诱导了人HepG2细胞氧化应激模型,评价了俄色叶不同提取部位清除细胞内活性氧(ROS)的能力,发现俄色叶不同提取部位对H2O2诱导的HepG2细胞氧化应激损伤有明显的预防作用,尤其是俄色叶正丁醇部位能显著抑制H2O2诱导的HepG2细胞内ROS的产生,减少细胞凋亡,减轻氧化应激损伤,进而产生保护细胞的作用。
2.5 降血压作用
有研究者观察了俄色叶不同提取部位对大鼠离体胸主动脉血管环张力的影响,发现其对基础状态的血管环无影响,但对氯化钾预收缩的血管环均有不同程度的舒张作用,尤以俄色叶正丁醇部位的舒张作用最强,提示其降血压效果显著[37-38]。
2.6 耐缺氧、抗疲劳作用
毛羽等[33]发现,变叶海棠提取物能延长小鼠在常压缺氧环境下的存活时间;同时,还能延长小鼠亚硝酸钠中毒、急性脑缺血性缺氧的存活时间,说明该提取物有耐缺氧、抗疲劳的功效。
2.7 抗炎作用
常柄权等[39]研究发现,变叶海棠的总黄酮对脂多糖诱导巨噬细胞RAW264.7引起的炎症反应有明显的抑制作用,且呈现剂量依赖关系;其作用机制可能与其抑制炎症因子一氧化氮(NO)、白细胞介素6(IL-6)、IL-1β和肿瘤坏死因子α(TNF-α)的释放有关。
2.8 其他作用
汪鋆植等[40]采用MTT法觀察了俄色叶醇提物和根皮苷对人乳腺癌MCF-7细胞及人乳腺癌MDA-MB-231细胞增殖的影响,发现其具有双向调节雌激素的作用,其作用机制主要是促进MDA-MB-231细胞与雌激素受体β结合,从而对雌激素和抗雌激素产生双向调节。另外,俄色素具有很好的抗菌作用,尤其是对金黄色葡萄球菌的抑制效果显著[20]。
3 结语与展望
本文对近20年有关俄色叶化学成分及药理作用的研究进行综述。目前,从俄色叶中仅分离鉴别出黄酮、酚酸、芳香类化合物,共26种;具有降血糖、降血脂、保肝、抗氧化、耐缺氧、抗疲劳、抗炎、抗菌等作用。通过对俄色叶相关研究文献的梳理发现,现有化学成分的研究较浅,其现代药理作用与传统功效仅部分相关,且尚无物质基础的相关报道。
目前,俄色叶中已分离出咖啡酸和对香豆酸,属于羟基肉桂酸类化合物。通过观察羟基肉桂酸类酚酸生物的合成途径,发现咖啡酸经过咖啡酸氧甲基转移酶(COMT)催化甲基化进而合成阿魏酸;在莽草酸生物合成途径中,咖啡酸、对香豆酸、肉桂酸缩合酯化从而形成绿原酸[41]。查阅俄色叶同科属植物相关报道,湖北海棠叶中含有咖啡酸、绿原酸、隐绿原酸[13]。药理研究亦表明,阿魏酸和绿原酸在抗氧化、降血脂、抗菌消炎、降血糖、降血压、保护血管和中枢神经、保肝中表现出良好活性[42-44],这与俄色叶的现代药理研究活性相符。尖嘴林檎[9]、垂丝海棠[45]、三叶海棠叶[46]中均含有熊果酸和齐墩果酸,表现出广泛的生物活性[47];这些化合物的药理作用与俄色叶的传统功效及临床应用有一致性,尤其是与保肝利胆联系紧密。尖嘴林檎、垂丝海棠中含有β-谷甾醇,在传统医学中用于治疗创伤、高血压、消化不良[48],与俄色叶的临床应用相似。因此,根据化合物在植物体中次生代谢途径、化合物结构性质、同科属植物亲缘关系及药效活性,可以推测俄色叶中可能含有阿魏酸、绿原酸、新绿原酸、隐绿原酸、熊果酸、齐墩果酸和β-谷甾醇等化合物。目前,笔者对俄色叶中有关这几种成分的研究已取得一定进展,将进一步对其进行分离鉴定。
中药功效和药理作用是从不同角度对中药治疗效果的描述,明确两者间的联系可为中药的临床应用与现代研究奠定基础[49]。《藏药晶镜本草》[5]记载,俄色叶具有攻坚化积、除腻涤滞、保肝利胆等功效;现代药理研究表明,其具有降血脂、保肝、抗氧化等作用。目前,俄色叶的现代药理作用仅与其传统功效中的保肝利胆有相关性,因此可根据俄色叶具有的攻坚化积、除腻涤滞的功效,进一步研究其在消化系统,尤其是胃肠道方面的药理作用。现代研究表明,俄色叶中根皮苷和根皮素在降血糖、抗氧化、保肝、抗衰老中表现出较好的药效活性[11,48,50]。临床上用于治疗糖尿病的药物,在降血糖的同时均会引发不同程度的不良反应并产生耐药性[51-53],且对并发症疗效不佳,而中药在糖尿病防治方面的历史悠久。众多案例显示,中药不仅对糖尿病起到一定的预防作用,并且对糖尿病及其并发症也有明显的治疗效果[54]。俄色叶不但绿色无污染,还符合《中药材生产质量管理规范》的要求,对糖尿病及其并发症效果好、不良反应少,因此可研究其作为糖尿病化学药的补充药物或替代药物[55]。
目前,研究者对俄色叶的药效成分研究集中于粗提物上,仅对根皮苷和根皮素略有研究。俄色叶中已分离出多种药理活性化合物,例如槲皮素在抗氧化、抗炎、肝细胞保护、糖尿病肾脏保护中显示出良好的药效活性[56];金丝桃苷在保肝、心脑血管保护、抗炎、抗肿瘤方面的效果良好[57]。可见,俄色叶仍存在许多潜在的药效成分,在进行俄色叶的药效物质基础研究和开发新的药效作用时,可重点关注槲皮素和金丝桃苷。目前,学者在进行俄色叶药效物质基础研究时尚未涉及体内化学成分变化,因此应注意其潜在药效成分在体内的作用过程,促进俄色叶在药动学和临床应用方面的研究,以期开发出新的制剂或产品以满足临床的需要,为更好地利用俄色叶资源提供理论依据。
参考文献
[ 1 ] 四川省食品药品监督管理局.四川省藏药材标准[S].2014年版.成都:四川科学技术出版社,2014:123-124.
[ 2 ] 贡布,占堆.发展藏医藏药,振兴民族医药产业[J].中国民族民间医药杂志,2005,114(2):63-64.
[ 3 ] 宇妥·云丹贡波.四部医典[M].上海:上海科学技术出版社,1987:55-59.
[ 4 ] 帝玛尔·丹增彭措.晶珠本草[M].北京:民族出版社,1986:222.
[ 5 ] 嘎务.藏药晶镜本草[M].北京:民族出版社,1995:153.
[ 6 ] 钱柯成,刘连芬.西府海棠(Malus micromalus)总黄酮提取及微乳液薄层分析[J].聊城大学学报(自然科学版),2015,28(2):46-49.
[ 7 ] 党娟丽,郭东艳,王露,等.一测多评法测定湖北海棠叶中5种黄酮的含量[J].中成药,2017,39(8):1733-1736.
[ 8 ] 卢静.林檎叶化学成分的分离及其提取物的抗菌、抗氧化活性研究[D].重庆:重庆大学,2014.
[ 9 ] 王道清.藏药“俄色”的生药学研究[D].成都:成都中医药大学,2012.
[10] 温馨,田甜,沈悦,等.超声波辅助提取变叶海棠中总黄酮工艺优化及抗氧化活性研究[J].天然产物研究与开发,2016,28(3):452-456.
[11] 王睿,吴飞,赵春草,等.根皮苷的分离纯化及药理研究进展[J].中华中医药杂志,2019,34(4):1605-1608.
[12] 常柄权.俄色叶总黄酮的分离纯化及抗炎活性研究[D].青岛:青岛科技大学,2019.
[13] 谭哲谞.湖北海棠化学成分的研究[D].北京:北京协和医学院,2018.
[14] 杨威,衣振,何亮亮,等.俄色茶的化学成分研究[J].云南民族大学学报(自然科学版),2017,26(4):270-273.
[15] 张磊.花叶海棠叶片主要成分分析与评价[J].防护林科技,2018,36(4):36-38.
[16] FAN ZF,WANG YD,YANG ML,et al. UHPLC-ESI- HRMS/MS analysis on phenolic compositions of different E Se tea extracts and their antioxidant and cytoprotective activities[J]. Food Chem,2020. DOI:10.1016/j.foodchem.2020.126512.
[17] 汪鋆植,張宏岐,邹坤,等.海棠提取物在制备保肝药物或保健食品中的用途:中国,CN101683411A[P]. 2010- 03-31.
[18] 林鹏飞,贾小舟,祁燕,等.酚酸类化合物研究进展[J].广东化工,2017,44(1):50-52.
[19] 李启发,夏柯,文焕松,等.从藏药俄色中提取分离的化合物及其方法和用途:中国,CN201410573928.9[P]. 2015- 03-25.
[20] 王海英,徐庆,柴成忠,等.川西2种高山海棠果实和叶片的营养成分[J].林业科学,2010,46(8):157-161.
[21] 王启和,孙鹏,刘志斌,等.花叶海棠表型性状变异的研究[J].林业科技开发,2006,20(3):27-30.
[22] 周海玉.藏药“俄色”不同部位的化学成分分析及保肝活性评价研究[D]. 成都:成都中医药大学,2016.
[23] 曾俊.藏药“俄色”不同药用部位化学成分与HPLC指纹图谱及抗高血压、高血脂活性评价研究[D].成都:成都中医药大学,2018.
[24] 权威发布:数据“说”糖尿病[J].实用心脑肺血管病杂志,2019,27(7):7.
[25] LI D,PENG C,XIE X,et al. Antidiabetic effect of flavonoids from Malus toringoides(Rehd.)Hughes leaves in diabetic mice and rats[J]. J Ethnopharmacol,2014,153(3):561-567.
[26] 李丹,彭成,谢晓芳,等. 藏药俄色不同提取物降血糖作用比较[J]. 中国实验方剂学杂志,2013,19(21):208- 212.
[27] 李燕,谢晓芳,李丹,等.俄色总黄酮对糖尿病的药理作用研究[J].中外医疗,2013,32(14):25-27.
[28] 赵军宁,华桦,杨安东,等.蔷薇科苹果属植物或其提取物的新用途:中国,CN104208204A[P]. 2014-12-17.
[29] 任军辉,索朗欧珠,邵妍丽,等.俄色叶水提物对糖尿病模型小鼠降血糖作用的研究[J].食品研究与开发,2018,39(21):27-32.
[30] 罗园,华桦,曾安琪,等.变叶海棠提取物对链脲佐菌素所致糖尿病小鼠的作用研究[J].中药药理与临床,2020,36(1):115-120.
[31] 孟宁.俄色提取物对高糖环境下脐静脉内皮细胞的保护作用及其机制研究[D].青岛:青岛科技大学,2019.
[32] 申婷婷,花尔并,马娜,等.根皮苷对饲喂高脂高胆固醇饲料仓鼠肝脏中胆固醇代谢调控基因表达的影响[J].营养学报,2014,36(2):159-163.
[33] 毛羽,吴永康,冯豫川.苹果属花楸苹果组植物的新用途:中国,CN200810170831.8[P]. 2009-04-22.
[34] HUANG S,LIU H,MENG N,et al. Hypolipidemic and antioxidant effects of Malus toringoides(Rehd.) Hughes leaves in high-fat-diet-induced hyperlipidemic rats[J]. J Med Food,2017,20(3):258-264.
[35] 夏冬梅.藏药“俄色叶”的质量标准研究[D].成都:成都中医药大学,2014.
[36] 曾俊,杨瑞山,蔡晓洋,等.俄色叶提取物对小鼠急性酒精性肝损伤的保护作用[J].食品工业科技,2017,38(13):311-314.
[37] 何刚.俄色叶及其提取物在制备降压药物中的用途:中国,CN201810856386.4[P]. 2018-12-18.
[38] 毛羽,冯豫川,吴永康,等. 1种预防高原反应的胶囊剂及其制备方法和用途:中国,CN200810166068.1[P]. 2009- 04-22.
[39] 常柄权,李斌,袁瑞瑛,等.变叶海棠叶总黄酮的分离纯化及体外抗炎活性[J].精细化工,2019,36(6):1149-1158.
[40] 汪鋆植,薛冰洁,叶红,等.海棠提取物及根皮苷的新用途:中国,CN201010192929.0[P].2010-12-01.
[41] 陈志杰,吴嘉琪,马燕,等.植物食品原料中酚酸的生物合成与调控及其生物活性研究进展[J].食品科学,2018,39(7):321-328.
[42] 梁娜,孙少平,罗跃娥,等.阿魏酸的研究进展[J].黑龙江中医药,2009,38(3):39-40.
[43] 严永旺,肖兰,周旭,等.绿原酸的药理作用及药用研发对策[J].中国药房,2017,28(19):2729-2732.
[44] 席利莎,木泰华,孙红男.绿原酸类物质的国内外研究进展[J].核农学报,2014,28(2):292-301.
[45] 冯发进.垂丝海棠活性成分研究[D].贵阳:贵州大学,2015.
[46] 赵良忠,段林东,刘放求.三叶海棠营养成份研究[J].邵阳高专学报,1996,9(3):262-263.
[47] 张明发,沈雅琴.熊果酸和齐墩果酸的泌尿系药理作用研究进展[J].药物评价研究,2016,39(2):308-316.
[48] 刺芹中提取的植物甾醇成分对急、慢性炎症的抗炎作用研究[J].国外医学:中医中药分册,2000,22(1):40-41.
[49] 任钧国,王冬芝,雷蕾,等.中药传统功效与现代药理作用之间关系的分析[J].中国中药杂志,2017,42(10):1979- 1983.
[50] 冯甜,王力彬,周楠,等.根皮素的研究进展[J].转化医学杂志,2017,6(1):42-46.
[51] 郝鑫菊,罗艳,刘京伟,等.二甲双胍不良反应及合理用药[J].河北医药,2016,38(4):603-606.
[52] 刘晓丹,李焱.格列奈类药物的疗效与安全性综合评价[J].药品评价,2015,12(13):16-18.
[53] 張红霞.口服降糖药物不良反应研究进展[J].天津药学,2017,29(2):75-78.
[54] 田佳星,赵林华,连凤梅,等.中医药防治糖尿病研究进展述评[J].中医杂志,2015,56(24):2093-2097.
[55] 林灵敏,毛羽,王逍遥,等.俄色药材的农药残留和重金属含量检测研究[J].西南民族大学学报(自然科学版),2017,43(2):149-156.
[56] 马纳,李亚静,范吉平.槲皮素药理作用研究进展[J].辽宁中医药大学学报,2018,20(8):221-224.
[57] 杨诗婷,王晓倩,廖广辉.金丝桃苷的药理作用机制研究进展[J].中国现代应用药学,2018,35(6):947-951.
(收稿日期:2020-06-04 修回日期:2020-08-03)
(编辑:罗 瑞)
