敲低和敲除OPTN基因SKOV3细胞的构建及其对抗癌药物敏感性的影响
2020-10-19郭若文秦宜德
王 鹏,陈 曦,徐 恰,刘 会,郭若文,刘 芸,许 尹,秦宜德
卵巢癌是临床上常见的妇科恶性肿瘤,死亡率位于妇科恶性肿瘤首位[1],由于化疗药物的使用会使患者产生耐药性导致临床上治疗效果不理想,临床需要更加有效的治疗方案。研究[2]表明OPTN基因在诱导细胞凋亡方面起着重要的作用,OPTN蛋白通过激活细胞因子介导细胞的凋亡,其中肿瘤坏死因子(tumor necrosis factor, TNF)-α超家族成员(factor associated suicide, Fas)在细胞凋亡信号通路中起着重要作用。Fas是一种I型跨膜糖蛋白通过与三聚化的Fasl结合而被激活,激活后的Fas可以通过下游的接头蛋白FADD与caspase8蛋白形成死亡诱导复合物(death inducing signaling complex,DISC),DISC激活下游的caspase3引发细胞凋亡[3],同时DISC还催化Bcl-2家族成员Bid前体,形成截断型激活型Bid(turn-cated Bid,tBid),激活的tBid转位到线粒体触发Bax和Bax同源寡聚作用启动细胞色素C的释放启动细胞凋亡[4],降低卵巢癌细胞对化疗药物的敏感性。
1 材料与方法
1.1 材料
1.1.1细胞株、菌株、质粒载体 本实验所使用的SKOV3细胞、293 T细胞均由本实验室所保存;TOP 10感受态细胞购自北京天根生化科技有限公司;敲除质粒PX 459、包装质粒psPAX 2和pMD 2.G由本实验室保存;慢病毒质粒pGPU 6_GFP_Neo购自上海吉凯基因化学技术有限公司。
1.1.2主要试剂 顺铂注射液购自山东齐鲁制药有限公司;MTT购自美国Promega公司;TRIzol购自美国Thermo Fisher公司;质粒提取试剂盒购自上海碧云天公司;逆转录试剂盒PrimeScriptTMRT、Mix Taq酶购自日本Takara公司;PCR引物由上海生工生物工程技术服务有限公司提供;β-actin鼠抗人抗体购自北京中杉金桥生物技术有限公司;caspase3、Bax、Bcl-2抗体购自武汉博士德生物有限公司。
1.2 方法
1.2.1细胞培养 人卵巢癌细胞SKOV3用DMEM(10%胎牛血清+双抗)培养基置于37 ℃、5% CO2的培养箱中,观察细胞待细胞长满培养瓶70%~80%时,用0.4%的胰蛋白酶消化,用于传代、冻存或其他实验。
1.2.2慢病毒的构建及包装 OPTN特异性shRNA序列选自Sigma网站从中选取序列,sgRNA从http://crispr.mit.edu/网站设计得到,由上海生工生物有限公司合成。见表1。将退火后的引物与酶切后的载体连接,转化TOP 10大肠杆菌、挑选阳性克隆、提取质粒由上海生工生物有限公司测序验证。取成功构建的重组载体分别和包装质粒(psPAX 2、pMD 2.G)共转染293 T细胞,转染前将细胞培养基换成不含血清的DMEM。转染后混合培养8 h更换含10%血清的DMEM培养基载体带有绿色荧光基因,48 h后观察转染效率。转染后48、72 h,3 000 r/min 离心15 min收集含有病毒的上清液,-80 ℃储存、备用。

表1 shRNA和sgRNA的序列
1.2.3病毒滴度的测定 滴度测定使用的是Cell Bio Labs’Quick Titertm慢病毒滴度试剂盒,测定前将293 T细胞消化并铺入96孔板里100 μl每孔,每个病毒设置10个孔。感染当日将病毒上清液在EP管里做10个10倍梯度稀释。弃去培养基,加入病毒液100 μl/孔,24 h后加入100 μl/孔新鲜培养液。72 h后观察并计数。病毒滴度(TU/ml)=荧光细胞个数×稀释倍数/病毒体积(ml)。
1.2.4慢病毒感染SKOV3细胞及稳定敲低株和敲除株的筛选 接种状态良好的SKOV3细胞到6孔板中,密度在60%~80%,待细胞贴壁后,按照病毒定量结果加入病毒上清液。6 h后更换完全培养基,转染48 h后加入新霉素2.2 μg/ml(敲低)和2.5 μg/ml的嘌呤霉素(敲除)继续筛选培养两周至单克隆细胞群的形成。
1.2.5敲减和敲除OPTN基因的检测 在NCBI上找到OPTN基因的全序列,在OPTN基因的第一个外显子区域上的sgRNA靶点上下游进行设计引物。设计的引物序列为F:5′-CTGCCGCCCGGCTTGGC-3′, R: 5′-GGCGCGGGCAGGGAGCG-3′,扩增产物大小为220 bp。β-actin序列为F: 5′-CGGGAAATCGTGCGTGAC-3′, R:5′-TGGAAGGTGGACAGCGAGG-3′,扩增产物大小为434 bp。提取细胞中的RNA逆转录成cDNA进行敲减OPTN的鉴定;提取细胞中基因组DNA并根据引物序列进行敲除OPTN在基因组DNA水平上的鉴定。
1.2.6MTT检测顺铂(cisplatin,DDP)对4组细胞增殖的影响 细胞消化后制成细胞悬液按照每孔5 000细胞接种96孔板中培养过夜。分为4组细胞加药:WT组(正常对照组)、NC组(非特异性转染组)、sh组(特异性转染敲低组)、KO组(敲除组)。浓度设置为1、2、4、8、16、32 μmol/L的DDP,每组设置5个复孔,培养48 h后每孔加入20 μl的MTT温箱继续孵育4 h,用酶标仪检测各孔490 nm的吸光度(optical density,OD)值(OD490nm),以正常对照组计算用药组的生长抑制率。计算公式为:抑制率(%)=(1-OD实验组/OD正常对照组)×100%。
1.2.7qRT-PCR法检测Bax、Bcl-2、caspase3的mRNA的表达情况 培养卵巢癌细胞,分为4组:WT+DDP(IC50)组、NC+DDP(IC50)组、sh+DDP(IC50)组、KO+DDP(IC50)组。培养48 h使用TRIzol提取细胞中总RNA,DEPC水溶解-80 ℃保存。使用Thermo试剂盒进行逆转录得到cDNA,用ABI 7500型定量PCR仪检测。所有引物均由上海生工生物技术有限公司合成,见表2。SYBR Green PCR 试剂盒被用来进行qPCR,qPCR反应体系10 μl为:SYBR Premix Ex TaqII(2×)5 μl,上/下游引物各0.5 μl,cDNA 2 μl,RNase Free dH2O 2 μl。反应条件为:95 ℃、30 s;95 ℃、5 s;60 ℃、30 s。每个基因的相对表达采用2-ΔΔCt法进行分析。

表2 引物的序列
1.2.8Western blot法检测Bax、Bcl-2、Procaspase3、Cleaved-caspase3的蛋白的表达情况 将培养的卵巢癌细胞分为4组:WT+DDP(IC50)组、NC+DDP(IC50)组、sh+DDP(IC50)组、KO+DDP(IC50)组。
培养48 h后收集细胞总蛋白,经12%的SDS-PAGE凝胶电泳,转至PVDF膜,按顺序孵育抗体[Bax、Bcl-2、Procaspase3、Cleaved-caspase3一抗(1 ∶2 000),辣根酶标记的山羊抗兔二抗(1 ∶10 000)],显色并进行灰度值的分析。

2 结果
2.1 成功构建pGPU 6_GFP_Neo-shOPTN、pGPU 6_GFP_Neo-NC慢病毒质粒及PX 459敲除质粒经酶切后的pGPU 6_GFP_Neo和PX 459质粒与退火后的shRNA和sgRNA连接产生重组质粒载体转化大肠TOP 10大肠杆菌,长出克隆后提取质粒,由上海生工生物技术有限公司测序证实插入序列正确,说明成功构建载体。见图1。

图1 重组质粒的测序结果
2.2 SKOV3细胞中敲低前后OPTN基因的表达量的变化将经筛选得到的细胞株使用TRIzol提取细胞中总RNA。使用Thermo试剂盒进行逆转录得到cDNA并根据设计的引物序列进行RT-PCR,产物经3%的琼脂糖凝胶电泳分离,并用凝胶成像系统分析。图2显示sh组的OPTN基因的表达量低于WT组和NC组。

图2 RT-PCR检测SKOV3细胞中敲低OPTN的基因表达量的变化A: OPTN基因表达量的变化;B: β-actin的表达量;1:WT组;2:NC组;3:sh组;M:Marker
2.3 SKOV3细胞中敲除OPTN在基因组DNA水平上的验证将经筛选后的敲除组SKOV3细胞利用天根生化科技公司的细胞基因组DNA的提取试剂盒,按照其说明书提取SKOV3细胞的基因组DNA,根据设计的引物序列进行PCR验证。结果显示与WT组相比KO组没有P出条带,说明在靶点附近的DNA片段被敲除。见图3。

图3 敲除OPTN在基因组DNA水平上的鉴定A:OPTN基因DNA的PCR结果;B:β-actin的PCR结果;1、2:WT组;3、4:KO组;M:Marker
2.4 SKOV3细胞中敲减和敲除OPTN的蛋白检测提取经新霉素筛选2周后的慢病毒感染的敲低株SKOV3细胞总蛋白。提取由慢病毒感染的SKOV3细胞并由嘌呤霉素筛选后获得的敲除株单克隆细胞株的总蛋白。并用Western blot法分析结果显示在蛋白水平上敲低的sh组OPTN蛋白的表达量相对于WT组和NC组降低,差异有统计学意义(F=132.13,Mean1=1.137,Mean2=1.104,Mean3=0.3062,SD=0.38,P<0.01)。KO组与WT组相比OPTN蛋白不表达。因此成功构建稳定的敲低和敲除OPTN基因的SKOV3细胞株。见图4。

图4 Western blot检测SKOV3细胞中OPTN蛋白的表达A:敲减;B:敲除;1:WT组;2:NC组;3:sh组;4、5:WT组;6、7:KO组;与WT组比较:**P<0.01
2.5 OPTN对DDP抑制SKOV3细胞增殖的影响使用1、2、4、8、16、32 μmol/L浓度的DDP作用于人SKOV3细胞48 h,MTT检测细胞生长的抑制率,得出WT、NC、sh、KO 4组细胞的IC50值分别为1.903、1.82、3.369、3.613 μmol/L。MTT检测结果也显示sh组和KO组的细胞抑制率明显低与WT组和NC组,差异有统计学意义(FWT=16.546,FNC=17.76,Fsh=26.65,FKO=28.75;MeanWT=62.06,MeanNC=62.89,Meansh=40.44,MeanKO=34.04;SDWT=27.27,SDNC=26.47,SDsh=29.16,SDKO=29.07;P<0.05或P<0.01),见图5,显示OPTN增加SKOV3细胞对DDP抑制的敏感性。

图5 OPTN对DDP抑制SKOV3细胞增殖的影响与WT组比较:*P<0.05,**P<0.01
2.6 OPTN对Bax、Bcl-2、caspase3的mRNA表达的影响qRT-PCR检测结果显示,OPTN蛋白的sh和KO组,与WT组相比,Bax、caspase3表达量降低,Bcl-2表达量升高,差异有统计学意义(Fcaspase3=53.07,FBax=25.18,FBcl-2=35.50,Meancaspase3=0.7442,MeanBax=0.7668,MeanBcl-2=0.666 6;SDcaspase3=0.18,SDBax=0.23,SDBcl-2=0.12;P<0.05或P<0.01),见图6。

图6 qRT-PCR检测caspase3、Bax、Bcl-2的mRNA表达量1:caspase3;2:Bax;3:Bcl-2;与WT组比较:*P<0.05,**P<0.01
2.7 OPTN对Bax、Bcl-2、Procaspase3、Cleaved-caspase3的蛋白表达影响Western blot检测结果显示,与对照组相比,OPTN蛋白的敲低和敲除组Bax、caspase3蛋白表达量降低,Bcl-2蛋白表达量升高,差异有统计学意义(FCleaved-caspase3=27.15,FProcaspase3=21.09,FBax=36.48,FBcl-2=29.76;MeanCleaved-caspase3=0.556,MeanProcaspase3=0.754,MeanBax=0.638,MeanBcl-2=1.244;SDCleaved-caspase3=0.113,SDProcaspase3=0.127,SDBax=0.106,SDBcl-2=0.197;P<0.05或P<0.01),见图7。
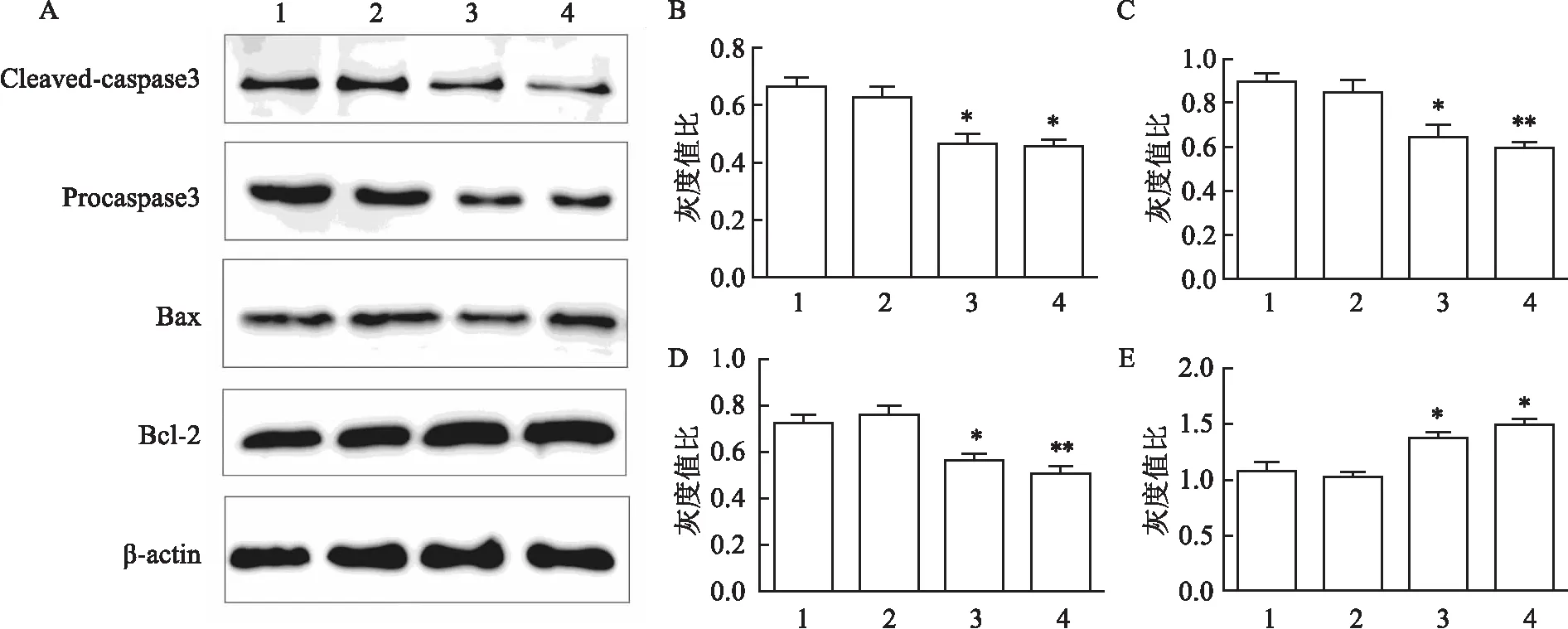
图7 Western blot检测Cleaved-caspase3、Procaspase3、Bax、Bcl-2的蛋白表达量A:蛋白表达量的变化;B:Cleaved-caspase3的蛋白柱状分析图;C:Procaspase3的蛋白柱状分析图;D:Bax的蛋白柱状分析图;E:Bcl-2的蛋白柱状分析图;1:WT组+DDP(IC50);2:NC+DDP(IC50);3:sh+DDP(IC50);4:KO+DDP(IC50);与WT+DDP(IC50)组比较:*P<0.05,**P<0.01
3 讨论
RNA干扰技术是指外源或者内源性双链RNA(dsRNA)与细胞同源mRNA序列结合,诱导转录后基因的沉默,阻断靶基因的表达。dsRNA进入细胞后被核酸内切酶Ⅲ(Dicer)切割成21~23 nt的双链小干扰RNA即siRNA[5],siRNA与体内解旋酶及其他因子结合形成复合物即RNA诱导沉默复合物(RNA-induced silencing complex,RISC)[6]。RISC具有核酸酶的功能利用siRNA反义链切割靶mRNA,导致靶mRNA降解[7-8]。本实验采用了RNA干扰技术对SKOV3细胞OPTN基因进行敲低,并成功获得了稳定敲低OPTN蛋白的SKOV3细胞株[9]。
CRISPR/Cas9技术是近年来兴起的一项基因编辑技术,CRISPR/Cas9是一种来自细菌降解入侵病毒DNA或其他外源DNA的免疫机制[10]。Cas9蛋白含有2个核酸酶的结构域,可以分别切割DNA两条单链。Cas9首先与crRNA及tracrRNA结合形成复合物通过PAM序列结合并侵入DNA形成RNA-DNA复合物结构,进而对目的DNA双链进行切割,使DNA双链断裂[11]。细胞会对断裂部分进行修复,在修复的过程中会导致基因的移码突变、替换或删除,致使基因功能丧失[12]。本实验所采用的是CRISPR/Cas9技术对SKOV3细胞OPTN基因进行敲除,根据OPTN基因的外显子设计sgRNA并与表达Cas9蛋白的质粒载体连接,在sgRNA的导向下Cas9识别含有PAM的靶序列并把双链DNA进行断裂达到敲除OPTN蛋白的作用。
OPTN蛋白在卵巢癌细胞中属于高表达蛋白,其在诱导肿瘤细胞凋亡方面起着重要的作用[13-14]。实验显示OPTN可能通过细胞凋亡途径介导细胞的凋亡,使下游凋亡基因Bax、caspase3表达量增加,Bcl-2表达量降低。本实验通过RNA干扰技术和CRISPR/Cas9技术对SKOV3细胞的OPTN基因进行敲低和敲除,结果显示敲低和敲除OPTN基因的细胞不易发生凋亡,对DDP的敏感性降低。这也说明OPTN可以促进抑制SKOV3细胞的增殖,促进SKOV3细胞的凋亡,并使SKOV3细胞对DDP耐药性的下降,具体的耐药性机制还有待进一步的研究。
