HtrA对乳牙高致龋性变异链球菌生物膜形成的影响
2020-10-15徐仕珍杨维虹刘兴容
徐仕珍,杨维虹,毛 玲,刘兴容
龋病的发生发展就是从获得性膜的形成、细菌黏附、牙菌斑生物膜形成到引起牙齿的颜色、形态和质地发生损害性改变,其中牙菌斑生物膜的形成与龋病发生密切相关[1]。变异链球菌(Streptococcusmutans,S.mutans)是造成龋病的最主要的细菌[2],其致龋性毒力作用基础包括产酸和耐酸、定植牙面形成生物膜及合成胞内外多糖能力[3]。高温需要蛋白A (high temperature requirement A,HtrA)是细菌体内的一种热休克蛋白质分子,能够帮助细菌逃避高温、高渗和高氧浓度等环境的变化[4-5]。Gasc et al[6-8]首次在肺炎链球菌中发现了HtrA,并发现其参与控制多种细菌毒力因子的表达。课题组前期实验[9]发现HtrA对变异链球菌的耐酸和黏附有重要调控作用。该实验旨在利用乳牙高致龋性的HtrA基因缺陷株,探讨HtrA的缺失对S.mutans生物膜的影响,为龋病的防治提供新的着手点。
1 材料与方法
1.1 实验菌株乳牙S.mutansHtrA高毒力株与缺陷株由课题组前期获得;S.mutans国际标准株UA159自四川大学华西口腔医学院国家重点实验室获得。
1.2 主要实验试剂MS固体培养基(美国BD公司);BHI培养基(青岛高科技工业园海博生物技术有限公司);甘露糖、蜜二糖、棉子糖、山梨醇、精氨酸双水解酶肉汤细菌微量生化鉴定管、七叶苷培养基(北京陆桥技术有限责任公司)。
1.3 实验方法
1.3.1S.mutans的复苏与培养 UA159标准株、HtrA高毒力株与基因缺陷株复苏经生化鉴定后接种于MS固体培养基,37 ℃厌氧(80% N2、10% H2、10% CO2)培养48 h。
1.3.2S.mutans体外非应激环境下[37 ℃、厌氧(80% N2、10% H2、10% CO2)]的生长曲线测定 挑选3个菌株的单菌落至BHI液体培养基中,37 ℃厌氧培养24 h;离心,弃上清液,无菌生理盐水漂洗,重复3次;加入BHI溶液稀释菌液,调节3组菌悬液使酶标仪测量吸光度(optical density, OD)600=0.05;37 ℃厌氧培养,在2、4、6、8、10、12、14、16 h时每组每管分别吸取100 μl细菌悬液加入96孔板,测定OD600值。
1.3.3S.mutans生物膜结晶紫染色定性分析
1.3.3.1S.mutans菌液浓度的调节 HtrA高毒力株与基因缺陷株菌液各2支,重复步骤1.3.2项使两菌液OD600=1.0,稀释10倍备用。
1.3.3.2S.mutans生物膜体外构建 取5块一次性无菌6孔板,每孔放入预处理的22 mm×22 mm无菌盖玻片一张,每两孔分别加入HtrA高毒力株菌液、HtrA基因缺陷株菌液,BHI液体培养基,每孔5 ml;37 ℃厌氧培养;培养的1、4、8、12、24 h随机取出一块6孔板,做后续染色处理。
1.3.3.3结晶紫染色定性分析 随机取出一块6孔板,吸干菌液,每孔加入PBS 5 ml,漂洗,吸出,重复3次,吸干;甲醇固定15 min,PBS洗净,1%结晶紫染色5 min,取出盖玻片,PBS冲掉多余染液后放于无菌载玻片上,显微镜油镜下观察。
1.3.4S.mutans生物膜扫描电镜观察
1.3.4.1S.mutans菌液浓度的调节 UA159标准株、HtrA高毒力株与HtrA基因缺陷株菌液各1支,重复1.3.2项使3组菌液OD600=1.0为止,稀释10倍备用。
1.3.4.2氧化锆片表面细菌生物膜的培养 一次性无菌24孔板1个,11枚抛光处理过的无菌氧化锆片间隔放入孔内,每孔加入0.5 ml无菌唾液淹没氧化锆片,37 ℃孵育4 h;取出24孔板,去除唾液,于有氧化锆片的孔中每孔加入0.8 ml含10 g/L蔗糖的BHI液体培养基、0.8 ml无菌唾液、200 μl调好浓度的细菌悬液(UA159标准株、HtrA高毒力株与HtrA基因缺陷株各加3个孔,余下2孔加200 μl无菌生理盐水作为空白对照组),37 ℃厌氧培养12 h。
1.3.4.3扫描电镜标本的制作与观察 取出24孔板,无菌生理盐水漂洗,每孔中加入2 ml 2.5%戊二醛溶液,4 ℃固定4 h;吸干,将氧化锆片转入一块新的24孔板内,PBS漂洗2次,15 min/次,乙醇梯度脱水,样本干燥喷金,扫描电镜镜检。
1.3.5S.mutans细菌生物膜结晶紫半定量分析
1.3.5.1S.mutans菌液浓度的调节 与1.3.4.1同。
1.3.5.2S.mutans细菌微孔生物膜的培养 取4块无菌96孔板,加入调配好浓度的菌液200 μl/孔,第一排为HtrA高毒力株,第二排为UA159标准株,第三排为HtrA基因缺陷株,每种菌液设置10个复孔;37 ℃厌氧培养,分别于4、8、12、24 h随机取出一块96孔板,做后续处理。
1.3.5.3结晶紫染色半定量分析 随机取出一块96孔板,PBS洗板3次,吸干,室温干燥30 min;加入1%结晶紫染色液200 μl/孔,静置20 min吸出;PBS漂洗3次,吸干后干燥30 min;加入95%乙醇,200 μl/孔,振荡30 min,测定OD600值。

2 结果
2.1S.mutans菌株生化鉴定结果HtrA高毒力株、HtrA基因缺陷株和UA159标准株均可分解甘露糖、山梨醇、密二糖、棉子糖,水解七叶苷,但不水解精氨酸。
2.2S.mutans菌株体外非应激环境下的生长曲线测定3组S.mutans菌株在体外非应激环境下的生长曲线趋势基本一致,但在细菌增殖的各个阶段,HtrA高毒力株与UA159标准株相对于HtrA基因缺陷株具有更高的细菌浓度(以OD600值计算)。HtrA高毒力株与HtrA基因缺陷株比较,2 h后差异均有统计学意义(P<0.05)。见图1。
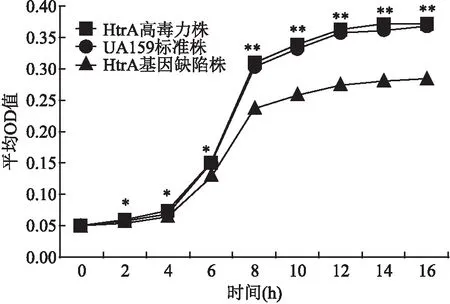
图1 3组菌株生长曲线测定结果与HtrA基因缺陷株比较:*P<0.05,**P<0.01
2.3S.mutans生物膜结晶紫染色定性分析结晶紫染色后油镜下观察24 h,随着时间推移,各菌株密集度逐渐加大。但不同时间段两者细菌密集度不同,HtrA高毒力株密度明显高于HtrA基因缺陷株。见图2。
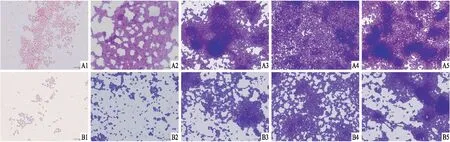
图2 HtrA高毒力株和HtrA基因缺陷株结晶紫染色油镜观察 ×1 000A:HtrA高毒力株;B:HtrA基因缺陷株;1:1 h;2:4 h;3:8 h;4:12 h;5:24 h
2.4S.mutans生物膜扫描电镜观察扫描电镜下观察3个菌株的密度HtrA高毒力株密度最大,UA159标准株稍次之,HtrA基因缺陷株密度最低。见图3。

图3 HtrA高毒力株、UA159标准株和HtrA基因缺陷株扫描电镜下观察A:HtrA高毒力株;B:UA159标准株;C:HtrA基因缺陷株;1:×1 000;2:×10 000
2.5S.mutans细菌生物膜结晶紫半定量分析4、8、12、24 h HtrA高毒力株与HtrA基因缺陷株比较,OD600值差异均有统计学意义(P<0.001)。见表1。

表1 3个菌株不同时间点结晶紫染色OD600值
3 讨论
生物膜是微生物黏附于牙面形成的复合体,是S.mutans赖以生存的微生态环境,它的形成包括两个过程,即早期细菌黏附牙面和后期细菌相互作用、集聚。丝氨酸蛋白酶的HtrA家族分布广泛,在多种细菌、植物及人体内都发现其同系物,这种蛋白酶具有管家蛋白的作用,能降解错误折叠的蛋白质,维持细菌的生理稳态和适应外界应激环境起重要作用[10]。Ahn et al[11]在S.mutans中仅发现一个HtrA基因的存在,并且证明了它不仅是调控S.mutans的生长和耐热性的关键因子,还是调控S.mutans某些基因转录和生物膜形成的关键因子。
Ahn et al[11]证实,HtrA在S.mutans的遗传转化中起着控制生长和反应能力的重要作用。敲除HtrA基因的S.mutans对承受低温和高温,低pH值以及氧化剂和DNA破坏剂的能力降低[5]。HtrA基因的缺失导致S.mutans在37 ℃时缓慢生长,在42 ℃耐热性降低[11]。有研究[12]表明HtrA基因的缺失可以限制细菌的存活能力,在酸性环境下,HtrA突变体的生长速度比野生株大大降低。本实验显示两实验组S.mutans生化鉴定结果与标准株S.mutans相符,说明了HtrA基因并不会对的S.mutans生物学特性和遗传特性造成严重影响。而在体外非应激条件下,两实验组S.mutans菌株的生长曲线趋势与UA159标准株虽然基本一致,但在4 h以后,HtrA高毒力株组与UA159标准株组的菌液浓度均高于HtrA基因缺陷株组,这说明HtrA基因可能并不影响乳牙S.mutans生长的基本趋势,但HtrA基因的缺失会使S.mutans的生长增殖速度降低。实验中扫描电镜下观察到各菌株的生物膜:HtrA高毒力株密度最大,HtrA基因缺陷株密度最低,HtrA缺陷株的生物膜较HtrA高毒力株的生物膜显得粗糙、稀薄,这与结晶紫染色光镜下结果一致,两者相互印证HtrA基因的缺失可降低S.mutans的黏附,使其形成的生物膜松散、稀薄。细菌生物膜结晶紫半定量分析发现HtrA高毒力株生物膜的形成比HtrA基因缺陷株生物膜的形成快且多,差异有统计学意义(P≤0.001),说明HtrA基因的缺失会减缓S.mutans生物膜的形成速度。综上,HtrA基因与细菌生长、应激耐受力、反应能力和生物膜的形成有关。Biswas et al[5]认为HtrA可能影响S.mutans糖酵解有关的细胞外酶从而进一步影响S.mutans生物膜的形成能力,本课题组早期研究[13]表明毒力因子GTFs蛋白和基因在乳牙S.mutansHtrA基因缺陷株中的表达高于HtrA高毒力株,但其生物学活性低于HtrA高毒力株。证实了HtrA基因在乳牙S.mutansGTFs的分泌过程中可有重要的调控作用,GTFs生物学活性的降低直接导致了细胞外葡聚糖的减少,进而减缓了S.mutans在牙面的黏附与生物膜的形成。
总之,HtrA是S.mutans生长、生物膜形成和能力发展的调控网络的组成部分,这将为临床上防龋治疗提供新的方向。
