骨肉瘤中O-GlcNAc糖基转移酶的表达及其对增殖和顺铂敏感性的影响
2020-10-15
海南医学院第一附属医院脊柱骨病外科,海南 海口 570102
骨肉瘤是骨科常见的肿瘤之一,好发于青少年,恶性程度很高,易发生肺转移[1]。当前常用的治疗方法是手术治疗加化疗,但患者术后5年生存率依旧徘徊不前,且在化疗药物的使用过程中常发生耐药[2]。目前,在手术治疗、新的辅助化疗药物及免疫治疗尚未取得巨大突破之前,寻找骨肉瘤治疗的分子靶点及阐明骨肉瘤耐药机制尤为重要。
肿瘤的发生、发展过程中,O-GlcNAc糖基化扮演着重要角色[3-4]。O-GlcNAc糖基化修饰广泛参与细胞周期、基因转录、蛋白质翻译加工及信号转导等多种细胞生命过程[5]。其修饰异常可导致肿瘤、心血管疾病、糖尿病及阿尔茨海默病等多种疾病[6]。已有研究证实,O-GlcNAc糖基转移酶(O-GlcNAc transferase,OGT)在肝肿瘤[7]、胃肠道肿瘤[8]及膀胱癌[9]等肿瘤中高表达,然而在骨肉瘤中的表达及其影响机制的研究却很少。本研究旨在分析骨肉瘤中OGT的表达水平,并观察其对骨肉瘤细胞增殖和顺铂敏感性的影响。
1 材料和方法
1.1 主要试剂
骨肉瘤细胞株U2-OS及MG-63购自中国科学院典型培养物保藏委员会细胞库/中国科学院上海生命科学研究院细胞资源中心,OGT及甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)等抗体购自英国Abcam公司,细胞计数试剂盒(cell counting kit-8,CCK-8)及5-乙炔基-2’脱氧尿嘧啶核苷(5-ethynyl-2’-deoxyuridine,EdU)试剂盒购自广州市锐博生物科技有限公司,流式细胞术凋亡试剂盒购自江苏凯基生物技术股份有限公司,血清、DMEM培养基及胰酶购自德国BI公司,OGT过表达及沉默质粒购自上海吉玛制药技术有限公司。
1.2 组织标本
经海南医学院第一附属医院医学伦理委员会批准,且所有患者知情同意后,收集51例手术切除的肿瘤组织及其相应的癌旁组织,新鲜的组织取下后立即放置于-80 ℃或置于固定液中固定,所有患者均经病理学检查诊断为骨肉瘤,所有患者术前均未接受任何抗肿瘤治疗。
1.3 细胞培养和转染
人骨肉瘤细胞U2-OS及MG-63用含10%胎牛血清的DMEM培养基于37 ℃、CO2体积分数为5%的细胞培养箱中温育。经磷酸盐缓冲液(phosphate-buffered saline,PBS)清洗后,用2.5%的胰酶消化细胞,计数后以每孔5×105个细胞接种于6孔板中。实验分为shOGT质粒组和shNC空转质粒组,过表达OGT组及过表达空转质粒组。待细胞贴壁生长至60%~70%,按照LipofectamineTM3000试剂盒说明,分别将OGT沉默及过表达质粒转染至骨肉瘤细胞中,并检测其转染效率。
1.4 实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)
严格依据试剂盒说明要求,采用TRIzol法提取组织及细胞RNA,并测定其浓度,按照反转录试剂说明,将RNA反转录合成cDNA。取cDNA进行RTFQ-PCR。其条件为:95 ℃预变性10 min;95 ℃ 15 s,60 ℃ 1 min,共40个循环。每个样品设置3个复孔,取平均值。
1.5 蛋白质印迹法(Western blot)
采用RIPA裂解液提取细胞蛋白,组织抽提试剂盒提取组织蛋白,采用BCA法测定蛋白浓度,调节蛋白浓度后添加6×蛋白上样缓冲液,100 ℃水浴10 min使蛋白发生变性。每孔以30 μg蛋白上样,经10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)转膜至PVDF膜,5%脱脂牛奶封闭2 h,添加一抗OGT(稀释比例为1∶1 000),于4 ℃温育过夜,经TBST清洗后,添加二抗(山羊抗兔1∶5 000)室温温育1 h,最后采用凝胶成像系统进行检测并分析。
1.6 免疫组织化学
新鲜的组织标本经4%中性多聚甲醛缓冲液固定,常规进行脱水、浸蜡及石蜡包埋后,将其切成连续4 μm的切片。石蜡切片进行烤片,脱蜡后用柠檬酸钠进行抗原修复,经牛血清白蛋白(bovine serum albumin,BSA)封闭后,滴加以1∶200稀释的OGT抗体,于4 ℃冰箱温育过夜,采用兔二抗常温温育1 h,经二氨基联苯胺(diaminobenzidine,DAB)显色,苏木精复染,中性树胶封片,在荧光显微镜下观察并拍照。
1.7 流式细胞术
按照既定的实验分组,经胰酶消化至肿瘤细胞部分脱落,用移液器轻柔将其吹落,收集细胞沉淀PBS清洗2遍,1 000 r/min离心5 min收集细胞,每孔加入100 μL的缓冲液,分别加入碘化丙啶(propidium iodide,PI)及异硫氰酸荧光素(fluorescein isothiocyanate,FITC)染料,避光温育30 min,上机进行检测。
1.8 CCK-8
骨肉瘤细胞按shNC及shOGT进行分组,经胰酶消化计数后,以每孔1×104个细胞接种于96孔板中,于37 ℃、CO2体积分数为5%的细胞培养箱中温育,于24、48及72 h后每孔加入CCK-8试剂,继续温育2 h,使用酶标仪测定450 nm波长处的吸光度(D)值,每孔设置3个复孔,实验重复3次。
1.9 EdU
骨肉瘤细胞按shNC及shOGT进行分组,取对数生长的骨肉瘤细胞,以每孔1×104个细胞接种于96孔板中,于细胞培养箱中培养24 h,按照EdU试剂说明书,每孔加入50 μL EdU于37 ℃温育2 h,100 μL 4%中性多聚甲醛缓冲液固定30 min,经0.5%Triton-X渗透后加入100 μL Hoechst 33342温育30 min,最后在荧光显微镜下观察骨肉瘤细胞的增殖情况。
1.10 统计学处理
所有数据均采用SPSS 26.0和GraphPad Prism 7.0软件进行分析。采用t检验分析两组间的差异,采用单因素方差分析比较两组间的差异。P<0.05为差异有统计学意义。
2 结果
2.1 骨肉瘤组织中OGT的表达及与预后的关系
为研究OGT在骨肉瘤中的表达,首先通过免疫组织化学法检测骨肉瘤组织及其相应的癌旁组织中OGT的表达水平,结果显示,OGT在64.70%(33/51)的骨肉瘤组织中高表达,而在相应的癌旁组织中仅17.65%(9/51)表达升高(P<0.01,图1A)。进一步通过RTFQ-PCR及免疫印迹法检测骨肉瘤组织及其癌旁组织中OGT mRNA及蛋白水平,结果显示,骨肉瘤组织中OGT mRNA及蛋白水平显著高于相应的癌旁组织(P<0.01,图1B~C)。接下来分析OGT的表达与患者临床病理学特征的关系,结果显示,OGT的表达与患者的年龄、性别、淋巴结转移无明显相关性,而与患者肿瘤的大小及病理学分期密切相关(表1)。最后分析OGT的表达与患者预后的关系,结果显示,高表达OGT的患者预后差(P<0.05,图1D)。以上结果表明,骨肉瘤中OGT的表达水平显著提升且与患者的预后密切相关。
2.2 降低骨肉瘤组织中OGT的表达显著抑制其生长
有研究[10]报道,肿瘤的恶性生长与糖基化转移酶的表达呈正相关。同样,为分析OGT的表达水平与骨肉瘤生长的作用关系,首先采用shRNA沉默骨肉瘤细胞U2-OS中OGT的表达,RTFQ-PCR及Western blot证实OGT下调成功(P<0.01,图2A~B)。接下来通过CCK-8及EdU分析骨肉瘤细胞的生长能力,结果显示,下调骨肉瘤细胞中OGT表达后,其增殖能力明显减弱(P<0.05,图2C~D)。以上结果表明,OGT的表达与骨肉瘤细胞的生长密切相关。
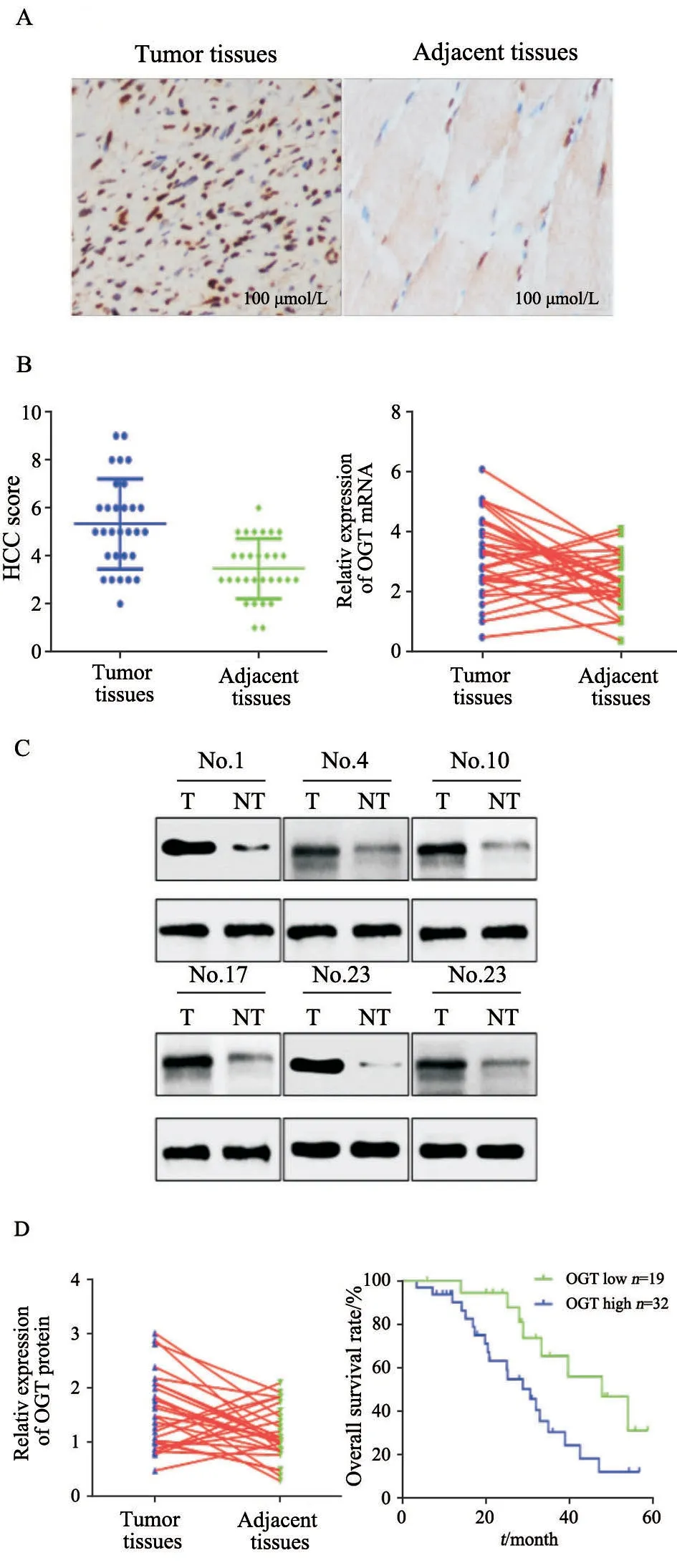
图1 骨肉瘤组织中OGT的表达及与患者预后的关系Fig.1 OGT expression in osteosarcoma tissues and its relationship with patient's prognosis
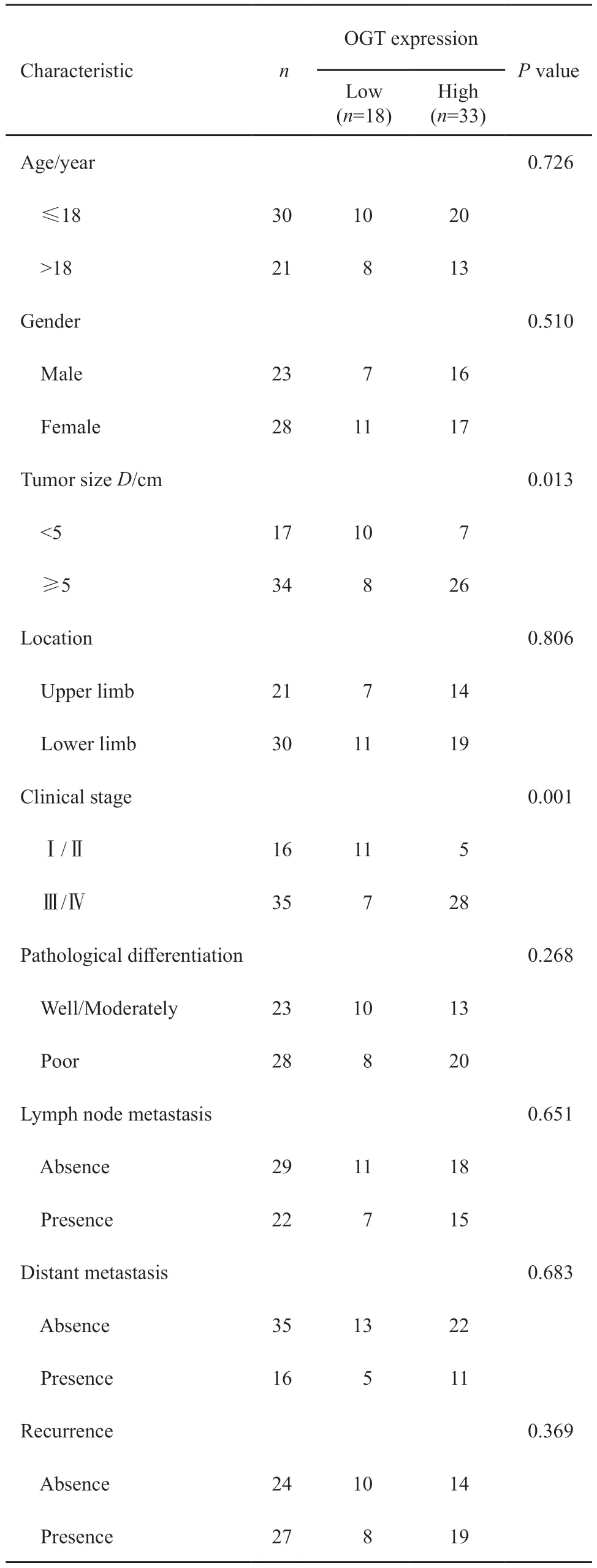
表1 OGT的表达与骨肉瘤患者的临床数据分析Tab.1 Analysis of the relationship between OGT expression and clinical data of osteosarcoma patients
2.3 OGT在顺铂作用的骨肉瘤细胞中高表达
顺铂作为骨肉瘤的常用化疗药物,在肿瘤的治疗中发挥巨大作用。然而骨肉瘤患者常发生顺铂耐药,而其耐药机制尚不完全明确,有研究[11]证实,O-GlcNAc糖基化与肿瘤顺铂耐药密切相关。为证实其机制是否发生于骨肉瘤细胞中,首先采用不同浓度的顺铂作用于骨肉瘤细胞U2-OS及MG-63,采用RTFQ-PCR及Western blot检测OGT蛋白的表达水平,结果显示,随着顺铂作用浓度的升高,骨肉瘤细胞中OGT的表达显著提升(P<0.05,图3A~B)。进一步采用10 μmol/L的顺铂作用于骨肉瘤细胞,结果显示,随着时间延长,骨肉瘤细胞中OGT的表达显著提升,且该作用能够持续48 h(P<0.05,图3C~D)。以上结果表明,顺铂作用于骨肉瘤细胞后,OGT的表达显著提升。
2.4 OGT的与顺铂药物的敏感性相关
为进一步明确OGT在骨肉瘤顺铂耐药中的作用,我们在沉默OGT的骨肉瘤细胞中加入顺铂,采用CCK-8检测细胞活力,结果显示,沉默骨肉瘤细胞中OGT的表达后,其细胞活力明显减弱(P<0.05,图4A~B)。采用流式细胞术检测细胞的凋亡情况,结果显示,沉默骨肉瘤细胞中OGT蛋白的表达,顺铂的敏感性显著增强(P<0.05,图4C~D)。相反,上调OGT的表达,顺铂的敏感性显著减弱(P<0.05,图4E)。
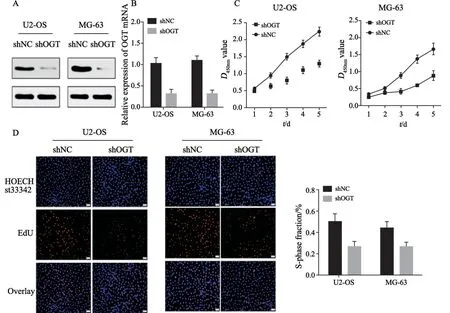
图2 降低骨肉瘤细胞中OGT的表达显著抑制其生长Fig.2 Reducing the expression of OGT in osteosarcoma cells significantly inhibits their growth
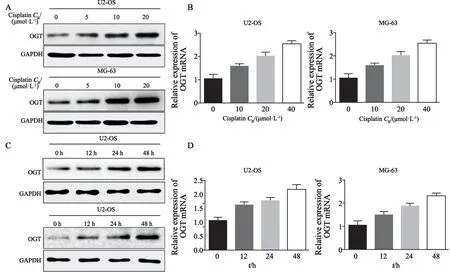
图3 OGT在顺铂作用的骨肉瘤细胞中高表达Fig.3 OGT is highly expressed in osteosarcoma cells treated with cisplatin
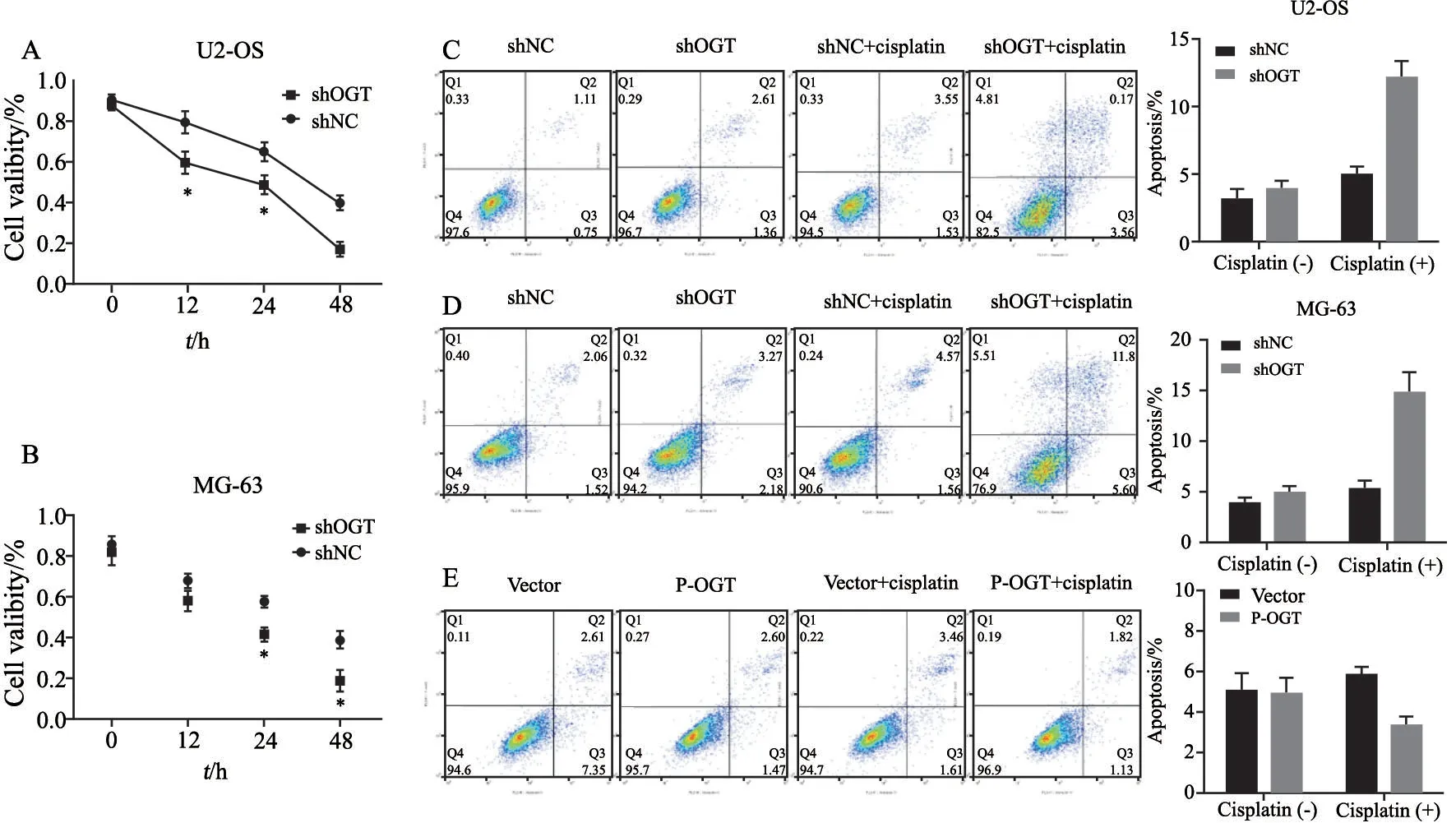
图4 沉默OGT的表达显著增强顺铂的敏感性Fig.4 Silencing OGT expression significantly enhances the sensitivity of cisplatin
3 讨 论
近年来,虽然骨肉瘤的整体治疗水平有了明显提升,但骨肉瘤患者的生存率却依旧不是很高,当前骨肉瘤常用治疗方法仍然是手术治疗和化疗[12]。部分患者容易出现化疗耐药及转移,因此亟待探寻骨肉瘤治疗新的分子靶点和阐明骨肉瘤化疗耐药机制。已有研究[13]证实,肿瘤的发生、发展与原癌基因及抑癌基因异常表达密切相关,O-GlcNAc糖基化在肿瘤的进展过程中扮演着重要角色。有研究证实,在肝癌[14]、乳腺癌[15]及非小细胞肺癌[16]等肿瘤中O-GlcNAc糖基化表达升高,且与患者的预后密切相关,在增殖迅速、发生转移及恶性程度高的肿瘤中,O-GlcNAc糖基化水平较高。抑制肿瘤细胞中O-GlcNAc糖基化水平,其生长及转移发生能力明显减弱,相反细胞的凋亡比例显著上升[17-18]。在骨肉瘤中,尚未见文献报道其生长迅速是否与O-GlcNAc糖基化有关。本研究表明,OGT在骨肉瘤组织中表达升高,且与患者的预后密切相关,在骨肉瘤细胞中沉默OGT的表达后其生长明显被抑制。另外,本研究也证实,OGT在顺铂作用的骨肉瘤细胞中表达水平升高,降低骨肉瘤细胞中OGT的表达后,能够显著增强骨肉瘤细胞对顺铂的敏感性,然而其具体机制仍有待进一步研究。
综上所述,本研究揭示了OGT在骨肉瘤中的表达及其在顺铂耐药中的作用,为骨肉瘤新的靶向治疗及化疗耐药提供了新的理论依据。
